几种因素对白鹤芋组培苗增殖生长的影响
韩 璐, 修景润, 代 月, 廉美兰, 尹光浩, 金美玉*
(1.延边大学农学院,吉林 延吉 133002;2.延边朝鲜族自治州农业科学院,吉林 龙井 133400;3.延边州农业技术推广总站,吉林 延吉 133000)
几种因素对白鹤芋组培苗增殖生长的影响
韩 璐1, 修景润2, 代 月2, 廉美兰1, 尹光浩3, 金美玉1*
(1.延边大学农学院,吉林 延吉 133002;2.延边朝鲜族自治州农业科学院,吉林 龙井 133400;3.延边州农业技术推广总站,吉林 延吉 133000)
为寻找一种简单、低成本及可规模化生产模式,以白鹤芋组培苗单株(2 cm)为外植体,研究不同培养方法、接种量、通气量和糖种类对白鹤芋组培苗生长的影响。结果表明:利用接触式生物反应器培养,有利于白鹤芋丛生芽增殖,组培苗叶色浓绿,鲜重和干重高于其它处理。同时,在接种量60个单株、通气量为0.3 vvm的处理中达到最佳效果。为大规模培养节约成本,糖种类选择了白糖。
白鹤芋;组培苗;接种量;通气量;生物反应器
白鹤芋(Spathiphyllumfloribundum),又名白掌、包叶芋、一帆风顺,属天南星科(Araceae)、白鹤芋属多年生草本植物,原产热带美洲,其中许多种或杂交种是重要热带花卉[1]。其叶片翠绿,花色洁白,非常清新优雅,可以过滤室内废气,是世界重要的观赏花[2]。20世纪初应用于盆栽观赏,到80年代欧洲已十分流行。白鹤芋组织培养研究始于20世纪70年代末[3-4],主要利用芽的外植体获得丛生芽,增殖后生根培养并获得大量植株,其主要目的是满足育种和生产上的需求。快速繁殖白鹤芋的有效途径是进行组织培养,已有的报道中用白鹤芋的茎段,茎尖,叶片和顶芽为外植体都有成功的先例[5-7]。
白鹤芋属植物因花粉退化,正常条件下不结籽,主要为无性繁殖,但繁殖系数低、速度慢,不能满足市场需求。组织培养可以将繁殖系数提高几十倍,加速良种繁育速度,目前,利用组织培养对白鹤芋进行快速繁殖的报道虽有一些,但其结果因其品种不同,仍然存在许多差异[8]。因此,本研究旨在建立一个全新的试验体系,利用生物反应器进行液体培养,研究白鹤芋组培苗增殖的最佳条件,使白鹤芋组培苗的增殖系数更高,弥补固体培养操作繁琐、成本高、周期长的问题,为今后运用生物反应器进行增殖培养和实现白鹤芋组培苗壮苗的大规模生产提供理论依据。
1 材料与方法
1.1 材料
试验材料为白鹤芋组培苗,从韩国忠北大学引进,培养在 MS[9]固体培养基中,进行增殖培养。
生物反应器为本实验室自行研制的气球型气升式生物反应器(3 L),培养基为MS液体培养基。
1.2 方法
1.2.1 不同培养方法对白鹤芋生长的影响
利用3 L气升式球形生物反应器分别进行接触培养及间歇浸没培养,以传统组培的固体培养作为对照。
1) 生物反应器培养 在生物反应器离底部10 cm处架一支持网,使接种的每个外植体单株在支持网上生长。每个反应器均加入MS+BA 2.0 mg/L+NAA 0.3 mg/L+蔗糖30 g/L(pH值5.8)的培养基2.0 L,接入50个单株,培养基中通入0.20 vvm(air volume/culture volume/min)的气体,每个处理接种3个反应器作为重复。
2) 间歇浸没式培养 1 h供应1次培养基,每天供应12次。
3) 接触式培养 为确保外植体在生物反应器的支持网上始终与培养基接触,根据培养基消耗情况,定期补充培养基。
4) 固体培养 在200 mL的PC瓶中,加入25 mL培养基,培养基成分为MS+BA 2.0 mg/L+NAA 0.3 mg/L+琼脂粉8.0 g/L(山东济南普朗特生物科技有限公司),pH值调节为5.8。每瓶接入2个单株,每组处理10瓶,3次重复。培养温度(25±2) ℃,相对湿度70%,光照强度1 600 lx,每天光照16 h,40 d后调查株高、丛生芽数、鲜物重和干物重。
1.2.2 接种量对白鹤芋组培苗增殖生长的影响
在3 L气升式气球型生物反应器内进行接触式培养。接种量设置为每个反应器接入40、50、60和70个单株,培养基通气量调节为0.20 vvm,每个处理重复3次。培养条件及调查方法同1.2.1。
1.2.3 通气量对白鹤芋组培苗增殖生长的影响
3 L反应器内(含2 L培养基)接入60个单株的白鹤芋组培苗(2 cm)进行接触式培养,通气量调节为0.1、0.2、0.3、0.4 vvm,培养基及培养方式同1.2.2,每个处理重复3次。培养条件及调查方法同上1.2.2。
1.2.4 碳源对白鹤芋组培苗增殖生长的影响
在含有2 L培养液的3 L反应器里,通入的空气量调节为0.30 vvm,白鹤芋组培苗的接种量为60个植株,取30 g/L的白糖和蔗糖分别加入MS+BA 2.0 mg/L+NAA 0.3 mg/L,pH值调节为5.8,每个处理重复3次。培养条件及调查方法同上1.2.3。
2 结果与分析
2.1 不同培养方式对白鹤芋组培苗增殖生长的影响
将白鹤芋组培苗分别进行固体培养基培养、间歇式液体培养基培养和接触式液体培养基培养,分别培养40 d后进行白鹤芋组培苗增殖情况的调查。结果发现,在接触式生物反应器中可生长出大量的单株外植体丛生芽,而且生长速度较快,状态良好。
由表1可知,在接触式生物反应器中可生长出大量的白鹤芋组培苗,获得了株高6.41 cm、鲜物重40.90 g/L、干物重4.89 g/L和丛生芽数6.10,最多,间歇式生物反应器培养次之,固体培养的增殖效果最差,三者的单个外植体再生形成的芽的平均数存在极显著差异;在白鹤芋组培苗增殖过程中,反应器中生长的组培苗一直保持旺盛的增殖生长,丛生芽数增加较为明显,植株叶片颜色为鲜绿色,而固体培养白鹤芋组培苗增殖速度相对较慢,生长状况良好。

表1 培养方法对白鹤芋组培苗增殖生长的影响
注:为0.05显著水平的多重比较结果,下同。
2.2 接种量对白鹤芋组培苗增殖生长的影响
将40、50、60和70 个单株白鹤芋组培苗接种于3 L气升式气球型生物反应器内进行增殖培养,发现丛生芽在培养初期长势缓慢,经15 d后,丛生芽分化和生长速度明显加快。
从表2可知,生长40 d后,接种量为40个单株时,株高、丛生芽数、鲜物重和干物重明显低于其它处理,接种量为60个单株时,各项指标明显优于其它处理,株高6.29 cm,丛生芽数12,鲜物重65.25 g,干物重7.68 g。
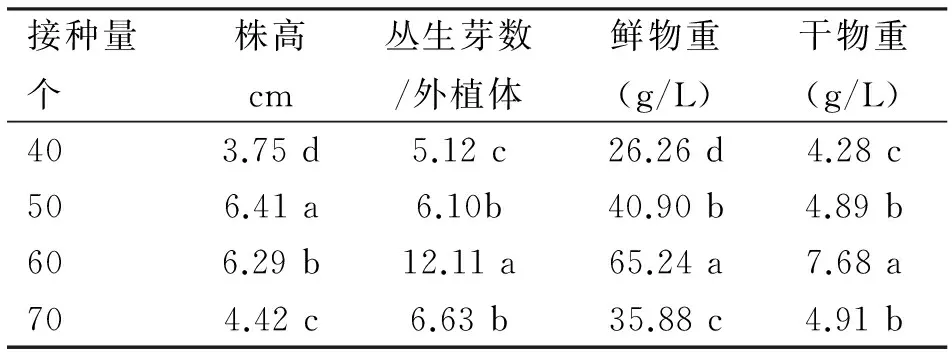
表2 接种量对白鹤芋组培苗增殖生长的影响
2.3 通气量对白鹤芋组培苗增殖生长的影响
反应器内通入适宜的氧气有利于白鹤芋组培苗增殖生长。当通气量为0.3 vvm时,所培养的白鹤芋组培苗不仅生长健壮,而且所有参数均显著优于其它处理,株高、鲜物重和干物重达到最高值,分别为4.87 cm、41.76 g/L和3.98 g/L(表3)。当通气量为0.1 vvm时,外植体的株高、鲜物重、干物重和丛生芽数等结果较差;通气量为0.20和0.40 vvm处理中,组培苗颜色绿,叶片肥厚,但0.40 vvm处理中株高、丛生芽数、鲜物重和干物重等低于0.30 vvm处理。结果表明:通气量为0.30 vvm最利于促进白鹤芋组培苗增殖,过低或过高都不适宜。
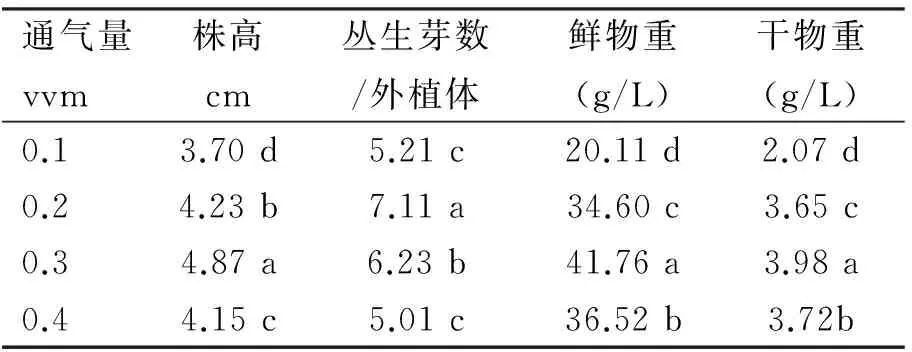
表3 通气量对白鹤芋组培苗增殖生长的影响
2.4 碳源对白鹤芋组培苗增殖生长的影响
糖是植物组织培养中不可缺少的,它不但作为离体组织赖以生长的碳源,而且还能维持培养基渗透压。本试验调查了糖种类对白鹤芋组培苗增殖生长的影响。从表4可以看出,用蔗糖作为碳源时,株高、鲜物重和干物重略高于白糖处理,但差异不大,以白糖作为碳源处理时,获得的丛生芽数明显高于蔗糖。从外观上看,2个处理对白鹤芋组培苗的生长无明显差异,表明蔗糖和白糖均适用于白鹤芋组织培养。大规模生产时,需糖量巨大,为节约成本,可利用白糖代替蔗糖作为有效糖源。

表4 糖种类对白鹤芋组培苗增殖生长的影响
注:**为0.05显著水平的独立样本t测验结果。
3 讨论与结论
植物组织培养是指通过无菌和人工控制的环境条件,利用适当的培养基,对离体的植物器官、组织、细胞及原生质体进行培养,使其再生细胞或长成完整植株的技术。其突出特点是生长周期短、繁殖系数高、能够保持原种苗的优良性状,同时培养条件可人为控制、管理方便、有利于工厂化生产。传统的组织培养有固体培养和液体培养2种方式。固体培养最大的优点是操作简便,通气问题易于解决,便于观察研究,但外植体与培养基接触面积小,养分在培养基中扩散慢,影响吸收利用,培养物排出的代谢废物对组织可产生毒害作用。本试验打破传统固体培养模式,优化为生物反应器液体培养,结果发现,应用接触式生物反应器,能够大量扩繁白鹤芋组培苗,节省了成本和操作时间,为大规模生产拓宽了思路。
在反应器培养中,接种量的多少对培养物的生长影响很大,接种量低,既浪费空间,又不利于植物生长;而接种量过高时,营养成分和氧气不能被充分利用,植物生长受抑制,会加速植物的衰老死亡[10-11]。金美玉[12],杨金凤[13]研究发现,利用生物反应器培养葡萄,接种量过高或过低,均不利于葡萄组培苗增殖生长。本试验中,接种量为60个单株,最适于白鹤芋组培苗在3 L(含2 L培养液)的反应器中培养。
在反应器中提供外源氧气,可以给植物代谢活动提供充分的溶解氧,同时,可以充分搅动培养基,有利于培养物吸收营养成分[14]。金美玉[12]研究表明,通气量0.15 vvm为葡萄生物反应器培养的最佳通气量。在本试验中,当通气量为0.3 vvm时,培养的白鹤芋组培苗不仅生长健壮,而且所有参素均显著优于其它处理。株高、鲜物重和干物重数达到最高值(4.87 cm、41.76 g/L和3.98 g/L)。
糖是植物组织培养成功与否的关键因素,至今为止,已有近50种糖类可用于植物组织培养,其中,蔗糖一直作为标准碳源,但许多研究表明,蔗糖并不一定是最佳碳源,其它糖类如葡萄糖、果糖、麦芽糖等对植物组织培养均有不同的良好表现[15]。糖浓度影响渗透压和养分吸收,过高浓度的蔗糖可以产生较高含量的生物活性物质[16],这可能是由于高渗透压影响了分解代谢从而导致碳代谢途径发生变化[17]。在不同碳源对草原樱桃增殖和生根培养的研究中,蔗糖和白砂糖差异不显著,而白砂糖的市售价较低,因此在生产中可以用白砂糖替代蔗糖作为碳源,又能达到降低成本的目的[18]。
本试验结果表明,用蔗糖和白糖作为碳源,对白鹤芋在生物反应器中的培养状况无明显差异,为节约成本,从投入成本及外植体丛生芽数等综合考虑,推荐白糖作为大规模生产白鹤芋组培苗增殖生长的最经济有效的糖源。
[1] Bunting G S.A revision ofSpathiphyllum(Araceae)-Mem[M].New York:Bot Gard,1960:1-54.
[2] Dewir Y H,Chakrabarty D,Hahn E J,et al.A simple method for mass propagation ofSpathiphyllumcannifoliumusing an airlift bioreactor[J].In Vitro Cellular & Developmental Biology-Plan,2006,42:291-297.
[3] Fonnesbech M,Fonnesbech A.In vitro propagation ofSpathiphyllum[J].Scientia Horticulturae,1979,10:21-25.
[4] 张云开,朱西儒,黄鸿枢.白鹤芋试管苗快速繁殖及移栽试验[J].广东农业科学,1991(04):29-31.
[5] 朱根发.白鹤芋属观赏植物的组织培养和快速繁殖技术研究[J].中国农学通报,2003,19(03):75-76,88.
[6] 张桂和,周清,李克烈,等.绿巨人茎尖的离体培养及快速繁殖[J].植物生理学通讯,1997, 33(03):199.
[7] 马国华,朱西儒,张云开,等.液体振荡培养高速繁殖白鹤芋丛芽[J].园艺学报,1993,20(03): 307-308.
[8] 王守明,朴炫春,廉美兰,等.BA 和IBA对“Cupid”白鹤芋试管苗增殖和发根的影响[J].延边大学农学学报,2004,26(02):128-131.
[9] Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue cultures[J].Physiologia Plantarum,1962,15:473.
[10] Lee C W,Shuler M L.The effect of inoculum density and conditioned medium on the production of ajmalicine and catharanthine from immobilizedCatharanthusroseuscells[J].Biotechnology and Bioengineering,2000,67(01):61-71.
[11] Huang S Y,Hung C H,Chou S N.Innovative strategies for operation of mist trickling reactors for enhanced hairy root proliferation and secondary metabolite productivity[J].Enzyme and Microbial Technology,2004,35(01): 22-32.
[12] 金美玉.葡萄茎段培养生物反应器微环境调控[D].延吉:延边大学,2011.
[13] 杨金凤.文心兰组培体系的优化及其圆球茎在生物反应器内培养的研究[D].延吉:延边大学, 2011.
[14] Ahmed S,Hahn E J,Paek K Y.Aeration volume and photosynthetic photon flux affect cell growth and secondary metabolite contents in bioreactor cultures ofMorindacitrifolia[J].Journal of Plant Biology,2008,51(03):209-212.
[15] 丁世萍,严菊强,季道藩,等.糖类在植物组织培养中的效应[J].植物学通报,1998,15(06):42-46.
[16] Lee E J,Mobin M,Hahn E J,et al.Effects of sucrose,inoculums density,auxins,and aeration volume on cell growth of Gymnema sytvestre[J].Journal of Plant Biology,2006,49(06):427-431.
[17] 陈丽娟,苏宾,闭志强,等.细胞分裂素6-BA浓度对红蕉组培快繁芽增殖的影响[J].南方农业学报,2004,2(02):67-68.
[18] 吴瑕,张涛,杨凤军,等.不同碳源及浓度对草原樱桃组培苗繁育的影响[J].黑龙江八一农垦大学学报,2007,19(05):26-29.
Effect of several factors on shoots growth and proliferation of Spathiphyllum floribundum in bioreactor
HAN Lu1, XIU Jingrun2, DAI Yue2, LIAN Meilan1, YIN Guanhao3, JIN Meiyu1*
(1.AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China2.YanbianAcademyofAgriculturalSciences,LongjingJilin133400,China;3.Agro-TechExtensionandServiceCenterofYanbian,YanjiJilin133000,China)
In order to find a simple, low cost and large-scale production way for producingSpathiphyllumfloribundumshoots,Spathiphyllumfloribundumshoot (2 cm) as explant, several factors affecting on the growth ofSpathiphyllumfloribundumshoots were investigated. The results showed that raft culture in bioreactors was favorable for shoot growth with dark-green in leaf color, fresh weight and dry weight were higher than others. Meanwhile, 60 inoculation and air volume of 0.3 vvm were best for shoots proliferation. It is a cost-saving way for large-scale culture when white sugar selected as source of carbon for the growth ofSpathiphyllumfloribundumshoots.
Spathiphyllumfloribundum; tissue culture plants; inoculation density; air volume; Bioreactor
2016-10-15 基金项目:国家自然科学基金(30860176); 2016年大学生创新创业训练计划项目(ydbksky2016343)
韩璐(1994—),女,吉林松原人,在读学士,研究方向为植物组织培养及反应器应用。金美玉为通信作者,
E-mail:jinmeiyu@ybu.edu.cn
1004-7999(2016)04-0313-04
10.13478/j.cnki.jasyu.2016.04.006
S682.19
A

