一种高效解磷复合菌剂的筛选与应用
苑伟伟+赵阳国+井永苹+刘鲁民

摘 要:通过平板透明圈和液体培养测定有效磷含量的方法初步筛选得到一株高效解磷真菌WL06,将该菌株与一株促生解淀粉芽孢杆菌WL21按照不同质量比进行复配,根据解磷复合菌剂对盆栽油菜中土壤有效磷含量和油菜长势的影响来筛选复合菌剂配方。盆栽试验结果表明,解磷菌WL06与促生菌WL21质量比为1∶2时解磷促生效果最好,与单一解磷菌相比,土壤有效磷含量提高66.50%,油菜鲜重提高30.76%。表明,解磷复合菌剂比单一解磷菌能够更好地提高土壤中有效磷含量,从而促进作物对磷元素的吸收,提高作物产量和品质。
关键词:解磷菌;复合菌剂;作物增长
中图分类号:S154.39文献标识号:A文章编号:1001-4942(2016)12-0086-05
Abstract Using plate and liquid culture methods to determine the available phosphorus content in liquid medium, an efficient phosphate-solubilizing fungus WL06 was screened. The fungus was mixed with a plant growth-promoting rhizobacteria Bacillus amyloliquefaciens WL21 in different mass ratios. Then the effects of different proportions of microbial inoculants on soil available phosphorus content and growth vigor of potted rape were investigated to screen the optimum formula. The results showed that they had the best phosphate-solubilizing and growth-promoting effects when the mass ratio of WL06 and WL21 was 1∶2. Under this formula, the soil available phosphorus content improved by 66.50% and the rape fresh weight increased by 30.76% than those of single phosphate-solubilizing fungus. This study indicated that the phosphorus-solubilizing compound inoculants had better effects on improving the soil available phosphorus than the single fungus, which would further promote the absorption of phosphorus by crop and increase crop yield and quality.
Keywords Phosphate-solubilizing bacteria; Compound microbial inoculants; Crop growth
在农业生产中,解磷菌的研究一直是关注的热点,特别是国家“一控两减三基本”的政策中提出,争取到2020年实现化肥和农药的零增长,这是生物肥料和生物农药发展的大好时机。研究表明,土壤中难溶磷占全磷含量的98%,其中难溶有机磷源占70%(植酸钙占68%),难溶无机磷源占28%,仅有2%左右的磷源是以植物能够直接吸收利用的可溶性磷盐形式存在[1]。土壤有效磷含量很低而全磷含量较高,如据黄土高原7省区的调查,土壤全磷平均较有效磷高250倍;黄淮海平原黄潮土与风沙土全磷较有效磷高130~500倍。农业中通过施入大量磷肥获得高产,但很大一部分磷肥施入土壤后很快被土壤固定成难溶性磷化合物[2]。影响土壤中磷有效性的因素很多,其中微生物对土壤磷的转化和利用率影响最大,解磷微生物的筛选是近些年来研究的热点。作物根际区域是一个复杂的环境,需要多种微生物与作物根际共同作用才能完成物质的吸收和运输过程。即使微生物将土壤中的难溶性磷解离出来变为有效态磷,有效态磷也不一定能被作物很好地吸收利用,所以不能依靠单纯的解磷微生物来提高作物对磷肥的利用率,需要一种包含解磷菌和促生菌在内的复合微生物菌剂共同发挥作用,才能提高土壤中有效态磷的含量并促进作物根系的吸收利用。
本研究就是将高效解磷真菌与作物促生菌复配,制成复合微生物菌剂,在盆栽试验中研究复合菌剂对土壤中有效磷含量及油菜生长状况的影响,为解磷复合微生物菌剂的市场化应用和推广提供技术支持。
1 材料与方法
1.1 供试菌株
供筛选解磷功能菌株编号为WL01~WL20,促生菌株编号为WL21。所有菌株均由青岛蔚蓝生物研发中心微生态实验室分离获得。
1.2 培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉18 g,蒸馏水1 000 mL。
无机磷培养基:葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g, MnSO4·4H2O 0.03 g,Ca3(PO4)2 5.0 g,蒸馏水1 000 mL,pH 7.2(琼脂20 g),115℃灭菌30 min。
有机磷培养基:葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,植酸钙5.0 g,蒸馏水1 000 mL, pH 7.2(琼脂20 g),115℃灭菌30 min。
1.3 试验方法
1.3.1 固体平板初筛 将20株供试菌株接种于无机磷和有机磷固体平板培养基上,重复3次,培养3~5天,测定菌落直径(R)及溶磷圈直径(D),根据溶磷圈直径与菌落直径的比值(D/R)初步确定溶磷能力较强的菌株,用于液体培养复筛。
1.3.2 液体培养复筛 取平板初筛中溶磷能力较强的菌株,接种于PDA平板培养基30℃活化培养3天,制备孢子悬浮液,等量接种于无机磷和有机磷液体培养基中,于30℃、180 r/min培养,每天取样离心,上清液用钼蓝比色法测定有效磷含量,连续测定7天,通过有效磷含量进一步筛选解磷效果好的菌株,用于盆栽试验。对照为不接种菌的空白培养基。
1.3.3 盆栽试验 供试土壤为石灰性土壤,pH值8.0,有效磷含量10.43 mg/kg,全氮0.082%。供试作物为油菜。因油菜生长对磷素比较敏感所以选择油菜为供试作物,品种为四季青帮油菜。
将复筛得到的两株解磷真菌WL05和WL06添加到供试土壤中,每千克土壤添加菌剂为1.0 g和2.0 g,通过评价油菜盆栽试验中土壤有效磷变化和油菜长势筛选较好解磷菌株及施用量。试验分别设4个处理(表1),每处理重复3次。空白对照为不添加菌剂。
作物种子先用0.4%次氯酸钠表面灭菌,然后用灭菌蒸馏水清洗4次除去次氯酸钠,55℃灭菌蒸馏水浸种,30℃温箱培养过夜,后转入灭菌纱布催芽。播种时,接种处理每盆用菌剂2.0 g 拌种,种子表面完全粘满菌剂,剩余菌剂与种子下方0~5 cm土壤混合均匀,然后点种。对照为不接菌处理,使用等量灭菌菌剂拌种,方法同接种处理。每盆播发芽种子5粒,出苗后每盆留苗2株。
作物生长45天后收获,采用游标卡尺测量主根直径,并对整株油菜称重,评价油菜长势;测定土壤中有效磷含量(碳酸氢钠浸提-钼锑抗比色法)[3],比较解磷效果。
1.3.4 复合菌剂筛选 将盆栽试验中复筛得到的较佳解磷菌株与促生菌株WL21,按照菌剂质量比1∶1、1∶1.5、1∶2、1∶3做成复合微生物菌剂,编号分别为FH1、FH2、FH3、FH4。将4种复合菌剂进行油菜盆栽试验,并将解磷菌剂单独作为一个处理,不添加任何菌剂的土壤为空白对照。根据土壤有效磷的变化和油菜长势的差异评价解磷促生复合菌剂与单一解磷菌剂的功能性差异。盆栽供试土壤、作物与操作同1.3.3。
1.4 数据分析
试验数据采用Microsoft Excel进行处理,利用SPSS 16.0软件进行数据统计及差异显著性分析。
2 结果与分析
2.1 固体平板培养初筛结果
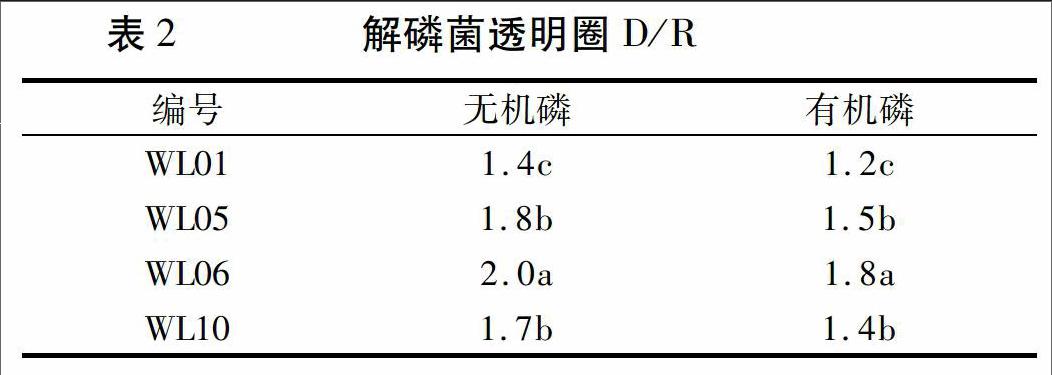
通过解磷透明圈观察,20株供试菌中有8株产生透明圈,4株D/R大于1(表2),其中菌株WL06在无机磷和有机磷培养基上产生的透明圈直径与菌落直径的比值分别为2.0和1.8,显著高于WL05和WL10(P<0.05),WL01 D/R 最小,显著低于其它菌株(P<0.05)。
2.2 液体培养复筛结果
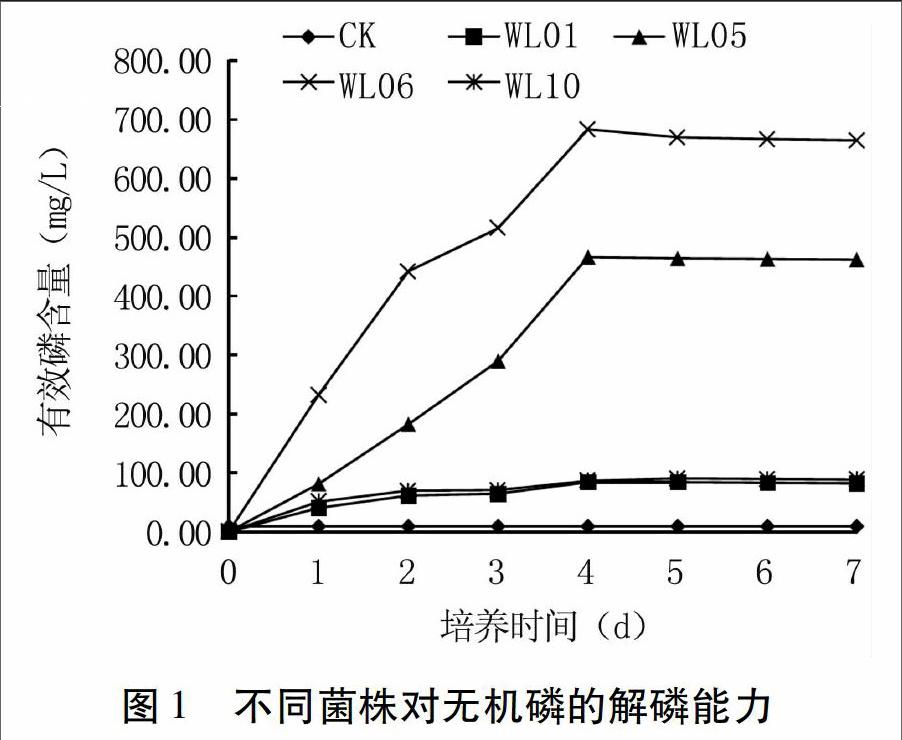
图1可见,固体培养初筛得到的4株菌有效磷含量在无机磷液体培养条件下逐渐增加,均在第4天达到最高,之后基本保持稳定。其中WL06有效磷含量最高,达683.19 mg/L,其次为WL05,达466.87 mg/L,WL10和WL01仅为90.27 mg/L和84.75 mg/L。因此,WL06在难溶性无机磷液体培养中解磷效果最好,其次是WL05。
4株菌有效磷含量在有机磷液体培养条件下逐渐增加(图2),其中WL06在第6天达最高,为 186.55 mg/L,其次为WL05,在第7天最高,为98.68 mg/L,二者最高有效磷含量明显高于WL10的59.76 mg/L和WL01的49.47 mg/L。从有效磷含量达到最高值的时间和含量综合比较,可以看出WL06在难溶性有机磷液体培养中解磷效果最好,其次是WL05。
2.3 单菌油菜盆栽试验效果评价
图3可见,不同菌株及其不同用量对油菜土壤解磷能力不同,T1、T2处理为菌株WL05添加量分别为1.0 g/kg土和2.0 g/kg土,土壤有效磷含量分别达到12.72 mg/kg和16.89 mg/kg;T3、T4处理为菌株WL06添加量分别为1.0 g/kg土和2.0 g/kg土,土壤有效磷含量分别达到17.12 mg/kg和20.30 mg/kg。T4处理土壤有效磷含量显著高于T2、T3处理,T2、T3处理显著高于T1、CK处理。由此可见,菌株WL06添加量2.0 g/kg土的处理T4最好。
由表3中盆栽油菜鲜重、主根直径可以看出,不同菌株不同用量对油菜长势影响明显。菌株WL05添加量为1.0 g/kg土和2.0 g/kg土两个处理T1、T2的鲜重比对照分别增加7.17%和14.56%,主根直径分别增长4.51%和12.03%。菌株WL06添加量为1.0 g/kg土和2.0 g/kg土两个处理T3、T4的鲜重比对照分别增加15.48%和22.76%;主根直径分别增长13.16%和37.22%。其中菌株WL06添加量为2.0g/kg土的处理T4最好,油菜的鲜重和主根直径均显著高于其它处理,具有显著的促生和增产效果。
2.4 复合菌剂油菜盆栽试验效果评价
解磷复合菌配方FH1、FH2、FH3、FH4各处理土壤有效磷含量分别为25.45、35.47、42.59、36.87 mg/kg(图4),单一解磷菌WL06处理土壤的有效磷含量为21.30 mg/kg,由此可见,复合菌剂处理的土壤有效磷含量都比单一解磷菌剂处理高,其中配方FH3土壤有效磷含量最高,显著高于其他处理,其次为配方FH2和FH4处理,FH1处理最低,与单一解磷菌WL06差异不显著。
由表4中数据可以得出解磷复合菌配方FH1、FH2、FH3、FH4各处理盆栽油菜的鲜物重增长率分别达到25.70%、31.02%、55.77%、40.02%,单一解磷菌WL06的油菜鲜物重增长率为19.12%;主根直径增长率分别达到16.67%、17.89%、28.05%、20.73%,单一解磷菌WL06的油菜主根直径增长率为14.23%。其中配方FH3处理鲜物重和主根直径增长率均为最高,并且与单一解磷菌差异显著。各处理盆栽油菜的长势见图5,FH3处理根系图见图6。
3 讨论
研究发现,解磷真菌的解磷效果往往好于解磷细菌。Kucey等[4]从草原土中分离的解磷真菌大多为青霉和曲霉,并证明虽然解磷真菌种类不多,但其解磷能力通常比细菌强。PDA平板上培养7天,细菌解磷能力为0.08~2.65 mg,而大部分真菌解磷能力一般是细菌的5倍,最高可达12.8 mg。林启美等[5]也发现真菌解磷能力比细菌强,溶解磷矿粉能力较强的细菌溶磷能力为26.92~43.34 mg/kg,而大多数真菌则为59.64~145.36 mg/kg。王富民等[6]和范丙全等[7]对青霉菌(Penicillium bilaii)、曲霉菌(Aspergillus niger)解磷功能做了深入研究,发现第1茬接种青霉菌与单施磷肥的玉米和花生的生物量没有差异,但明显提高了花生和玉米的吸磷量,第2茬接种青霉菌显著增加玉米、花生的生物量和吸磷量。蔡磊等[8]通过对14株细菌解磷能力筛选得到的最好解磷细菌液体培养的最高解磷量为19.10 μg/mL。本试验中解磷真菌菌株WL06在液体培养中解无机磷能力达到683.19 mg/L,解有机磷能力达到186.55 mg/L,解磷能力较强。
在油菜盆栽试验中,郝晶等[9]研究表明,不同解磷菌群能增加作物地上鲜重7.0%~44.4%。邢芳芳等[10]研究中施用解磷菌后鸡毛菜鲜重增加32.94%。贺国强等[11]研究表明,接种解磷复合菌剂可使小麦根际土壤细菌多样性指数和丰富度指数提高。方华舟等[12]研究表明,复合菌剂处理稻田土壤,可使土壤有效磷含量增加32.17%。贺国强等[13]研究表明,解磷复合菌剂可使小麦最高增产14.49%。与之相比,本研究应用复合菌剂后,油菜鲜重提高55.77%,表现出很好的应用效果。
4 结论
本研究筛选得到一株解磷真菌,通过与一株促生菌以1∶2的质量比复配制成的复合菌剂可使土壤中有效磷含量提高272.3%,油菜主根直径提高28.05%,鲜重增长55.77%,比单一解磷菌具有更明显的促生、增产效果,表现出很好的应用前景。
参 考 文 献:
[1] Trafdar J C, Gharu A. Mobilization of organic and poorly soluble phosphates by Chaetomium globosum[J]. Applied Soil Ecology, 2006, 32(3): 273-283.
[2] 王莉晶.高效解磷菌的筛选及其对小麦生长的影响[D].大连:大连理工大学,2008.
[3] 鲍士旦.土壤农化分析[M].北京:中国农业科技出版社,2000.
[4] Kucey R M N, Janzen H H, Leggett M E. Inorganic phosphate solubilizing microorganisms: microbially mediated increases in plant available phosphorus[M]. Academic Press Inc., 1989:202-220.
[5] 林启美,王华,赵小蓉,等.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,2001,28(2):26-30.
[6] 王富民,刘桂芝,张彦,等. 高效溶磷菌的分离、筛选及在土壤中溶磷有效性的研究[J].生物技术,1992,2(6):34-37.
[7] 范丙全,金继运,葛诚.溶磷草酸青霉菌筛选及其溶磷效果的初步研究[J].中国农业科学,2002,35(5):525-530.
[8] 蔡磊,李文鹏,张克勤.高效解磷菌株的分离、筛选及其对小麦苗期生长的促进作用研究[J].土壤通报,2002,33(1):44-46.
[9] 郝晶,洪坚平,刘冰,等.不同解磷菌群对豌豆生长和产量影响的研究[J].作物杂志,2006(1):73-76.
[10]邢芳芳,徐文凤,宋涛,等.一株高效溶磷真菌的溶磷特性及其促生效果研究[J].华北农学报,2013,28(增刊):357-360.
[11]贺国强,陈三凤. 固氮、解磷复合菌剂对小麦根际土壤细菌群落的影响[J].中国农业大学学报,2015,20(5):81-88.
[12]方华舟,左雪枝. 稻田固氮解磷解钾菌筛选及其复合菌剂对土壤培肥作用[J].中国土壤与肥料,2014(2):82-87.
[13]贺国强,王磊,邓志平,等. 固氮·解磷菌剂对小麦种子萌发及田间小麦产量的影响[J].安徽农业科学,2011,39(7):3875-3876,3888.

