CT血管造影诊断一例犬肝外门体分流(PSS)病例报告
陈立坤 , 马超贤 , 谢富强
(中国农业大学动物医学院 , 北京 海淀 100193)
门体分流(PSS)是犬猫肝脏血管异常的一种表现形式。门体分流可依据不同发病机理分为先天性门体分流(CPSS)及继发性门体分流(APSS);其中先天性门体分流又可依据分流血管的起点及终点分为几种不同的解剖类型:肝外门体分流(EHPSS)及肝内门体分流(IHPSS);肝外门体分流又可分为多重不同解剖类型,比如:脾-后腔静脉分流、脾-膈静脉分流、脾-奇静脉分流等,主要发生于猫及小型犬。肝内门体分流又可分为:左支分流、右支分流、中央分流,主要好发于大型犬。患病动物常在幼年即表现出神经、胃肠道及泌尿系统症状。大部分病例主要因肝性脑病症状就诊。该病的诊断除了依据症状高度怀疑外,需要进行实验室检验及影像学检查,特别是CT血管造影方能确诊。
1 病例介绍
1.1 基本信息及病史 患犬为4月龄比熊犬,雌性未绝育,体重约2.3 kg。患犬正常免疫及驱虫,饮食以幼犬粮为主。主诉:半个月前发现犬大量流涎、精神沉郁、低头靠墙行走、间歇性失明。多在下午及晚上发生,且近期症状频发,表现为犬嗜睡、食欲时好时坏、小便颜色深黄、大便正常。
1.2 检查结果
1.2.1 体格检查 犬精神沉郁;口腔黏膜颜色粉、湿润度尚可,毛细血管再充盈时间(CRT)<2 s;呼吸频率约20次/min,呼吸深度正常;心率约148次/min,窦性心律不齐,听诊心音未见异常;触诊体表淋巴结未觉明显增大。
1.2.2 实验室检验 实验室检验主要测定CBC、生化、血胺及进食后胆汁酸。检查结果提示:血常规检查可见小红细胞,轻度低色素性贫血。血清生化显示ALP、血氨以及餐后胆汁酸显著升高,白蛋白下降,提示动物肝脏功能异常(见表1)。尿液化学分析提示动物肾脏浓缩功能未见异常,但存在大量尿酸盐结晶。
1.2.3 影像学检查
1.2.3.1 超声检查 超声检查结果提示:双肾对称性增大,膀胱内散在大量结晶;肝脏缩小,肝外门体分流,未能判断其分流类型(见图1),建议CT血管造影评估。
1.2.3.2 CT血管造影检查 CT平扫之后进行CT团注试验,以确定最佳门静脉相。将动态扫查线置于T13-L1水平,经头静脉给予200 mg/kg I的碘海醇,CT动态扫查设定为开始注射后的1 min内,每2秒钟扫查1次,共扫查30次,动态扫查结束后,选取门静脉为感兴趣区,绘制HU值-时间曲线,寻找门静脉最佳显影时间(T),设定T,经头静脉给予 800 mg/kg I的碘海醇后,在T时间进行腹部扫查,最终确诊为右胃静脉-后腔静脉分流(见图2)。
1.3 治疗及预后 术前纠正体况,使用乳果糖及阿莫西林克拉维酸钾降血胺,糖盐水补液,保证患犬水合状态。开腹后,于分流支血管放置Ameroid缩窄器。犬术后苏醒正常,1年之后回访,犬生活状态良好。
2 讨论
该犬由于近期逐渐加重的肝性脑病症状:大量流涎,精神沉郁,低头靠墙行走,间歇性失明,症状发生频率越来越高,而就诊,经CT血管造影确诊为先天性门体分流。犬先天性门体分流定义为门静脉与体循环之间的任何直接的血管性连接,这会导致来自胃肠道的门静脉血液未经过肝脏代谢直接进入体循环。正常犬猫供应肝脏的血供主要有两种:约70%~80%的肝脏血供来源于门静脉,20%~30%的肝脏血供来源于肝动脉[1]。当发生门体分流时,供应肝脏的门静脉血液通过分流支大量直接进入体循环,导致肝脏血液供应减少,从而引起肝脏发育不良、肝脏渐进性萎缩,肝脏变小;另外门静脉从肠道吸收的一些有毒物质未经过肝脏代谢直接进入体循环引起肝性脑病[2]。肝性脑病症状常常可逆,但会渐进性加重且发生频率越发频繁;大部分患犬还会出现其他症状,比如腹泻、呕吐、黑粪症/食欲下降、多尿、血尿等[1]。该犬就诊原因是越发频繁的神经症状。
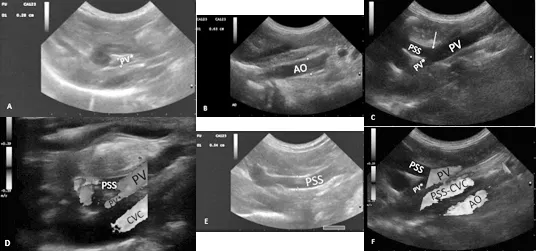
图1 超声扫查图像
A:分流后入肝门静脉纵切面; B:主动脉纵切面; C:分流处门静脉纵切面; D:分流处门静脉处彩色多普勒; E:分流支血管纵切面; F:门静脉、后腔静脉、主动脉彩色多普勒信号。(PV短路支尾侧门静脉主干,PV*短路支头侧门静脉主干,即入肝的门静脉主干,PSS门体分流短路血管,CVC后腔静脉,AO主动脉,PSS-CVC门体分流短路支与后腔静脉连接处)。PV*直径约0.28 cm(A),AO直径约0.63 cm(B),PV*/AO≈0.44<0.65,PV*血管内血流方向向肝性(D),频谱多普勒测得血流速度明显减慢,约8 cm/s; 门静脉在幽门水平背侧分出一短路支(C),短路支向头侧延伸一段距离继而向尾侧延伸(E),最终汇入后腔静脉,彩色多普勒可见后腔静脉血管内湍流(F),短路支直径约0.54 cm(E)
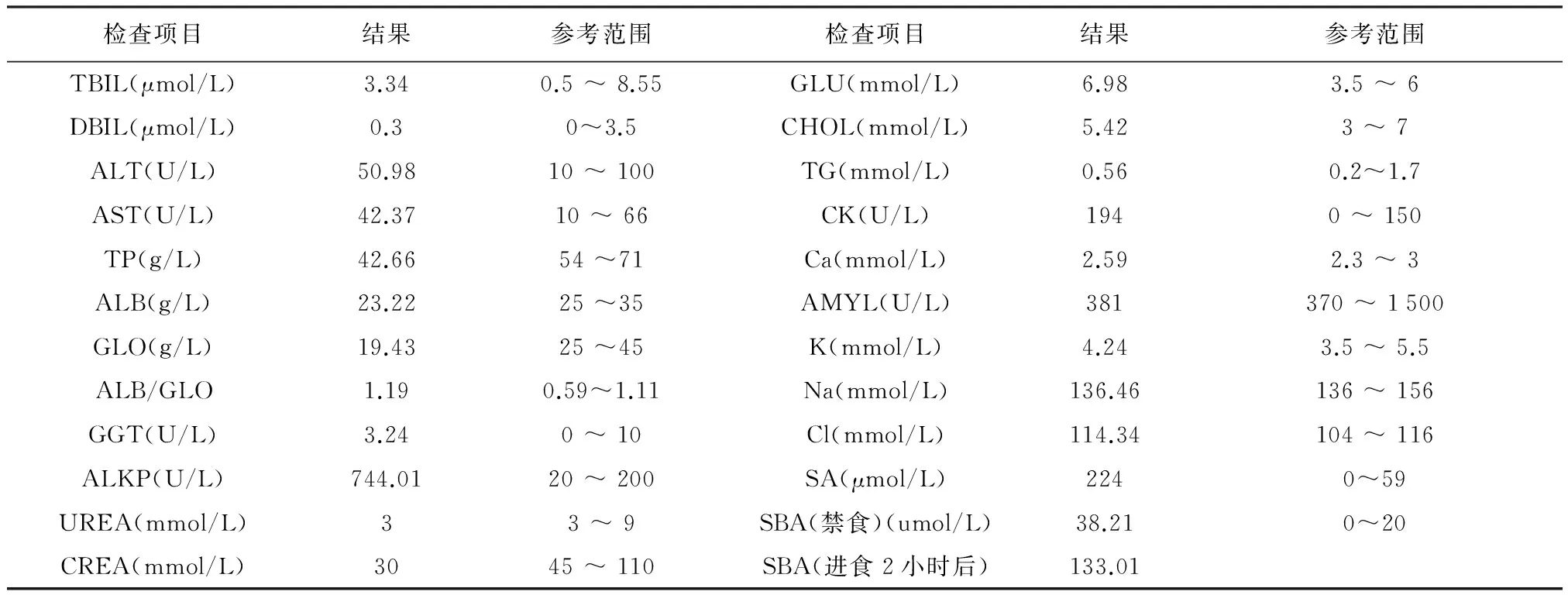
表1 患犬血清生化检验
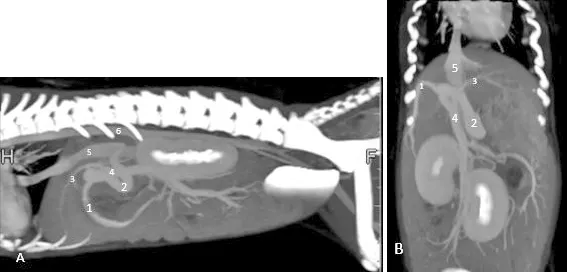
图2 CT血管造影
A:CT血管造影最大密度投影矢状面观;B:CT血管造影最大密度投影冠状面观。两图均可见门静脉的全部分支、后腔静脉及主动脉显影(5,6),可见胃十二指肠静脉(1)前段分支的右胃静脉增粗(2),最终连接至后腔静脉(5),入肝门静脉变细(3),脾门静脉及分流处尾侧门静脉未见明显异常(4)
犬先天性门体分流好发于纯种犬,没有性别倾向性,多见于幼年犬,但极少数患犬可能会在老年表现症状;很多患病动物,尤其是猫,病史较长。门体分流的类型也与症状出现的时间有很大关系,往往肝内门体分流的动物出现症状的时间更早,有些肝外门体分流患病动物出现症状相对较晚,尤其是脾静脉-奇静脉分流、脾静脉-膈静脉分流[3-4]。原因是奇静脉较细,位于胸腔内,且膈静脉位于肝脏与膈之间,一般分流支连接两者时,遇到的血流阻力相对较大,又因呼吸运动还会加大血流阻力,所以此两种类型造成的分流相对来说更缓和,从而使得症状出现时间较晚[3]。此病例是右胃静脉-后腔静脉分流,分流支末端连接至腹中部偏头侧的后腔静脉,此处不仅血流阻力很小甚至无阻力,且后腔静脉向头侧流动使得分流支与后腔静脉连接处的血流阻力呈负值,故加重了分流程度。有些病例由于分流支分流较严重引起向肝内的门静脉主干内的血流反向流动,表现为出肝方向血流。一般此类型的门体分流病例临床症状出现较早。
犬先天性门体分流的影像学诊断有独特优势。包括开腹肠系膜静脉造影、超声引导脾门静脉穿刺造影技术、超声检查及多普勒血流成像技术和CT血管造影技术[1,5]。一些简单的分流类型可经过超声确诊,但复杂的分流类型或多个分流,超声全面诊断难度较大,这时就需要使用CT血管造影进行诊断。CT血管造影可以通过多平面重建或容积重建清楚的观察到门静脉的各个分支及相对解剖位置关系、异常分支,可以用来精确诊断各种类型的PSS,从而有助于手术方案的精确制定。CT血管造影操作惟一一点不足之处是需要患病动物全身麻醉,但相对于超声引导脾静脉穿刺造影及开腹肠系膜静脉造影操作侵入性小得多,此病例,超声检查确诊是肝外门体分流,但无法确定肝外门体分流类型,于是进行CT血管造影诊断,最终诊断为右胃静脉-后腔静脉分流。为手术方案的制定提供了可靠依据,病例进行了外科手术治疗,开腹放置Ameroid缩窄环[6],预后良好。
该病实验室检验中相对有指征意义的指标是禁食血胺及进食前后胆汁酸。血氨主要由大肠内的厌氧菌及大肠杆菌产生。大多数从肠道释放的血氨通过尿素循环在肝内转化成尿素氮;所以血氨升高的鉴别诊断包括:门脉异常,比如PSS、肝功能衰竭、尿素循环障碍,对于犬可能主要由于原发性的尿素循环酶缺乏;对于猫,可能主要由于尿素循环底物的获取不足(常常是由于饮食未添加精氨酸或禁食)或厌食导致。胆汁酸的惟一合成途径是胆固醇在肝细胞内合成,胆汁酸分泌进入胆道,储存在胆囊内。进食后,胆汁分泌进入十二指肠帮助消化脂肪,然后在结肠远端通过门静脉重吸收进入肝脏。肝肠循环中,多于95%的胆汁酸被重吸收,所以胆汁酸升高原因可分为:门脉异常,比如PSS、肝脏实质疾病、胆汁淤积,胆汁酸从肝细胞泄露至全身血液循环[7]。有学者[8]指出,使用实验室参考范围的上限 (血氨59 mmol/L;胆汁酸20 mmol/L), 犬血氨的敏感性和特异性分别是 85% 和 86% ,猫分别是83% 和 76%。犬胆汁酸的敏感性和特异性分别是93% 和 67%,猫分别是100% 和 71%。使用优化的血氨界定点(犬57 mmol/L;猫94 mmol/L) ,犬的敏感性和特异性分别是91% 和 84%,猫分别是83% 和 86%。使用胆汁酸的优化的界定点(犬 58 mmol/L;猫34 mmol/L) ,犬的敏感性和特异性是78% 和 87%,猫分别是 100% 和 84%[8]。禁食血胺及胆汁酸对于诊断PSS的敏感性及特异性相对较好,且样本较容易获得,操作简便,所以对于怀疑PSS病例,实验室检验有着很重要的意义。PSS动物门静脉中部分血流未能正常进入肝脏,肝脏功能受到一定的影响,主要表现为蛋白、糖原以及尿素合成减少,血氨、胆汁酸、胆红素等清除率下降等,本病例出现低蛋白血症、高血胺以及高胆汁酸,但血糖、胆汁酸以及尿素氮浓度均在正常范围内,这可能是由于动物在采血过程中相对紧张应激,导致血糖有所升高,而尽管肝脏功能受损,但胆红素仍在肝脏可代谢的范围内。本病例尿素氮尽管在正常范围,但也是低限。
先天性门体分流病例治疗的基石及关键点即是诊断,应认识到此类疾病的非特异性临床症状,有针对性的进行实验室检验(主要是禁食血胺及进食前后胆汁酸检查)。超声检查初步诊断肝内或肝外及一些简单的肝外门体分流,CT血管造影确诊复杂等任何类型的门体分流。所以,先天性门体分流的诊断需要进行临床症状、实验室检验及影像学检查综合诊断[9]。
[1] 姜晨. 6只犬门静脉血管异常超声诊断研究[D].北京:中国农业大学.2015.
[2] D. Paepe, Haers, Vermote. Portosystemic shunts in dogs and cats: defnition, epidemiology and clinical signs of congenital portosystemic shunts[J].Vlaams Diergeneeskundig Tijdschrift, 2007, 76:234-240.
[3] K Fukushima, H Kanemoto, K Ohno,etal. Computed tomographic morphology and clinical features of extrahepatic portosystemic shunts in 172 dogs in Japan[J].The Veterinary Journal, 2014, 199:376-381.
[4] Nathan C. Nelson, Laural. Nelson. Anatomy of Exthrhepatic Portosystemic Shunts in Dogs as Determined by Computed Tomography Angiography[J].Veterinary Radiology & Ultrasound, 2011, 52(5): 498-506.
[5] Sebastian Schaub1, Antje Hartmann, Tobias Schwarz. Comparison of contrast-enhanced multidetector computed tomography angiography and splenoportography for the evaluation of portosystemic-shunt occlusion after cellophane banding in dogs[J]. BMC Veterinary Research.2016, 12:283.
[6] Margo L. Mehl, Andrew E. Kyles. Surgical Management of Left-Divisional Intrahepatic Portosystemic Shunts: Outcome After Partial Ligation of, or Ameroid Ring Constrictor Placement on, the Left Hepatic Vein in Twenty-Eight Dogs (1995—2005)[J]. Veterinary Surgery,2007, 36:21-30.
[7] G. van Straten, B. Spee, J. Rothuizen.etal. Diagnostic value of the rectal ammonia tolerance test, fasting plasma ammonia and fasting plasma bile acids for canine portosystemic shunting[J].The Veterinary Journal,2015, 204: 282-286.
[8] Kristina Ruland, Andrea Fischer, Katrin Hartmann. Sensitivity and specificity of fasting ammonia and serum bile acids in the diagnosis of portosystemic shunts in dogs and cats[J]. Vet Clin Pathol,39/1 (2010):57-64.
[9] Sara L. Connolly. Canine portosystemic shunts: Single or multiple tests to make the correct diagnosis[J]. The Veterinary Journal,2016, 207: 6-7.

