基于多壁碳纳米管-铂纳米颗粒纳米复合材料的乙醇生物传感器*
苗智颖,念 陈,邵学广,陈 强
(1.华北理工大学基础医学院,河北 唐山 063000;2.海南医学院,海口 571199;3.南开大学药物化学生物学国家重点实验室,天津 300071;4.南开大学生物活性材料教育部重点实验室,天津 300071)
基于多壁碳纳米管-铂纳米颗粒纳米复合材料的乙醇生物传感器*
苗智颖1,念 陈2,邵学广3,陈 强4*
(1.华北理工大学基础医学院,河北 唐山 063000;2.海南医学院,海口 571199;3.南开大学药物化学生物学国家重点实验室,天津 300071;4.南开大学生物活性材料教育部重点实验室,天津 300071)
采用超声法制备了多壁碳纳米管-铂纳米颗粒(MWCNTs-PtNPs)纳米复合材料,并将其修饰于乙醇生物传感器,表现出良好的检测性能。实验结果表明:传感器最低检测限为0.02 mmol/L,线性范围为0.25 mmol/L~3.00 mmol/L,灵敏度为0.923 32 μA/(mmol/L),并且具有高稳定性和良好的重现性。
生物传感器;乙醇;多壁碳纳米管-铂纳米颗粒;纳米复合材料
乙醇(Ethanol,CH3CH2OH)是醇类的一种,对人体液(血液、血清、唾液、尿液、汗液等)中的乙醇精确快速的检测在临床和法医检定方面具有重要意义[1]。近年来,已发展了多种乙醇检测方法,如氧化还原滴定法、分光光度法、呼气法、高效液相色谱法、气相色谱法、生物传感器法等[2-4]。其中,基于酶制剂的生物传感器由于检测方便、快速和准确,能够满足即时检测的要求而受到广泛的关注[5-6],而且随着材料科学的发展,采用纳米材料修饰电极的出现[7-10],进一步提高了乙醇检测的性能,尤其是以多壁碳纳米管MWCNTs(Multi-Wallcarbon Nanotubes)为代表的纳米材料,已广泛应用于多种高性能生物传感器的制备[11-12]。明胶包埋法作为传统酶固定化方法,具有操作简单、条件温和、能阻碍大分子干扰物等优点,适合结构复杂的八聚体乙醇氧化酶AOD(Alcohol Oxidase)的固定。本文将用超声法制备的MWCNTs-PtNPs纳米复合物修饰在丝网印刷电极上,在聚丙烯胺盐酸盐/聚磺化乙烯硫酸盐PAA/PVS(poly(allyl-amine)/poly(potassium vinyl sulfate))自组装膜提高传感器抗干扰性基础上,利用包埋法将乙醇氧化酶固定在电极表面,构建了乙醇生物传感器,并考察了影响电极性能的因素。所制备的传感器不仅表现出较宽的线性范围和较高的灵敏度,还表现出良好的稳定性。
1 实验部分
1.1 试剂与仪器
乙醇氧化酶(AOD,EC1.1.3.13 from Pichia pastoris,5 483 U/mL)、氯铂酸钾、尿酸、醋氨酚、抗坏血酸购于Sigma;多壁碳纳米管(MWCNTs,直径30 nm~50 nm,长度0.5 μm~1 μm,羧基基团0.73 wt%,纯度95%)购于中国科学院成都有机化学研究所;聚丙烯胺盐酸盐(Poly(allyl-amine),PAA,Mw:10 000)和聚磺化乙烯硫酸盐(Poly(potassium vinyl sulfate),PVS,Mw:170 000)购于Aldrich;乙醇购于天津市化学试剂有限公司。实验过程中使用的其他试剂均为分析 纯,溶液均为去离子水配制。循环伏安(CV)曲线和计时电流(i-t)曲线在电化学测试系统(Model 283型,M270数据处理软件,美国EG&G公司)上进行,采用丝网印刷电极(BVT-AC1.W2.RS:工作电极-Pt,参比电极-Ag/AgCl,对电极-Pt,上海安赞商贸有限公司),实验前溶液通入氮气除氧,所有的实验均在室温下进行。
1.2 MWCNTs-PtNPs纳米复合物的制备
将MWCNTs用混酸(浓硫酸∶浓硝酸=3∶1,V∶V)超声处理4 h,离心后去掉上清液,MWCNTs用双蒸水反复洗涤至中性,干燥后用双蒸水配置成1 mg/mL溶液备用。取1 mL 1 mg/mL MWCNTs溶液于烧杯中,室温下边搅拌边加入2 mL 0.01 mol/L K2PtCl6水溶液,然后将混合液超声2 h,最后室温下搅拌20 h,离心收集最终产物,双蒸水配置成1 mg/mL溶液备用。
1.3 纳米复合物修饰酶电极的制备
将丝网印刷电极分别在乙醇、去离子水中超声清洗,然后在0.5 mol/L稀硫酸溶液中在-0.3 V~+1.5 V范围内进行循环伏安扫描,直至循环伏安曲线达到稳定状态,以除去电极表面的金属杂质。然后将电极在2 mg/L PAA与PVS溶液交替浸入25 min,间隔以PBS冲洗,重复上述过程在电极表面自组装(PAA/PVS)2膜;取5 μL MWCNTs-PtNPs水溶液滴加到工作电极表面,室温下干燥后置于4 ℃冰箱保存备用。取10 μL明胶(10%,W/V)、10 μL AOD(1 mg/L)混匀,取10 μL滴加于处理好的工作电极表面,放4 ℃冰箱中自然干燥,12 h后取出。
1.4 电化学测试
电化学测试前,先将电极置于0.1 mol/L pH 7.5的PBS中浸泡5 min,以洗去结合松散的酶蛋白。将电极放入20 mL pH 7.5 PBS中进行电化学测试。在50 mV/s扫描速度下测定工作电极的循环伏安曲线,初始电位0 mV,折回电位+600 mV。在+400 mV电位下测定工作电极的计时电流曲线,测定时施加电磁搅拌。
2 结果与讨论
2.1 MWCNTs-PtNPs纳米复合物的透射电镜表征
图1为MWCNTs-PtNPs纳米复合物的透射电镜图,从图1(a)中可以清晰的看到黑色的纳米铂颗粒附着在碳管的表面,纳米铂颗粒的直径约为2 nm~3 nm;与其相对应的空白碳管图1(b)未发现表面有黑色颗粒状结构。

图1 TEM表征结果
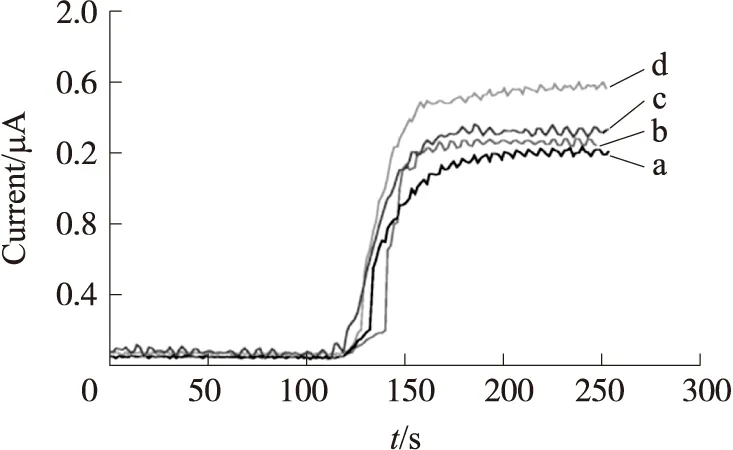
图2 不同材料修饰的电极对乙醇的电流响应
2.2 不同材料修饰的电极对乙醇的电流响应及工作曲线
分别将PtNPs、MWCNTs和MWCNTs-PtNPs纳米复合物修饰于电极表面,在+400 mV(vs.Ag/AgCl)电位下测量电极对2 mmol/L乙醇的电流响应,结果如图2所示。
其中MWCNTs-PtNPs纳米复合物的增效作用最明显(曲线d),这主要归因于MWCNTs-PtNPs纳米复合物大的比表面积和良好的生物相容性以及良好的电子传递能力,不仅增大了酶的固定量,同时保持了酶的活性。故本实验中选择MWCNTs-PtNPs纳米复合物修饰电极制备乙醇传感器。
将AOD/MWCNTs-PtNPs/(PAA/PVS)2/Pt电极连接电化学工作站,构建用于乙醇定量测定的生物传感器,在+400 mV(vs.Ag/AgCl)电位下测定计时电流曲线,分别加入不同量的乙醇形成乙醇浓度梯度,测试结果如图3所示。

图3 传感器对乙醇浓度响应的计时电流曲线
在20 mL 0.1 mol/L pH 7.5 PBS中测试,测试电位+400 mV(vs.Ag/AgCl),电磁搅拌,室温25 ℃,箭头标注表示单次加样后乙醇总浓度。
将实验中电流响应值与浓度的对应关系绘制成乙醇传感器工作曲线,并根据酶反应动力学方程——米氏方程(Michaelis-Menten equation)进行拟合[13]:
V=Vmax·[S]/(Km+[S])
(1)
式中:V为反应速率,由加样后稳态电流值Iss所代表;Vmax为最大反应速率,由酶被底物饱和时的最大响应电流Imax所代表;[S]为体系中的底物浓度;根据5次独立测定重复实验的平均值绘制乙醇生物传感器工作曲线,如图4所示。

图4 乙醇传感器的工作曲线
该工作曲线的线性范围为0.25 mmol/L~3.0 mmol/L,灵敏度为0.923 32 μA/(mmol/L),乙醇检测时加样前基线平均值为7 nA,信噪比(S/N)为3时,传感器最低检测限为0.02 mmol/L。
2.3 传感器的抗干扰性与稳定性
抗坏血酸、尿酸和醋氨酚是体液中常见的氧化还原活性物质,本研究在电极上固定AOD之前,先在电极表面自组装(PAA/PVS)2纳米膜来增强传感器的抗干扰能力。结果显示,与1 mmol/L乙醇产生的电流相比,0.5 mmol/L尿酸产生的干扰电流为8.97%,0.1 mmol/L醋氨酚产生的干扰电流为1.92%,0.1 mmol/L抗坏血酸产生的干扰电流为4.81%。表明制备的乙醇传感器在对血液中所含的尿酸、醋氨酚、抗坏血酸的抗干扰性良好。这归功于(PAA/PVS)2自组装膜对干扰物的扩散阻碍作用,4种干扰物分子较大,难于通过微小孔结构扩散到电极表面进行氧化[14]。
所制备的乙醇生物传感器稳定性实验结果见图5。电极不用时置于4 ℃冰箱pH 7.5 PBS中保存,在7周时间内连续测定电极对2 mmol/L乙醇的响应电流,响应电流值下降缓慢,第49天乙醇生物传感器响应电流仍保持了初始值的82.2%,表明制备的传感器具有良好的稳定性,这与包埋法提供的温和环境、以及MWCNTs的吸附性、生物相容性有关。

图5 制备的乙醇生物传感器在7周内对2 mmol/L乙醇的电流响应
3 结论
本文采用超声方法制备了MWCNTs-PtNPs复合材料,所制备的纳米复合材料表现出良好的电化学活性,提高了乙醇生物传感器的性能,所制备的传感器表现出良好的线性范围和检测限,由于复合材料的制备方法简单,有望在乙醇的检测中得到实际应用。
[1] Peng M,Wu S,Jiang X,et al. Long-Term Alcohol Consumption is An Independent Risk Factor of Hypertension Development in Northern China:Evidence from Kailuan Study[J]. J Hypertens,2013,31(12):2342-2347.
[2] Chalier P,Ghommidh C,Ragazzo-Sanchez J A. Coupling Gas Chromatography and Electronic Nose for Dehydration and Desalcoholization of Alcoholized Beverages-Application to off-Flavour Detection in Wine[J]. Sensors and Actuators B:Chemical,2005,106(1):253-257.
[3] Jones A W. Measuring Alcohol in Blood and Breath for Forensic Purposes—A Historical Review[J]. Forensic Science Review,2000,12(1/2):151-182.
[4] 陈珠丽,郭希山,朱松明. 基于纳米金修饰丝网印刷电极的乙醇生物传感器[J]. 传感技术学报,2009,22(12):1686-1689.
[5] Li L,Lu H,Deng L. A Sensitive NADH and Ethanol Biosensor Based on Graphene-Au Nanorods Nanocomposites[J]. Talanta,2013,113:1-6.
[6] Das M,Goswami P. Direct Electrochemistry of Alcohol Oxidase Using Multiwalled Carbon Nanotube As Electroactive Matrix for Biosensor Application[J]. Bioelectrochemistry,2013,89:19-25.
[7] Narang J,Chauhan N,Jain P,et al. Silver Nanoparticles/Multiwalled Carbon Nanotube/Polyaniline Film for Amperometric Glutathione Biosensor[J]. Int J Biol Macromol,2012,50(3):672-678.
[8] 马莉萍,左显维,王艳凤,等. 基于Au NPs-CeO2@PANI纳米复合材料固定化酶的葡萄糖生物传感器[J]. 传感技术学报,2013,26(5):606-610.
[9] Dalmasso P R,Pedano M L,Rivas G A. Supramolecular Architecture Based on the Self-Assembling of Multiwall Carbon Nanotubes Dispersed in Polyhistidine and Glucose Oxidase:Characterization and Analytical Applications for Glucose Biosensing[J]. Biosens Bioelectron,2013,39(1):76-81.
[10] Lata S,Pundir C S. L-Amino Acid Biosensor Based on L-Amino Acid Oxidase Immobilized Onto NiHCNFe/c-MWCNT/PPy/GC Electrode[J]. Int J Biol Macromol,2013,54:250-257.
[11] Miao Z,Zhang D,Chen Q. Non-Enzymatic Hydrogen Peroxide Sensors Based on Multi-Wall Carbon Nanotube/Pt Nanoparticle Nanohybrids[J]. Materials,2014,7(4):2945-2955.
[12] Benvidi A,Rajabzadeh N,Mazloum-Ardakani M,et al. Comparison of Impedimetric Detection of DNA Hybridization on Chemically and Electrochemically Functionalized Multi-Wall Carbon Nanotubes Modified Electrode[J]. Sensors and Actuators B Chemical,2015,207:673-682.
[13] 陈守文. 酶工程[M]. 北京:科学出版社,2008:208-216.
[14] Saiki T H. Kuwazawa Hoshi. Selective Permeation of Hydrogen Peroxide Through Polyelectrolyte Multilayer Films and Its Use for Amperometric Biosensors[J]. Analytical chemistry,2011,73(21):5310-5315.
Alcohol Biosensor Based on Multi-Walled Carbon Nanotubes/Platinum Nanoparticles Nanocomposite*
MIAOZhiying1,NIANChen2,SHAOXueguang3,CHENQiang4*
(1.School of Basic Medical Sciences,North China University of Science and Technology,Tangshan Hebei 063000,China;2.Hainan Medical College,Haikou 571101,China;3.State Key Laboratory of Medicinal Chemical Biology,Nankai University,Tianjin 300071,China;4.Key Laboratory of Bioactive Materials,Ministry of Education,NankaiUniversity,Tianjin 300071,China)
MWCNTs-PtNPs nano composite was prepared by ultrasonic method,and its modified to ethanol biosensor showed good performance. The experimental results show that the minimum detection limit of the sensor is 0.02 mmol/L,the linear range is 0.25 mmol/L~3.0 mmol/L,the sensitivity is 0.923 32 μA/(mmol/L),and has high stability and good reproducibility.
biosensor;ethanol;MWCNTs-PtNPs;nanocomposite

苗智颖(1980-),男,博士,博士后,毕业于南开大学生命科学学院,主要从事生物传感器相关研究工作,miaozhiying@ncst.edu.cn;陈 强(1962-)男,博士,博士后,教授,毕业于日本东北大学药学部,目前从事生物分子可控有序自组装、光电化学纳米生物传感技术、生物分子识别分析技术等分析化学和生命科学的前沿交叉学科研究工作,qiangchen@nankai.edu.cn。
项目来源:国家自然科学基金(81273993)
2016-05-11 修改日期:2016-09-21
TP212.2
A
1004-1699(2017)01-0016-04
C:7230J
10.3969/j.issn.1004-1699.2017.01.003

