叶酸-O-羧甲基壳聚糖的制备与光谱分析
孙 双,魏长平,伞 靖,汪凤明,董丽丹
(长春理工大学化学与环境工程学院,吉林长春 130022)
叶酸-O-羧甲基壳聚糖的制备与光谱分析
孙 双,魏长平∗,伞 靖,汪凤明,董丽丹
(长春理工大学化学与环境工程学院,吉林长春 130022)
壳聚糖经羧甲基化制备出的O-羧甲基壳聚糖,采用离子交联法与叶酸复合制备出叶酸-O-羧甲基壳聚糖复合物。通过红外光谱、X射线衍射光谱、扫描电镜等测试手段进行表征,探讨了叶酸、O-羧甲基壳聚糖的质量比对复合物结构及性能的影响,利用断尾取血法探究复合物的凝血、止血性能。结果显示,叶酸-O-羧甲基壳聚糖凝血、止血效果显著。当叶酸与O-羧甲基壳聚糖的质量比为2∶5时,二者基团的作用力最强,复合物结构最稳定,凝血、止血效果最好。
壳聚糖;叶酸;O-羧甲基壳聚糖;光谱分析;止血性能
1 引 言
人体血液的主要成分之一是红细胞,其细胞膜由蛋白质、脂质、糖脂和无机离子等组成,表面带负电荷,容易粘附在带正电荷的材料表面[1]。壳聚糖作为甲壳素的脱乙酰基衍生物,是唯一带正电荷的天然碱性多糖[2],其氨基可与红细胞细胞膜表面的氨酸残基发生电荷反应,使红细胞大量黏附聚集于伤口处,形成血栓,从而使血液凝固[3]。同时壳聚糖具有生物相容性好、可生物降解性、免疫活性低[4-5]、止血、抑菌消炎的优点[6-7],在生物材料、医学等领域的应用备受关注。但壳聚糖只溶于酸性溶液,使其应用受到限制。因此,人们将壳聚糖进行理化改性来改善其溶解性能,提高止血效果。O-羧甲基壳聚糖是壳聚糖经过羧甲基化后的产物,同时含有羧基和氨基两种基团,比壳聚糖具有更好的水溶性、免疫性、生物相容性及生物降解性等生物学特性[8-11],同时保留了氨基的止血作用。
叶酸是水溶性的维生素,具有化学性质简单、方便易得、无免疫原性的优点,叶酸-叶酸受体靶向是近年来备受青睐的一种新型药物[12]。通过配体-受体中氨基的作用可将基因、药物靶向导入高表达叶酸受体的病理组织和细胞中,而正常细胞不受影响,从而大大增加了治疗的安全性和有效性[13]。本实验制备了叶酸-O-羧甲基壳聚糖的复合物,探讨了叶酸与O-羧甲基壳聚糖质量比对复合物微观结构及性能的影响,利用光学测试手段对样品进行了表征。采用成年雄性昆明鼠活体断尾取血试验,来考察复合物的凝血、止血性能。
2 实 验
2.1 主要试剂
壳聚糖(生化试剂,国药集团化学试剂有限公司);氯乙酸(分析纯);叶酸(FA,生化试剂,惠世生化试剂有限公司);二甲基亚砜(分析纯,北京化工厂);月桂酸钠(分析纯,阿拉丁);乙酸钠(分析纯,沈阳市试剂四厂)。
2.2 实验方法
称取3.0 g壳聚糖分散于异丙醇溶液中,室温下滴加5 mL NaOH溶液,30℃水浴下加入20 mL氯乙酸/异丙醇溶液。调pH约为7.0,洗涤、过滤、烘干,制得O-羧甲基壳聚糖(O-CMCS)。
称取0.221 g叶酸溶解于15 mL二甲基亚砜溶液,加入月桂酸钠(FA与月桂酸钠的量比为1∶1)至溶解。称取一定量的O-羧甲基壳聚糖(叶酸、羧甲基壳聚糖质量比分别为2∶3、2∶4、2∶5、2∶6、2∶7、2∶8)溶于醋酸-醋酸钠缓冲溶液中,加入叶酸溶液,经反应、离心、洗涤、过滤、烘干,制得叶酸-O-羧甲基壳聚糖粉体(FA-O-CMCS)。
选用体重为25 g左右的雄性昆明鼠,采用断尾取血法进行体外凝血、止血试验,每组平行测试3次,取平均值。
2.3 样品表征
采用傅里叶变换红外光谱仪室温下测试样品的红外光谱,测量范围为4 000~400 cm-1、采用X射线衍射光谱仪分析样品结构,辐射源为Cu Kα线,测试范围为10°~90°。采用扫描电子显微镜观察样品表面形貌。
3 结果与讨论
3.1 红外光谱分析
由图1的壳聚糖与O-羧甲基壳聚糖的红外光谱可知,—NH2的吸收峰3 434.98 cm-1偏移到3 444.63 cm-1,偏移了10 cm-1。3 334.69 cm-1为—OH的伸缩振动峰,经过羧甲基取代后偏移到3 294.19 cm-1,偏移了40.5 cm-1,说明羧甲基与壳聚糖的氨基、羟基均发生了反应。在羧甲基化过程中,壳聚糖的C—O吸收峰1 261.36 cm-1消失,1 159.14 cm-1吸收峰偏移到1 108.9 cm-1,说明壳聚糖羧甲基化过程中—OH发生了反应。壳聚糖的1 326.93 cm-1吸收峰为C—NH2的伸缩振动峰,经羧甲基后该峰无变化。综上所述,羧甲基化时主要是在壳聚糖的C3—OH发生取代,从而制备了O-羧甲基壳聚糖。
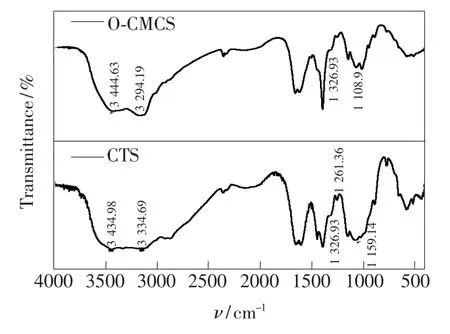
图1 CTS和O-CMCS的红外光谱Fig.1 Infrared spectra of CTS and O-CMCS
图2为叶酸-O-羧甲基壳聚糖、叶酸及O-羧甲基壳聚糖的红外光谱。由图可知,3 444.63 cm-1为O-羧甲基壳聚糖中—NH2的伸缩振动峰,与叶酸复合后偏移到3 400.27 cm-1,而1 020~1 340 cm-1处C—N伸缩振动峰无变化,说明叶酸基团取代了O-羧甲基壳聚糖氨基上的氢。叶酸中3 542.99,2 962.46,2 567.08 cm-1处的吸收峰均为羧酸中—OH的伸缩振动峰,复合后该峰消失,说明复合反应主要是叶酸中的羧基上OH与O-羧甲基壳聚糖中氨基上的H脱水作用。
叶酸对机体无任何毒副作用,其活化量比为1∶1时复合效果最佳。考虑到叶酸价格比壳聚糖高得多,为尽量提高复合物中具有止血作用的氨基含量、经济性等,我们对叶酸与O-羧甲基壳聚糖(O-CMCS)质量比分别为2∶3、2∶4、2∶5、2∶6、2∶7、2∶8的复合物进行比较分析,其红外光谱如图3所示。对于质量比为2∶3的复合物,3 431.31 cm-1是叶酸的氨基的吸收峰,随着O-羧甲基壳聚糖含量的升高,当质量比为2∶5时,该峰偏移到3 427.27 cm-1,这是由于引入了亲水基团。当叶酸与O-羧甲基壳聚糖质量比为2∶6、2∶7、2∶8时,该峰消失,这是由于叶酸含量低使反应不充分。可见,当质量比为2∶5时,叶酸-O-羧甲基壳聚糖中的氨基含量最高,此时的止血效果最好。

图2 FA-OCMCS、FA、O-CMCS的红外光谱。Fig.2 Infrared spectra of FA-O-CMCS,FA and O-CMCS,respectively.

图3 不同质量比FA-O-CMCS的红外光谱Fig.3 Infrared spectra of FA-O-CMCS with different quality proportion
3.2 XRD分析
图4为壳聚糖、O-羧甲基壳聚糖和叶酸-O-羧甲基壳聚糖的XRD谱图,峰的强度与其结晶性成正比。壳聚糖在19.74°及20.36°出现相关衍射峰,两峰重叠。改性后的O-羧甲基壳聚糖两峰合并为19.68°处的强衍射峰,峰形较尖锐,这说明O-羧甲基壳聚糖的结晶性较好,同时与其溶解性较差相对应。叶酸-O-羧甲基壳聚糖在21.1°和21.98°两次处出现衍射峰,两峰部分重合,说明叶酸-O-羧甲基壳聚糖复合物的结晶性更强,基团间作用力较大,复合物结构较为稳定。

图4 CTS、O-CMCS及FA-O-CMCS的XRD谱图。Fig.4 XRD patterns of CTS,O-CMCS and FA-O-CMCS,respectively.
图5为叶酸与O-羧甲基壳聚糖不同质量比的样品的XRD谱图。当质量比为2∶3时,样品在21.72°和22.42°两处出现强衍射峰;随着O-羧甲基壳聚糖质量的增加,峰逐渐尖锐,在24.1°处出现新的衍射峰;当质量比为2∶6时,样品的衍射峰位置改变,且24.1°处的峰消失,说明晶型发生变化;当质量比为2∶7、2∶8时,复合物的衍射峰位置不稳定,即晶型不稳定,说明此时物质结构不稳定。可见,叶酸与O-羧甲基壳聚糖的质量比为2∶5是复合物的最佳质量比。
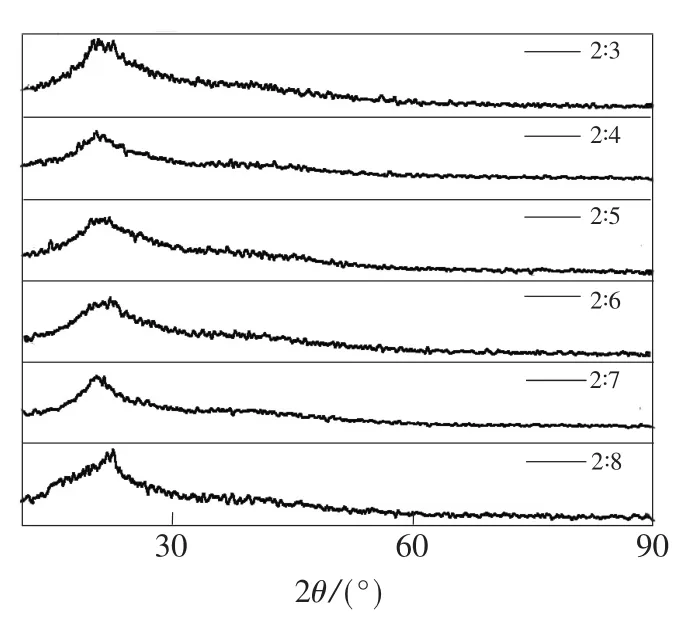
图5 不同质量比FA-O-CMCS的XRD谱图Fig.5 XRD patterns of FA-O-CMCS with different quality proportion
3.3 SEM分析
O-羧甲基壳聚糖与叶酸-O-羧甲基壳聚糖的扫描电镜图如图6所示。O-羧甲基壳聚糖为规则块状颗粒,颗粒大小均匀,平均粒径约为650~700 nm;叶酸-O-羧甲基壳聚糖颗粒呈均匀球状,分散性较好,样品的平均粒径约为0.9~1 μm。这说明O-羧甲基壳聚糖与叶酸复合后,通过与叶酸的键合作用,复合物结构较为稳定。

图6 O-CMCS(a)与FA-O-CMCS(b)的SEM图Fig.6 SEM images of O-CMCS(a)and FA-O-CMCS(b)
3.4 性能分析
空白试验、壳聚糖、O-羧甲基壳聚糖、叶酸-O-羧甲基壳聚糖的凝血、止血性能测试结果如表1、表2所示,数据为平行3组测试的平均值。由表可知,壳聚糖及其衍生物在缩短凝血、止血时间上有较明显的作用。壳聚糖平均凝血、止血时间为231 s和533 s,较空白试验分别缩短了89 s和565 s;O-羧甲基壳聚糖的凝血、止血时间分别为200 s和471 s,复合叶酸后的叶酸-O-羧甲基壳聚糖的凝、止血时间分别为139 s和266 s,时间又缩短了61 s和205 s。复合物的凝血、止血效果较为显著,结合微观结构分析可知,叶酸的复合大大增加了复合物中氨基的含量,由于氨基的止血作用及靶向作用,使复合物达到了快速止血的目的。
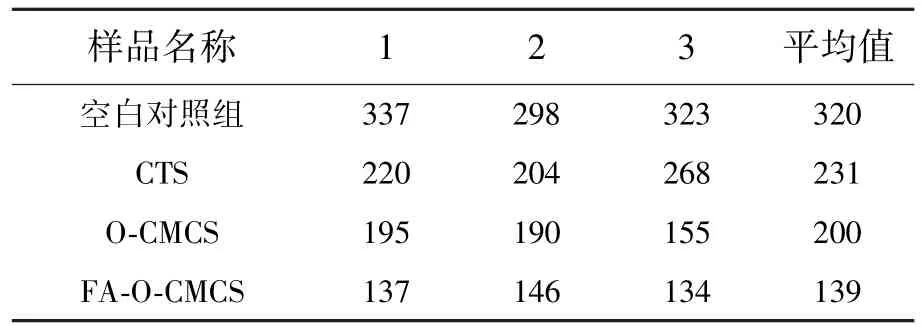
表1 样品的凝血测试结果Tab.1 Coagulation test results of the sampless
图7为空白对照组与叶酸与O-羧甲基壳聚糖在质量比分别为2∶3、2∶4、2∶5、2∶6、2∶7、2∶8时的凝血、止血时间。由图可知,与空白对照组相比,改性复合物有较好的止血效果。质量比为2∶3时,复合物的凝血、止血时间分别为166 s和290 s。随着O-羧甲基壳聚糖含量的增加,凝血、止血时间均逐渐缩短。直至质量比为2∶5时,凝血、止血时间分别为139 s和266 s,达到最低点。然后随着O-羧甲基壳聚糖含量的增加,凝血、止血时间又开始延长。可见,当质量比为2∶5时,复合物具有最好的凝血、止血性能。

表2 样品的止血测试结果Tab.2 Hemostasis test results of the sampless
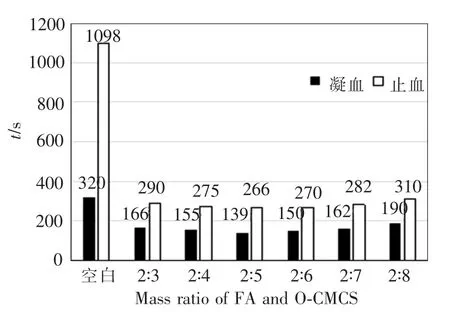
图7 不同质量比样品的凝血、止血性能。Fig.7 Clotting and hemostatic performance of the sample with different quality proportion
4 结 论
叶酸羧基上的—OH与O-羧甲基壳聚糖氨基脱水作用生成了叶酸-O-羧甲基壳聚糖复合物,结晶性较强,颗粒大小均匀(约为0.9~1 μm),结构较稳定。叶酸-O-羧甲基壳聚糖的凝血、止血效果显著,凝血、止血时间分别为139 s和266 s,有一定的凝血、止血效果。叶酸与O-羧甲基壳聚糖的质量比为2∶5时,二者基团的作用力最强,复合物结构最稳定,凝血、止血效果较好。
[1]蔡树山,刘宗华,陈莉莉,等.叶酸-壳聚糖偶联物的制备及对人体血红细胞的影响[J].光谱实验室,2012,29 (3):1702-1707.CAI S S,LIU Z H,CHEN L L,et al..Preparation of folate-chitosan conjugate and its influence on human red blood cells [J].Chin.J.Spectrosc.Lab.,2012,29(3):1702-1707.(in Chinese)
[2]程沁园.壳聚糖止血活性及其生物安全性评价研究[D].无锡:江南大学,2013. CHENG Q Y.The Hemostatic Activity and Biological Safety Evaluation of Chitosan[D].Wuxi:Jiangnan University,2013.(in Chinese)
[3]卢斌,钱利强,章志量.壳聚糖止血机理及应用进展研究[J].健康研究,2010,30(1):55-58. LU B,QIAN L Q,ZHANG Z L.Hemostatic mechanism of chitosan and the progress of its application[J].Health Res.,2010,30(1):55-58.(in Chinese)
[4]尹刚.温敏性壳聚糖止血膜止血作用的实验研究[D].上海:第二军医大学,2014. YIN G.Experimental Study on Hemostasis of Thermosensitive Chitosan Hemostatic Film[D].Shanghai:Second Military Medical University,2014.(in Chinese)
[5]WANG D S,LI J G,LI H P,et al..Preparation and drug releasing property of magnetic chitosan-5-fluorouracil nano-particles[J].Trans.Nonferr.Met.Soc.China,2009,19(5):1232-1236.
[6]高文彪,张岩睿,张军.胶原/壳聚糖止血敷料在外科伤口中的应用[J].中国组织工程研究,2012,16(29): 5477-5480. GAO W B,ZHANG Y R,ZHANG J.Collagen/chitosan hemostatic dressings in surgical wounds[J].Chin.J.Tissue Eng.Res.,2012,16(29):5477-5480.(in Chinese)
[7]KAYA M,CAKMAK Y S,BARAN T,et al..New chitin,chitosan,and O-carboxymethyl chitosan sources from resting eggs of daphnia longispina(Crustacea);with physicochemical characterization,and antimicrobial and antioxidant activities [J].Biotechnol.Bioprocess Eng.,2014,19(1):58-69.
[8]王志华,江阳阳,余晓华,等.壳聚糖及其水溶性衍生物对小鼠免疫功能的影响[J].食品科学,2016,37(1): 198-202. WANG Z H,JIANG Y Y,YU X H,et al..Effect of chitosan and its water-soluble derivatives on immune function in mice [J].Food Sci.,2016,37(1):198-202.(in Chinese)
[9]TUNGTONG S,OKONOGI S,CHOWWANAPOONPOHN S,et al..Solubility,viscosity and rheological properties of water-soluble chitosan derivatives[J].Maejo Int.J.Sci.Technol.,2012,6(2):315-322.
[10]郭苗苗,吴迪,刘辉,等.O-羧甲基壳聚糖止血海绵止血和愈创效果研究[J].中国药师,2012,15(11): 1538-1541. GUO M M,WU D,LIU H,et al..Studies on hemostatic and wound healing effect of O-carboxymethyl chitosan hemostatic sponges[J].China Pharm.,2012,15(11):1538-1541.(in Chinese)
[11]马烽,陆丰艳,秦岩,等.N,O-羧甲基壳聚糖磁性复合微球的制备与表征[J].材料工程,2014(8):41-45. MA F,LU F Y,QIN Y,et al..Preparation and characterization of magnetic N,O-carboxymethyl chitosan composite microspheres[J].J.Mater.Eng.,2014(8):41-45.(in Chinese)
[12]武润平,李巧玲,刘晓霞,等.叶酸偶联O-羧甲基壳聚糖的制备及其表征[J].化工技术与开发,2013,42(2):1-3. WU R P,LI Q L,LIU X X,et al..Preparation and characterization of folate O-carboxymethyl chitosan[J].Technol. Dev.Chem.Ind.,2013,42(2):1-3.(in Chinese)
[13]邢志华,方桂珍.离子交联法制备叶酸-壳聚糖微球工艺研究[J].黑龙江医药,2011,24(6):915-917. XING Z H,FANG G Z.Folic acid ionomer prepared folic acid-chitosan microsphere production[J].Heilongjiang Med. J.,2011,24(6):915-917.(in Chinese)

孙双(1991-),女,辽宁抚顺人,硕士研究生,2014年于渤海大学获得学士学位,主要从事医用基础功能材料的研究。
E-mail:lemondave@sina.com

魏长平(1960-),女,吉林长春人,教授,博士生导师,1999年于吉林大学获得博士学位,主要从事医用基础功能材料的研究。
E-mail:changpingwei@hotmail.com
Preparation and Spectral Analysis of Folic Acid-O-Carboxymethyl Chitosan
SUN Shuang,WEI Chang-ping∗,SAN Jing,WANG Feng-ming,DONG Li-dan
(School of Chemistry and Environment Engineering,Changchun University of Science and Technology,Changchun 130022,China)∗Corresponding Author,E-mail:changpingwei@hotmail.com
O-carboxymethyl chitosan was prepared by the carboxymethyl chitosan,and the folic acid-O-carboxymethyl chitosan compounds were prepared by ion crosslinking method.The samples were characterized by means of infrared spectroscopy,X-ray diffraction and scanning electron microscopy.The influences of the mass ratio of folic acid and carboxymethyl chitosan on the composite microstructure and properties were discussed.The coagulant and hemostatic properties of the folic acid-O-carboxymethyl chitosan compounds were explored by tail blood method.The results show that the blood coagulation and hemostatic effects of the folic acid-O-carboxymethyl chitosan compounds are remarkable.When the mass ratio of folic acid and carboxymethyl chitosan is 2∶5,the interaction force between folic acid and carboxymethyl chitosan is the strongest,the complex structure is the most stable,and the blood coagulation and hemostatic effect is the best.
chitosan;folic acid;O-carboxymethyl chitosan;spectral analysis;hemostatic properties
O614
A
10.3788/fgxb20173802.0160
1000-7032(2017)02-0160-05
2016-06-28;
2016-09-24

