阿帕替尼联合顺铂对食管癌ECA109细胞抑制作用及机制探讨
安改丽,李 旭,黄尚科,冯 璐,白 俊,赵新汉△
1.陕西省人民医院肿瘤内科(西安710068), 2.西安交通大学第一附属医院肿瘤内科(西安 710061),3.陕西省肿瘤医院内一科(西安 710061)
△通讯作者
阿帕替尼联合顺铂对食管癌ECA109细胞抑制作用及机制探讨
安改丽1,2,李 旭3,黄尚科2,冯 璐2,白 俊1,赵新汉2△
1.陕西省人民医院肿瘤内科(西安710068), 2.西安交通大学第一附属医院肿瘤内科(西安 710061),3.陕西省肿瘤医院内一科(西安 710061)
目的:探讨阿帕替尼(Apatinib)联合顺铂对食管癌细胞ECA109的抑制作用及其可能的分子机制。方法:对人食管癌细胞株ECA109,单独或联合给药后采用MTT法测定细胞增殖,流式细胞仪测定细胞凋亡,Western blot观察VEGF、AKT的表达情况。结果:Apatinib及顺铂单药对食管癌细胞株ECA109细胞均有增殖抑制作用,且结果呈时间剂量依赖关系;与对照组相比,Apatinib联合顺铂作用后有协同诱导凋亡作用,两两比较差异均有统计学意义(P<0.05);Western blot检测显示对照组与Apatinib单药组,联合用药组与单药组比较,AKT及VEGF表达均显著下调(P<0.05),而顺铂单药组与对照组相比较,AKT及VEGF表达下调不显著。结论:Apatinib和顺铂联合应用能够在体外协同抑制食管癌ECA109细胞增殖,促进其凋亡,其作用机制可能与下调AKT、VEGF有关。
食管癌是我国常见的恶性肿瘤,随着手术、化疗及放疗技术的发展,食管癌的临床治疗有了很大的进展,但是其5年生存率仍低于20%[1]。在我国90%以上食管癌为鳞状细胞癌,腺癌占5%左右,小细胞未分化癌少见。随着近几年分子肿瘤学的进展,分子靶向治疗在多种肿瘤中显示出较好疗效,在食管癌治疗中的应用探索也越来越多。阿帕替尼(Apatinib)是一种新型的小分子酪氨酸激酶抑制剂,通过选择性抑制血管内皮生长因子受体2(VEGFR-2)的磷酸化来达到抗血管新生的目的[2]。在临床前研究中,Apatinib在胃癌、结直肠癌、肝癌、肉瘤及非小细胞肺癌等多种移植瘤小鼠模型中均有明显的抑瘤作用,且与奥沙利铂、氟尿嘧啶、阿霉素及多西他赛联合应用在上述移植瘤鼠模型上有协同作用[3],根据其在晚期胃癌中的3期临床研究结果,该药已获批用于晚期胃癌的治疗。既往有文献报道食管鳞癌细胞高表达VEGFR1-3[4],但目前将Apatinib用于食管癌治疗研究的文献很少。本研究拟将新型抗肿瘤血管生成药物Apatinib与经典化疗药物顺铂联合应用,观察其对食管癌细胞株ECA109的抑制作用,并通过检测血管内皮生长因子(VEGF)、蛋白激酶B(AKT)水平推测其可能的作用机制,为靶向治疗与化疗联合的生物化疗模式提供体外实验的理论依据。
材料及方法
1 材 料 人食管癌细胞株ECA109(西安交通大学医学院环境与疾病相关基因教育部重点实验室惠赠);阿帕替尼(Apatinib)(江苏恒瑞公司);顺铂(山东齐鲁制药厂),1640培养基(美国GIBCO公司);胎牛血清(以色列Biological Industries公司);噻唑兰(MTT)(美国Sigma公司);Annexin V-APC/7-AAD双染凋亡试剂盒(深圳晶美生物公司);二甲基亚砜(DMSO)(美国Sigma公司);细胞培养箱(美国Thermo公司);FACScan 流式细胞仪(美国BD公司);anti-VEGF(Cell Signaling Technology),anti-AKT(Cell Signaling Technology),鼠抗人β-actin单克隆抗体(美国Santa Cruz公司);二抗羊抗鼠单克隆抗体 (美国Jackson公司),Genios 多功能酶标仪(美国TECAN公司);Western blot电泳和转膜装置(美国BIO-RAD 公司);Odyssey 双色红外荧光成像系统扫描仪(美国LI-COR公司产品);倒置显微镜( DXM1200)(日本Nikon公司)。
2 方 法 ①细胞培养:对食管癌细胞ECA109采用含有10%胎牛血清的1640培养基进行培养,在37 ℃、5% CO2饱和湿度培养箱内培养,待其贴壁生长至70%~80%时,用0.25%胰蛋白酶消化传代。随后取对数生长期细胞进行后续的实验。②药物稀释方法:将Apatinib药物用100% DMSO 溶解配置成母液,保存于-20 ℃条件下。实验用时用1640培养基稀释至目标浓度,使DMSO终浓度< 0.5 %,不影响细胞生长。③实验分组:实验分为空白对照组、Apatinib单药组、顺铂单药组、Apatinib+顺铂组。检测细胞增殖抑制率时Apatinib单药组浓度分别是2.5、5、10、20、40 μmol/L,顺铂单药浓度分别是5、10、20、40、80 μg/ml。联合处理组:以相应的Apatinib浓度和顺铂浓度联合应用;流式细胞仪检测细胞凋亡以及Western blot相关实验时单药Apatinib浓度为5 μmol/L,单药顺铂浓度为4 μg/ml,联合处理组为上述两药浓度对细胞进行联合处理,空白对照组仅用1640培养基进行细胞处理。
3 检测项目及方法 ①MTT法检测细胞活性,并计算细胞抑制率:取对数生长期的人食管癌细胞株ECA109(5000个细胞/孔)接种于96孔板上,每孔加入100 μl细胞悬液,培养24 h后,倾去培养基,加入不同浓度的Apatinib和(或)顺铂,每组设6个复孔,每孔加100 μl。将与实验组中含有最大浓度DMSO的培养液作为空白对照组,不含细胞的无血清培养基为调零孔,培养48 h后每孔加入MTT溶液(浓度为5 mg/ml)10 μl,继续培养4 h后终止培养,小心吸去药液及培养液,每孔中加入DMSO 150 μl,振荡10 min以充分溶解结晶物。用酶标仪在490 nm处测定每孔的OD值。细胞抑制率(%)=(1-试验孔平均OD值/对照孔平均OD值)×100%,根据上述结果绘制细胞生长抑制率曲线。所有实验均重复3次。②流式细胞仪检测细胞凋亡:取对数生长期的ECA109细胞,调整细胞浓度为2×105/ml,以2 ml/孔接种至6孔板内,含10%胎牛血清的1640培养基孵育24 h后,实验组分别加入相应浓度的Apatinib、顺铂单药及两药联合,对照组不加任何药物作为参考,每组设3个复孔,然后置于37 ℃、5% CO2饱和湿度培养箱内培养48 h后,用不含EDTA的胰酶消化各处理组细胞并对细胞进行收集,用4 ℃预冷的PBS对细胞进行2次洗涤,离心后弃去上清,加入500 μl的Binding Buffer使悬浮细胞,后分别加入5 μl Annexin V-APC和5 μl的7-AAD染液,混匀室温避光放置15 min后上流式细胞仪检测,所有试验均重复3次。③Western blot检测细胞蛋白的表达:首先是细胞总蛋白的提取,取对数生长期的细胞,待细胞密度达到60%~70%,分别加入Apatinib、顺铂,以及Apatinib+顺铂处理48 h后,弃去细胞培养基,冰PBS洗2次,尽可能弃去PBS,加入配置好的适量RIPA蛋白裂解液于培养板中,冰上抚育60 min,刮取细胞并转移至离心管中,4 ℃,10 000 r/min离心10 min,将上清(含有蛋白样品)移入新的试管中,分装蛋白样品并于-80 ℃保存。在5%~10% SDS-聚丙烯酰胺凝胶上,每孔加入蛋白样品10 μl进行电泳。同时裁取所需大小PVDF膜放于甲醇溶液中浸泡5 min后浸于转移液中以备用,按照4层滤纸、PVDF膜、凝胶、4层滤纸的顺序将其放置在转膜架上进行转膜,转膜结束后用含5%脱脂奶粉的TBST缓冲液室温封闭2 h,随后用按照一定比例稀释好的特异性一抗封闭PVDF膜,放于4 ℃过夜,第2天取出PVDF膜后用TBST溶液洗膜3次,10 min/次,洗膜完毕后用二抗(1∶5000)室温封闭2 h,再用TBST洗膜3次,10 min/次,洗膜结束后,用干净滤纸吸去PVDF膜上的TBST溶液,然后将膜放进准备好的干净培养皿中,在膜表面均匀滴加ECL化学发光试剂显色,然后将培养皿放入凝胶成像系统中成像,最后保存结果。上述实验操作过程均需重复3次。

结 果
1 MTT结果 见图1。MTT法检测不同浓度Apatinib、顺铂及Apatinib联合顺铂对ECA109细胞增殖的抑制作用,结果发现,不同浓度的Apatinib及顺铂作用于ECA109细胞后对细胞生长均有不同程度的抑制作用,联合用药后抑制作用增强,且差异有统计学意义(P<0.05)。无论单药或者联合用药,抑制率均呈现剂量依赖性。

图1 Apatinib、顺铂单药及联合处理组作用48 h后对ECA109细胞株的生长抑制作用
2 流式细胞仪测定细胞凋亡 见图2,表1。ECA109细胞分别经对照组,Apatinib单药组,顺铂单药组,Apatinib+顺铂联合组处理48 h后,采用Annexin V-APC/7-AAD法经流式细胞仪测定细胞凋亡。结果发现:对照组、Apatinib单药组、顺铂单药组及两药联合组细胞凋亡率分别为:7.93%、11.06%、24.07 %、38.72%;将单药处理组、联合处理组分别与对照组之间进行两两比较,其细胞凋亡率均有升高,并且分析结果提示差异有统计学意义(P<0.05)。
3 不同处理组VEGF、AKT的表达情况 见表2。不同药物组对ECA109细胞株作用48 h后其VEGF、AKT均有表达,其中两药联合组及Apatinib单药组与空白对照组相比,其VEGF、AKT蛋白表达下降(P<0.05),联合组较单药组表达下降(P<0.05),顺铂单药组与空白对照组比较,VEGF、AKT表达下降不明显(P>0.05)。

表1 Apatinib、顺铂单药及联合对ECA109细胞凋亡率的影响
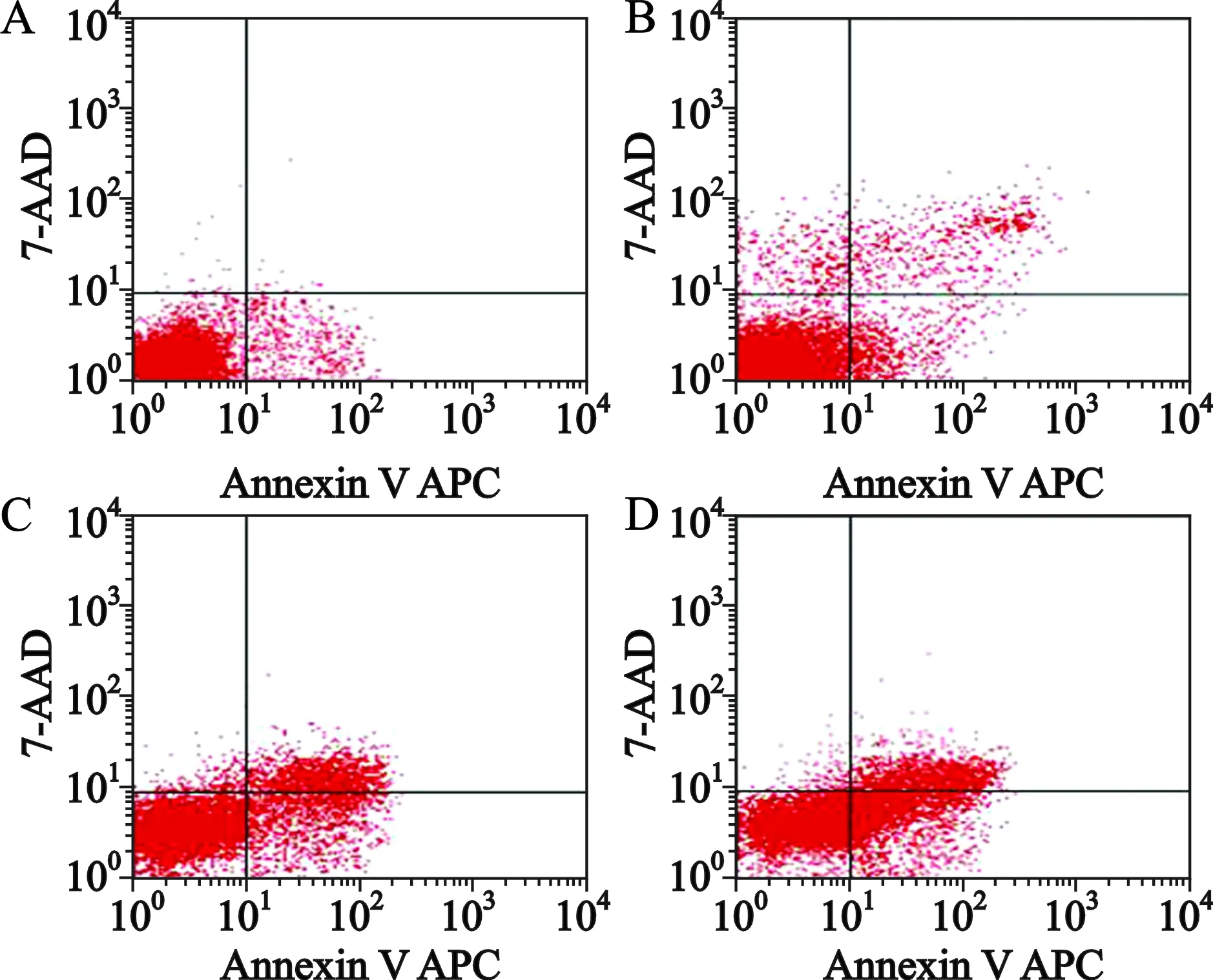
A.对照组;B.Apatinib组;C.顺铂组;D.Apatinib+顺铂组

图2 Apatinib、顺铂单药及联合对ECA109细胞凋亡作用比较
注:与空白对照组比较,*P<0.05;与Apatinib、顺铂组比较, △P<0.05
讨 论
根据药物作用于肿瘤细胞通路的不同,现在常用的靶向治疗药物分为以下几种:EGFR抑制剂、VEGF抑制剂、HER2抑制剂、c-MET抑制剂、COX-2抑制剂、PI3K/AKT/mTOR抑制剂和其他通路药物。从临床研究的数据来看,上述药物多数应用于食管癌后疗效并不显著,且这些数据大多来源于西方人群的食管腺癌或食管胃结合部癌,缺少来自以鳞癌为主要病理特征的中国人群的数据支持。肿瘤抗血管生成靶向治疗已成为目前抗肿瘤靶向治疗的研究热点,VEGF-VEGFR介导的血管生成在食管癌发展中起到了重要的作用。越来越多的数据提示食管癌中VEGF-VEGFR表达与预后的相关性[5-6],在一项研究中发现,食管鳞癌细胞胞浆中VEGFR1的表达与淋巴结转移相关,和预后无关;胞浆VEGFR2表达与临床病理特征及预后不相关,而与肿瘤血管密度及淋巴结播散有关,这揭示了VEGFR及其配体作用后与肿瘤进展的相关性[7]。
Apatinib是一种新型的小分子酪氨酸激酶抑制剂,通过选择性地抑制血管内皮生长因子受体2(VEGFR-2)磷酸化而产生抑制肿瘤血管新生的作用[7]。因其在晚期胃癌临床试验中的良好效果,2014年已被国家食品药品监督管理局批准为晚期胃癌及胃食管结合部腺癌的适应证,而且在肝癌、非小细胞肺癌、结直肠癌、乳腺癌中的临床试验正在进展中。本研究将新型抗血管生成药物Apatinib与传统化疗药物顺铂联合应用,经体外实验证实两药联合可以增强对食管癌ECA109细胞株的生长抑制作用,且呈现浓度依赖性,并且两药联合后细胞凋亡率升高,较单药组及对照组比较,差异均有统计学意义。这与该药在其他实体瘤动物模型中结果一致。同时我们采用Western blot法检测了不同药物处理后ECA109细胞中VEGF蛋白的表达情况,提示Apatinib单药、顺铂单药及两药联合组与空白对照组比较,其VEGF蛋白表达均有降低,两药联合及Apatinib单药组与对照组比较差异有统计学意义。本研究联合用药取得了更好的抑制肿瘤生长并促进肿瘤细胞凋亡作用,研究结果支持了生物化疗模式这一肿瘤治疗新模式的适用性,联合治疗所需药物剂量较单药组明显降低,因而可能减少药物的毒副作用,提高耐受性。同时提示Apatinib可能通过下调VEGF的表达发挥抗癌作用。
顺铂是细胞周期非特异性化疗药物,其最主要的作用机制是诱导肿瘤细胞凋亡。磷脂酰肌醇-3-激酶(PI3K)/AKT是抵抗细胞凋亡的重要因子,细胞过度表达PI3K/AKT可以抑制肿瘤细胞凋亡。文献报道,PI3K/AKT的表达与癌细胞对顺铂的耐药有关[8],用LY294002抑制PI3K活性后,可明显增加顺铂对耐顺铂人鳞状细胞癌UM-SCC-23细胞的促凋亡作用。研究提示在肺腺癌细胞A549中检测到AKT1过表达,这明显减弱了A549细胞对顺铂的化疗敏感性。顺铂可以通过耦合到细胞DNA双链结构,引起DNA损伤,从而激活PI3K/AKT通路,引起细胞凋亡的抑制,由此降低化疗效果[9]。文献报道食管鳞癌细胞高表达PI3K/AKT,且其高蛋白水平与细胞分化程度低、淋巴结转移等病理因素相关。本研究通过Western blot法检测食管癌细胞株ECA109经不同药物处理后AKT蛋白表达情况,结果发现,与空白对照组相比,顺铂单药组、Apatinib单药组及两药联合处理组中AKT表达均有降低,Apatinib单药组、联合处理组与空白对照组相比,差异具有统计学意义,提示Apatinib与顺铂联合用药后增强细胞凋亡率的结果与其可以逆转AKT介导的顺铂耐药可能有关。
综上所述,本研究结果表明, Apatinib作为一种安全有效的抗肿瘤血管生成药物,对食管癌细胞株ECA109显示出良好的细胞生长抑制、促凋亡作用,且与顺铂联用有协同抑制作用,其发挥作用机制可能与下调VEGF、AKT表达有关,这为Apatinib应用于食管癌的临床研究提供了一定的理论基础。
[1] Kim T,Grobmyer SR,Smith R,etal.Esophageal cancer:the five year survivors[J].J Surg Oncol,2011,103(2):179-183.
[2] Li J,Zhao XM,Chen L,etal.Safety and pharmacokineties of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J].BMC Cancer,2010,10(5):529-534.
[3] Scott AJ, Messersmith WA, Jimeno A.Apatinib: a promising oral antiangiogenic agent in the treatment of multiple solid tumors[J].Drugs Today (Barc),2015,51(4):223-229.
[4] Wen XU,Bin L,Alfred KY L,etal.Targeting VEGFR1-and VEGFR2-expressing non-tumor cells is essential for esophageal cancer therapy[J].Oncotarget,2015,6(3):1790-1805.
[5] Bose D,Meric-Bernstam F,Hofstetter W,etal.Vascular endothelial growth factor targeted therapy in the periopetative setiting:implications for patient care[J].Lancet Oncol,2010,11:373-382.
[6] Cui Y, Dong C.Expression of cyclooxygenase-2, vascular endothelial growth factor, and epidermal growth factor receptor in Chinese patients with esophageal squamous cell carcinoma[J].J Cancer Res Ther,2015,11:44-48.
[7] Eng L, Azad AK, Qiu X,etal.Discovery and validation of vascular endothelial growth factor (VEGF) pathway polymorphisms in esophageal adenocarcinoma outcome[J].Carcinogenesis,2015,36(9):956-962.
[8] Zhou HH,Chen L,Liang HF,etal.Smad3 Sensitizes Hepatocelluar Carcinoma Cells to Cisplatin by Repressing Phosphorylation of AKT[J].Int J Mol Sci,2016,17(4):610.
[9] Koberle BI,Tomicic MT, Usanova S,etal.Cisplatin resistance: preclinical findings and clinical Implications[J].Biochim Biophys Acta,2010,1806(2):172-182.
(收稿:2016-06-13)
食管肿瘤 分子靶向治疗 顺铂 细胞凋亡 蛋白激酶类 血管内皮生长因子 @阿帕替尼
R735.1
A
10.3969/j.issn.1000-7377.2017.02.004

