玉米骨干亲本及其衍生系中基因的序列变异及与株高等性状的关联分析
胡雅+潘亮+徐辰武

摘要:玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因是显性矮化基因,由于其突变体在DELLA区的碱基缺失而使其呈组成型表达抑制GA响应,从而表现出植株矮小,种子发芽率低,叶片呈暗绿色等特性。对玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因在来源广泛的96份玉米自交系中进行了目标序列重测序,并与株高和穗位高2个株型性状以及穗长、穗粗、轴粗、穗质量、行粒数、穗行数和粒质量7个穗部性状进行关联分析。[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因在供试玉米自交系中共有66个变异位点,包括18个SNP和48个InDel。在编码区发现24个变异位点,包括6个SNP和18个InDel位点。关联分析发现,玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因中1个非同义突变位点与株高显著关联,另外1个非同义突变位点与穗长显著关联。
关键词:玉米;骨干亲本基因;株高;关联分析
中图分类号: S513.03文献标志码:
赤霉素是植物重要的生长调控因子[1],其最主要的功能就是控制茎的伸长生长。大量矮秆基因的研究结果表明,株高与赤霉素生物合成和赤霉素信号转导途径相关。
GA信号传导途径中基因突变时,部分持续对GA响应的突变体表现为徒长,植株纤细并且葉片灰绿,这和施加过量GA的植株表型一样;而无法对GA响应的突变体表现为叶片深绿、植株矮化、育性降低等,这与GA突变体合成受阻的表型相同,并且不可以通过外源施加GA得以恢复[2-3]。在植物体中,DELLA蛋白质是GA响应的最主要抑制因子,而GA传导途径的开启主要是通过解除这种抑制作用得以实现。DELLA蛋白质在N端的DELLA结构域中有2个保守元件:DELLA和VHYNP,这2个元件的DELLA类蛋白能够抑制对赤霉素的响应。本研究中的玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因,其3个突变体[WTBX][STBX]d8-1、d8-2023[WTBZ][STBZ]和[WTBX][STBX]d8-Mp1[WTBZ][STBZ]在DELLA区、VHYNP区且2个区域同时缺失氨基酸导致植株呈明显矮化[4]。这些表明,[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因通过在GA转导途径抑制GA响应,来达到调控株高的目的。
玉米是世界三大粮食作物之一,也是集粮、饲、经“三元一体”的优势作物。2003年我国科学家率先提出了农作物“骨干亲本”的概念。此后,很多研究者利用分子标记技术,对玉米、小麦、大麦等作物的一些骨干亲本进行了分析,认为深入研究并充分利用骨干亲本有助于育种效率的显著提高。在我国的玉米生产中骨干亲本主要有黄早四、MO17、掖478、丹340、自330这5个骨干亲本,在育种中发挥了很重要的作用[5]。此外,作物的株高与抗倒性、产量等性状紧密相关,是重要农艺性状之一。目前,矮秆作物在生产上已经显示了巨大的增产潜力,矮秆基因的发掘及遗传研究利用在育种中越来越受重视。在玉米中,已经有大量的矮秆突变体被发现,其中玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]是一种对外源GA响应并发生改变的矮化突变体。研究表明,玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]突变体是由于[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因的DELLA结构域有碱基的缺失和突变,从而导致了矮秆的突变表型[6]。因此,[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因与株高的关联分析研究十分重要。此前,Thornsberry等首次运用了基于候选基因关联分析的方法研究了玉米的[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因,发现[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因中有9个多态性位点与玉米开花期的变化显著相关[4];Camus-Kulandaivelu 等选用不同的玉米自交系也得出相同结论[7]。Andersen等用另一玉米自交系群体试验证明玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因序列多样性与开花期和株高有关[8]。本研究选用来源广泛的96份玉米自交系(包括5大骨干亲本及其衍生系及糯玉米自交系)作为试验对象,在对目标基因测序的基础上,结合株高性状的测定结果,利用候选基因的关联分析方法,解析自然变异群体中[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因的序列变异对株高等性状的作用及其影响,从而筛选出一些重要的变异位点以及优异位点组合,为我国玉米骨干自交系优良基因的有效利用和玉米优质育种提供理论依据和技术支撑[9]。
1材料与方法
1.1试验材料
本研究选取具有广泛代表性的玉米自交系96份,包括我国温带玉米的5个杂种优势群的代表性种质、热带/亚热带种质、糯玉米自交系和来源于国外的种质材料(表1)。供试材料于2014年夏季种植于青岛基地,田间试验采用完全随机设计,重复2次。每个材料种植2行,每行10株,常规水肥田间管理。授粉20天后,每行选取5株,分别测量株高和穗位高。果穗收获后晾干,考察穗部性状,包括穗长、穗粗、轴粗、穗质量、行粒数、穗行数、穗粒数。
1.2DNA的提取和基因重测序
采用改良的CTAB 法[10]完成DNA提取。用分光光度计检测DNA浓度,并以B73的[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因(GRMZM2G144744)序列为模板,在供试材料中采用NimbleGen[11]平台技术进行目标基因区段序列捕获并重测序。基因的目标序列定点捕获和重测序委托华大基因有限公司完成。NimbleGen定点序列捕获主要是利用杂交和DNA微阵列技术基因分离原理来捕获目标区域,与目前被广泛采用的基因组重测序技术相比,该方法具有高特异性和高覆盖度、捕获区域可按需设计和省时省力等优点。
1.3数据分析
2.3群体结构分析
为了解关联作图群体的遗传结构,基于前期3 072个SNP分析自交系多样性的数据,采用STRUCTURE软件中基于数学模型的方法对96份自交系进行群体结构分析,将每个自交系细分到相应的亚群,通过分析比较发现,当K=3时,获得了稳定的α值,基于模型的亚群,大都与自交系的系谱来源和系统聚类结果一致(图1)。在自交系不是完全血缘纯和的情况下,群体结构分析对关联分析筛选特定准确等位变异位点起到了关键性的矫正作用。
2.4[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因的连锁不平衡
连锁不平衡(LD)是不同基因座位上等位基因的非随机组合现象。关联分析是利用等位基因间LD的统计特性预测染色体某个区段与表型性状的关联程度。r2则是一种与等位频率相关的度量参数,被用来衡量2个位点间的LD水平(图2)。在[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因的序列上分散分布着一些较强的LD结构。基因[WTBX][STBX]Dwarf8[WTBZ][STBZ]的多态性位点221、407和116、117、196、202,246和44、53、55,44和53、55,60和61、62,280和239,2 760 和66,816和813等之间均存在较强的连锁不平衡结构(r2>0.9);如图3,对[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因分析区LD的衰退程度进行检测,以位点距离和连锁不平衡参数r2作散点图,发现玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因的连锁不平衡随距离的增加而快速衰减,在500 bp左右就衰退至0.1水平。
2.5[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因与表型的关联分析
分别对株高、穗位高、穗长、穗粗、轴粗、穗质量、行粒数、穗行数和粒质量共9个玉米产量性状进行测定,方差分析结果表明,这9个农艺性状均在供试玉米自交系间存在极显著差异(表4),这说明各性状在不同自交系中具有较高的遗传多样性。利用变异系数表示每一性状的绝对变异度,发现每一性状均具有较高的变异度,但不同性状的变异系数也存在较大差异。变异系数最高的为粒质量,达到45.22%,变异系数最低的为穗粗,仅为12.59%。
利用TASSEL3.0 软件中的MLM模块对株高性状与[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因序列多态性位点进行关联分析。在编码区内共检测到2个SNP位点与玉米株高存在显著关联(表5),这2个[CM(25]变异位点处于完全连锁不平衡状态,对株高的贡献率为[CM)]
4.98%。这2个SNP中,SNP_2825为非同义突变,能引起蛋白质序列的改变,位于编码区的 SNP_1525变异位点也为非同义突变,并与穗长有关,贡献率为10.94%。此外,在启动子区SNP_286和SNP_301也处于完全连锁不平衡状态,并与穗位高显著关联,贡献率为8.18%。除株高,穗位高和穗长之外,本研究中所鉴定的其他农艺性状不与[WTBX][STBX]Dwarf8基因序列变异存在显著关联。
3讨论
丰富的变异是作物遗传改良的基础。作物种质材料的变异包括表型特征的变异和遗传基础的变异。丰富的表型变异和核苷酸多样性也是通过连锁和关联分析进行遗传作图的重要基础[20]。本研究中的供试群体在表型性状上存在明显的差异,估计这些性状大部分是由遗传基础起到主要作用。对目的基因进行核苷酸多态性分析,并进而通过遗传转化等途径,为在分子水平上有目的的进行作物遗传改良创造条件。SNP和InDel是基因核苷酸变异中最常见的,往往能引起表型的变异。这其中SNP是基因组中发生频率最高、数量最多而且密度最大的变异。本研究中,我们对[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因进行了序列变异分析,结果发现在该基因位点上存在着丰富的变异。与非编区相比,编码区的核苷酸变异频率较低,主要是受到更多选择压力引起的,这种趋势在其他许多基因的核苷酸变异研究中得到证实。Ching等对36个玉米自交系的18个基因进行了研究,发现每41 bp会有1个多态性位点,每47.7 bp处会有1个SNP,85 bp处会有1个InDel[21]。相比较而言,本研究中的SNP和InDel频率都偏低,造成上述基因間变异频率差异的主要原因是人工选择、自然选择以及遗传漂变等。
玉米产量的形成是一个复杂的过程,受多个基因及基因网络的调控,也受到各个性状的影响。株高作为一个重要的农艺性状,对产量的作用有着深远的影响[22-23]。育种家将半矮基因导入作物引发了谷物产量飞跃的“绿色革命”。但绿色革命在提高谷物产量的同时,也带来了许多不利的影响,如肥料滥用使得土壤变得贫瘠,杀虫剂的大面积推广造成了空气、水源和土壤污染,农民种植品种过于单一化导致遗传多样[JP3]性急剧降低。这些弊端严重影响了谷物的可持续发展,也使得运用新的品种改良理念和采取行之有效的举措显得更加重要。
矮秆玉米相对于高秆来说,有着不可比拟的优势,有着更高的干物质转化率,适宜密植,能实现高产,生产上具有巨大潜能。但矮源的遗传多样性低不利于玉米的产量和品质提高,大部分矮秆基因与某些不良性状基因紧密连锁,一因多效,使得这些基因的个体大多畸形,不便于繁殖利用。因此,创造或筛选新的矮源和矮秆基因对玉米育种和生产都具有重要的意义。本研究中在的目的基因[WTBX][STBX]Dwarf8[WTBZ][STBZ]就是一个显性矮化基因,由于其突变体在DELLA区的碱基缺失而使其呈组成型表达抑制GA响应,使得突变体植株表现出植株矮小。本研究中在对其进行序列分析的基础上,进一步对其变异位点与[CM(25][KG*8]株高、穗位高、穗长等9个产量相关性状进行了关联分析,[CM)]
4结论
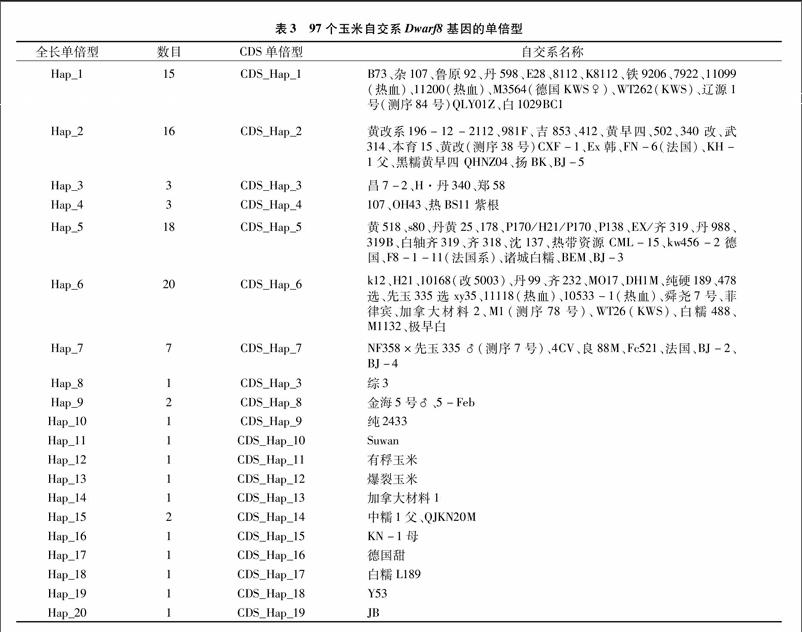
玉米基因的全长序列在96个常用玉米自交系中共发现了48个SNP和18个InDel。该基因编码区含有6个SNP,可将96个自交系划分成20种单倍型,玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因符合中性进化模型假设,没有发生纯化选择,基于候选基因的关联分析发现,该基因在编码区的1个非同义突变与株高显著关联,另外1个非同义突变与穗长显著关联。研究结果表明,玉米[WTBX][STBX]Dwarf8[WTBZ][STBZ]基因的变异位点可用于分子标记辅助选择改良现有种质,对中国玉米株型改良的分子设计育种具有一定的指导意义。
[HS2*1][HT8.5H]参考文献:
[1]Phinney B O. The history of gibberellins[J]. The Biochemistry and Physiology of Gibberellins,1983,1:19-52.
[2]Silverstone A L,Ciampaglio C N,Sun T. The Arabidopsis RGA gene encodes a transcriptional regulator repressing the gibberellin signal transduction pathway[J]. The Plant Cell,1998,10(2):155-169.
[3]Raven J A,Allen J F. Genomics and chloroplast evolution:what did cyanobacteria do for plants?[J]. Genome Biology,2003,4(3):209-213.
[4]Thornsberry J M,Goodman M M,Doebley J,et al. [WTBX][STBX]Dwarf8[WTBZ][STBZ] polymorphisms associate with variation in flowering time[J]. Nature Genetics,2001,28(3):286-289.
[5]黎欲,王天宇. 我国玉米育种种质基础与骨干亲本的形成[J]. 玉米科学,2010,18(5):1-8.
[6]Peng J,Richards D E,Hartley N M,et al. ‘Green revolutiongenes encode mutant gibberellin response modulators[J]. Nature,1999,400(6741):256-261.
[7]Camus-Kulandaivelu L,Veyrieras J B,Madur D,et al. Maize adaptation to temperate climate:relationship between population structure and polymorphism in the [WTBX][STBX]Dwarf8[WTBZ][STBZ] gene[J]. Genetics,2006,172(4):2449-2463.
[8]Andersen J R,Schrag T,Melchinger A E,et al. Validation of [WTBX][STBX]Dwarf8[WTBZ][STBZ] polymorphisms associated with flowering time in elite European inbred lines of maize (Zea mays L.)[J]. Theoretical and Applied Genetics,2005,111(2):206-217.
[9]戴景瑞,鄂立柱. 我国玉米育种科技创新问题的几点思考[J]. 玉米科学,2010,18(1):1-5.[ZK)]
[10]Fulton T M,Chunwongse J,Tanksley S D. Microprep protocol for extraction of DNA from tomato and other herbaceous plants[J]. Plant Molecular Biology Reporter,1995,13:207-209.
[11]Nuwaysir E F,Huang W,Albert T J,et al. Gene expression analysis using oligonucleotide arrays produced by maskless photolithography[J]. Genome Research,2002,12(11):1749-1755.
[12]Larkin M A,Blackshields G,Brown N P,et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics,2007,23(21):2947-2948.
[13]Rozas J. DNA sequence polymorphism analysis using DnaSP[J]. Bioinformatics for DNA Sequence Analysis,2009,537:337-350.
[14]Librado P,Rozas J. DnaSP v5:a software for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics,2009,25(11):1451-1452.
[15]Tajima F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics,1989,123(3):585-595.
[16]Fu Y X,Li W H. Statistical tests of neutrality of mutations[J]. Genetics,1993,133(3):693-709.
[17]Hudson R R,Kaplan N L. Statistical properties of the number of recombination events in the history of a sample of DNA sequences[J]. Genetics,1985,111(1):147-164.
[18]Ganal M W,Durstewitz G,Polley A,et al. A large maize (Zea mays L.) SNP genotyping array:development and germplasm genotyping,and genetic mapping to compare with the B73 reference genome[J]. PloS One,2011,6(12):e28334.
[19]Bradbury P J,Zhang Z,Kroon D E,et al. TASSEL:software for association mapping of complex traits in diverse samples[J]. Bioinformatics,2007,23(19):2633-2635.
[20]Xu S,Yang Z,Zhang E,et al. Nucleotide diversity of maize [WTBX][STBX]ZmBT1[WTBZ][STBZ] gene and association with starch physicochemical properties[J]. PloS One,2014,9(8):e103627.
[21]Ching A D A,Caldwell K S,Jung M,et al. SNP frequency,haplotype structure and linkage disequilibrium in elite maize inbred lines[J]. BMC Genetics,2002,3:1-9.
[22]黄忠阳,陈舜权,胡俏强,等. 种植密度对超甜玉晶甜18主要农艺性状及产量的影响[J]. 江蘇农业科学,2014,42(12):106-107.
[23]张丽妍,霍剑锋,孟繁盛,等. 不同肥料、施肥水平及施用方法对玉米产量、性状及效益的影响[J]. 江苏农业科学,2014,42(11):119-122.

