拉曼光谱研究两面针活性成分诱导肝癌细胞的凋亡
毛晓丽+覃禹+陈相宜+邝晓聪+黄庶识+刘华钢
[摘要]运用拉曼光谱法对两面针活性成分诱导的肝癌细胞凋亡进行分析,肝癌细胞7404分别经10 mg·L-1氯化两面针碱及3 g·L-1两面针提取液处理后,收集经药液处理12,24,36,48 h的各组细胞的拉曼光谱后,通过Hochest33342/PI荧光染色法鉴定细胞并保留荧光染色阳性(发生凋亡活细胞)的光谱,并在OriginPro8.0系统中比较各组平均光谱的差异。收集肝癌细胞的拉曼光谱依次进行背景扣除、平滑、归一化等方法处理。Hochest荧光染色后空白组细胞核染色均匀,而药物处理48 h后,核碎裂,拉曼光谱结果显示两面针提取液处理肝癌细胞12,24,36,48 h后,与核酸及蛋白质相关的峰均有降低,其中785,1 002,1 175,1 660 cm-1峰强度随两面针药物作用时间的延长而降低,表明两面针活性成分能够诱导肝癌细胞凋亡,凋亡的肝癌细胞中核酸和蛋白质的含量均低于活细胞。两面针活性成分作用时间与药效呈一定的相关性。拉曼光谱能够反映中药两面针活性成分作用后的肝癌细胞内物质变化的信息,对实时监测细胞凋亡过程及药物的临床应用具有重要意义。
[关键词]拉曼光谱; 肝癌细胞; 两面针
[Abstract]The apoptosis of mono-hepatocellular induced by the active ingredients of the Zanthoxyli Radix was investigated using laser Raman spectroscopy. Hepatoma cells (BEL-7404) were treated with 10 mg·L-1 nitidine chloride and 3 g·L-1 the extracts of Zanthoxyli Radix, respectively, then were divided into two parts, one for fluorescence staining, the other for determination of Raman spectroscopy. The acquired spectra were then processed by background elimination, smoothing, and normalization. Fluorescence staining results showed that the nucleuses from untreated group were uniformly stained, while those from the group treated for 48 hours were densely stained and broken. The spectra results revealed that the intensity of peaks associated with nucleic acid and protein decreased after the cells were incubated with the extracts of Zanthoxyli Radix for 12, 24, 36 and 48 hours. The intensity of peaks at 785,1 002,1 175,1 660 cm-1 was decreased with the time of the cells were incubated by the extracts of Zanthoxyli Radix. The results indicated that the extracts of Zanthoxyli Radix could induce the apoptosis of hepatoma cells and reduce the amount of nucleic acid and protein in the cells. There is a certain relevance between the drug treatment time and the efficacy. The above results suggest that Raman spectra can provide abundant information about the changes in biological macromolecules within the cells after incubated by the extracts of Zanthoxyli Radix and serve as an effective method for the real time measurement of apoptosis.
[Key words]Raman spectroscopy; hepatoma cell; Zanthoxyli Radix
doi:10.4268/cjcmm20162119
兩面针系芸香科花椒属藤本植物两面针Zanthoxylum nitidum(Roxb.)DC.的干燥根,又名入地金牛、蔓椒、双面针、双背针等。两面针是广西道地药材,富含生物碱、木质素、香豆素和挥发油等,具有活血化瘀,行气止痛,祛风通络,解毒消肿等功效,用于跌扑损伤,胃痛,牙痛,风湿麻痹,毒蛇咬伤等[1]。现代研究发现氯化两面针碱为主的生物碱活性成分发挥抗肿瘤作用,其主要作用机制是抑制拓扑异构酶活性、阻滞细胞周期、逆转肿瘤细胞多药耐药、诱导肿瘤细胞凋亡等[2]。
细胞凋亡是细胞在一定的生理或病理条件下,由基因控制的细胞自主的有序死亡。现代研究发现中药诱导肿瘤细胞凋亡已成为治疗癌症的新途径,紫杉醇通过抑制癌细胞有丝分裂诱导细胞凋亡,对子宫癌、乳腺癌、卵巢癌等具有特殊疗效[3]。细胞凋亡时会发生一些特征性的形态和生化改变,现在常用的检测细胞凋亡的方法有电子显微镜、流式细胞术、核酸电泳等[4]。拉曼光谱技术是通过拉曼光谱特征峰的位置和强度来反映分子的精细结构和振动结构,从分子水平上对细胞进行检测,拉曼光谱已成为研究细胞内分子结构变化的有效工具[5-6]。拉曼光谱具有非破坏性,非侵入性,不需要对样品进行预处理,一般的生物样品,细胞、活体组织、DNA以及RNA都可以直接测量。拉曼光谱主要是测定细胞内核酸、蛋白质、脂质等生物大分子的变化过程,药液对激发拉曼散射的可见光只有很弱的吸收,这使得拉曼光谱技术适合于研究溶液体系如药物培养液中的细胞[7]。近年来拉曼光谱也广泛用于乳腺癌、肝癌等癌症诊断以及治疗的研究中[8-11]。
本文从两面针中提取活性成分,对体外肝癌细胞进行不同时间段的处理,利用单细胞拉曼光谱系统测定不同处理时间段细胞的光谱,并结合化学计量学方法对光谱数据进行处理和分析,以期揭示肿瘤光谱特征变化所反映的生物学内涵,促进中药两面针中的有效成分诱导肝癌细胞凋亡的生理过程的深入理解。
1 材料
1.1 药物 氯化两面针碱对照品(中国食品药品检定研究院,批号1108482-200502,供含量测定用,纯度>99.5%)。两面针样品分别采集于广西南宁市大塘镇和柳州市融水县,经广西中医药研究院中药室赖茂祥研究员鉴定为芸香科两面针Z.nitidum的干燥根。
1.2 试剂 氯仿(国药集团,分析纯);RPMI DMEM培养基,RPMI1640培养基(美国Gibco公司);新生牛血清(杭州四季青生物材料研究所);标准胎牛血清(Solarbio);胰蛋白酶(美国Amersco公司);四甲基偶氮唑盐(MTT)(美国Amersco公司);N-2-羟乙基哌嗪-N′-2-乙磺酸(HEPES)(美国Sanland-chem公司);二甲基亚砜(DMSO)(广州市新港化工有限公司);磷酸盐缓冲液(PBS)(福州迈新生物技术开发有限公司);Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);Hochest33342/PI染色液(南京凯基生物科技发展有限公司)。
1.3 細胞株 BEL-7404人肝癌细胞购于中国科学院上海细胞库。
1.4 仪器 Thermo Forma CO2培养箱(美国 Forma Scientific公司);Axiovert 200型倒置光学显微镜(德国Zeiss公司);Model-450酶联免疫检测仪(美国 Bio-Rad公司);超低温冰箱(日本三洋公司);超净工作台(苏州净化设备厂);平板振荡器(北京海淀电子医疗仪器厂)。
1.5 拉曼系统 单光镊拉曼系统为一束波长为785 nm的半导体激光(美国Thorlabs公司)经过滤波后进入一台TE2000U尼康倒置生物显微镜(日本Nikon公司),在进显微镜之前,增加一对X和Y方向的电控扫描对镜,通过信号发生器给对镜的电机加电,通过调节电压分别控制X和Y方向扫描的幅度,通过调节信号的频率控制扫描的频率。在本实验中,X方向设定的频率为8 Hz,即1 s扫描8次,Y方向设定的频率为0.3 Hz,X和Y方向电压都设定为2.6 V。光谱仪耦合到电荷耦合器件CCD上,CCD用液氮冷却到-120 ℃,用悬浮在水中的聚苯乙烯小球做系统校正。
2 方法
2.1 两面针样品溶液的制备 精密称取两面针药材3.00 g,加氯仿180 mL,回流提取3次,每次2 h,过滤,回收氯仿,残渣用无水乙醇定容到5 mL量瓶中。提取物用0.22 μm微孔滤膜过滤除菌,取滤液300 μL,加入RPMI1640培养液1 200 μL,即得。此方法处理后的样品溶液生药浓度为120 g·L-1,再将其质量浓度对半稀释成60 g·L-1。置于4 ℃保存待用。
2.2 氯化两面针碱溶液的配制 精密称取氯化两面针碱1.00 mg,无水乙醇定容至1 mL。于超声仪中超声1 h后,在超净台上用0.22 μm微孔滤膜过滤除菌,取滤液300 μL,加入RPMI1640培养液1 200 μL,即得氯化两面针碱的质量浓度为0.20 g·L-1。
2.3 肝癌细胞的培养 人肝癌细胞7404培养于DMEM培养基中,内含10%胎牛血清、L-谷氨酰胺2 nmol·L-1、青霉素100 IU·mL-1和链霉素100 IU·mL-1,37 ℃,5% CO2常规培养。每天2次置于倒置显微镜观察细胞生长情况,0.25%胰蛋白酶消化传代,取对数生长期细胞用于实验。
2.4 肝癌细胞拉曼光谱的测定 取对数生长期的人肝癌细胞7404悬液接种于96孔培养板,细胞浓度为1×105个/mL,每孔190 μL;培养24 h后,分别加入两面针提取溶液,每孔10 μL(两面针样品溶液和氯化两面针碱溶液作用到肝癌细胞上的最终浓度分别是3 g·L-1及10 mg·L-1,此浓度是通过前期MTT法及流式细胞仪研究确定的最佳药物作用浓度),并根据药物对细胞的作用时间12,24,36,48 h进行分组。各组细胞经过酶消化、离心、PBS漂洗后,用PBS稀释至适宜浓度后用于拉曼光谱的测定。
从各组细胞中取一部分用于拉曼光谱的检测。激光光镊拉曼光谱系统(LTRS),激光光镊拉曼光谱系统实验装置及系统描述详见1.5项。一般而言,拉曼光谱系统激光激发光斑直径在2 μm左右,面积约3.14 μm2,肝癌细胞的直径一般在15~20 μm,面积大于200 μm2,入射激光仅照射细胞的局部区域不一定能获取整个细胞的光谱信息,本实验采用扫描方式收集细胞光谱,即设定一个区域和时间让激光连续在设定好的区域进行运动,以累积的方式记录光谱信号,由此获取的细胞光谱信息较全面。为了获得单个细胞的整体光谱,实验采用激光束动态扫描模式,激光束在一个周期内以分别向X轴横向和Y轴纵向运动,实验中扫描频率被设定为1 Hz。以20 mW激发功率和30 s曝光时间。拉曼系统实验条件是已经通过前期研究[12]设定,拉曼光谱的响应强度足以反映细胞的拉曼图谱。
拉曼检测流程:加样,随机选取视野,视野中每个细胞均检测其拉曼光谱,然后用Hochest33342/PI染色法区分正常细胞、凋亡细胞和死亡细胞,最后选取凋亡细胞的拉曼光谱进行数据分析。重复以上操作直到获得30个凋亡细胞的拉曼光谱数据。扫描的范围是可以包括整个细胞面积的最小四边形,来自于溶液、石英片、光学部件的背景光谱也用同样扫描的面积取得。每扫描一个细胞光谱的同时,要扫描一次细胞周围样品池的背景光谱,进行背景光谱的扣除,最后得到细胞的光谱。由于每个细胞只被功率为20 mW 的激光照射了30 s,因此对细胞生物活性的影响很小[13]。
细胞活性的鉴定:各组细胞完成拉曼检测后将5 mg·L-1 Hochest33342荧光染料及5 mg·L-1 PI荧光染料加入待检测样品中。避光反應15 min,置于荧光显微镜下,在激发波长为352 nm的紫外光及激发波长为488 nm下观察细胞的情况。
2.5 数据处理 光谱数据运用Origin 8.0进行背景扣除、平滑、拉曼光谱基线校正软件进行基线校正,用Unscrambler 9.7对光谱数据进行归一化处理,归一化的方法是标准正态变量变换(standardized normal variate, SNV)。
3 结果
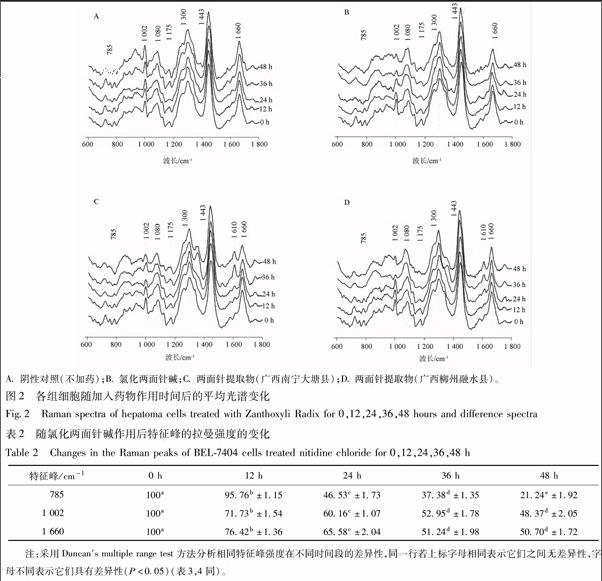
3.1 7404肝癌细胞的Hochest33342/PI染色结果 Hochest33342/PI在荧光显微镜下观察。活细胞的细胞结构完整;染色后其细胞核在激发波长为352 nm下呈弥漫均匀的淡蓝色荧光;活细胞对PI 染料拒染,所以在激发波长488 nm下观察不到红色荧光,见图1。
凋亡细胞的细胞膜完整;染色后其细胞核在激发波长为352 nm下呈亮蓝色荧光,并观察到核碎裂;凋亡细胞的细胞膜完整对PI染料拒染,所以在激发波长488 nm下观察不到红色荧光,见图1。
死亡细胞的胞膜完整性被破坏;染色后其细胞核在激发波长为352 nm下观察到蓝色荧光;在激发波长488 nm下观察到红色荧光,见图1 。
在激发波长为352 nm下是不能区分凋亡细胞和死亡细胞的。只有在激发波长488 nm下,凋亡细胞的细胞膜完整对PI染料拒染,观察不到红色荧光;死亡细胞细胞膜被破坏,PI染料进入细胞在激发波观察到红色荧光,见图1。可以区分对应凋亡细胞和死亡细胞。
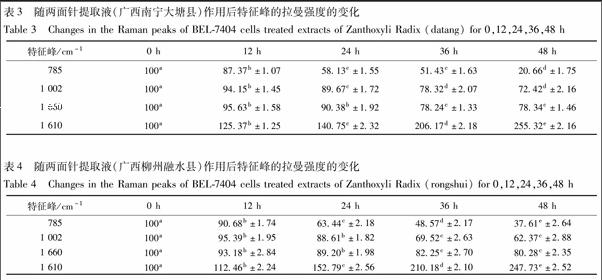
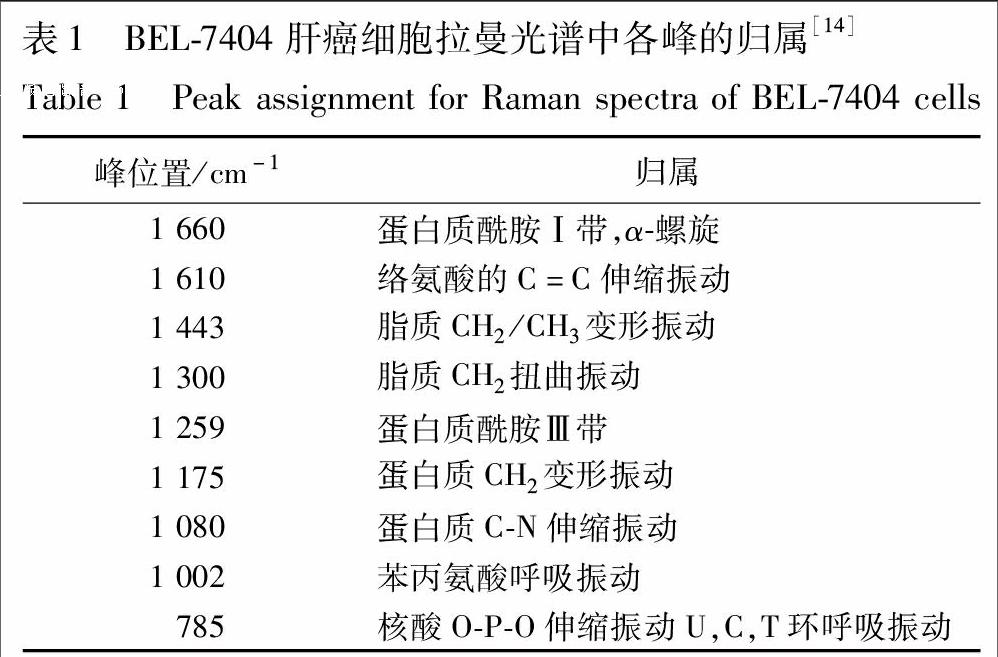
3.2 各组细胞拉曼光谱 经两面针药液处理0,12,24,36,48 h的肝癌细胞的平均拉曼光谱见图2,各峰归属见表1。从图2可以观察到A组不加药物处理的肝癌细胞平均拉曼光谱随时间的变化没有发生明显的变化趋势,而加入药物处理后的B,C,D组的肝癌细胞的拉曼光谱随时间的变化发生了一些规律性的变化。与核酸相关的谱峰,785 cm-1代表核酸U,C,T碱基环呼吸振动和磷酸二酯键O-P-O伸缩振动,此峰值随着药物作用时间的推移逐渐降低。与蛋白质相关的谱峰,1 002 cm-1代表苯丙氨酸面内振动,1 080 cm-1代表蛋白质C-N伸缩振动,1 175 cm-1代表蛋白质分子的酪氨酸、丝氨酸、苏氨酸等残基中的C-O基团氢键结合力,1 259 cm-1代表蛋白质酰胺Ⅲ带,1 610 cm-1代表络氨酸的C=C伸缩振动,1 660 cm-1代表蛋白质酰胺Ⅰ带。1 002,1 175,1 259,1 660 cm-1峰强度随两面针药物作用时间的延长都有不同程度的降低。1 610 cm-1峰强度随两面针药物作用时间的延长而升高。与脂质相关的谱峰,1 443 cm-1代表脂质CH2/CH3变形振动,1 300 cm-1代表脂质CH2扭曲振动,这2个峰没有发现明显的变化趋势。
为了定量描述肝癌细胞中生物大分子的含量随着两面针药液处理时间的变化规律,从拉曼光谱图中提取785,1 002,1 660,1 610 cm-1这4个表征细胞内物质变化的特征峰相对峰强度百分比,结果见表2~4。785,1 002,1 660 cm-1相对峰强度随药物作用时间的延长而显著,由此说明肝癌细胞在凋亡过程中细胞内核酸、蛋白质类等生物大分子显著降低。
4 讨论
785 cm-1峰值随药物处理时间延长显著的降低,是反映细胞凋亡程度的敏感指标。785 cm-1峰强度代表细胞内磷酸二酯键以及C,T,U碱基含量,由此可以推论两面针药物作用后,肝癌细胞的DNA的磷酸根骨架有一定的断裂,细胞内含氮碱基含量逐渐下降,从而导致癌细胞的分裂繁殖失去有效的控制。这和目前对细胞凋亡的认识是一致的[12]。细胞凋亡时,内源性的核酸内切酶被激活,在核小体的连接处将DNA切断为200 bp整数倍的小片段,细胞在凋亡晚期DNA降解加剧,因此核酸碱基的含量也会下降。DNA是许多抗癌药物作用的靶标[15-16],应用共振拉曼光谱研究抗癌药物与DNA的相互作用,能够得出相互作用的位点和连接方式等重要信息。据现有的研究及相关报道[17],两面针提取液作用于肝癌细胞后其可能的机制是两面针活性成分能够嵌入DNA,影响拓扑异构酶介导的DNA链的切割/连接过程,造成细胞内大量DNA双链断裂,进而导致肿瘤细胞周期阻滞于G2/M期,并诱导肿瘤细胞凋亡。
1 002,1 175,1 660 cm-1峰强度随两面针提取物作用时间的延长而降低,而1 610 cm-1峰随着提取物作用时间的延长而升高,表明细胞内蛋白质分子侧链氨基酸残基发生改变,酪氨酸增多,苯丙氨酸减少,同时蛋白质分子中酪氨酸、丝氨酸、苏氨酸等残基中的C-O基团结合的氢键受到破坏,蛋白质酰胺Ⅰ及蛋白质酰胺Ⅲ的峰高降低,蛋白质的空间结构发生变化。1 610 cm-1峰强度并未随氯化两面针碱作用时间的延长而升高,说明氯化两面针碱是单一生物碱药效成分,而两面针提取物含多种生物碱混合药效成分,两者总体上诱导肝癌细胞凋亡的机制是一致的,但也存在微小的差别,这种差异的原因有待进一步的研究。
两面针抑制肿瘤细胞的增殖,一方面与细胞增殖相关的蛋白质表达降低有关,使蛋白质的合成代谢减弱;另一方面,凋亡的过程确实会伴随着一些蛋白的水解,因此蛋白质含量会下降。细胞发生凋亡时半胱氨酸蛋白酶家族的成员被水解激活,活化的酶可以催化其他底物蛋白的水解,造成细胞内蛋白质含量的降低。
5 结论
肝癌细胞经两面针提取物处理后,利用显微拉曼光谱技术测定不同处理时间后肝癌细胞拉曼光谱的变化,结果表明肝癌细胞中核酸和蛋白质含量随药物处理时间的延长而显著降低,说明凋亡的肝癌细胞中核酸和蛋白质的含量均低于活细胞,并与药物处理时间呈一定的相关性。拉曼光谱能够反映经中药两面针提取物作用后肝癌细胞内核酸、蛋白质等生物大分子物质变化的信息,对实时监测细胞凋亡过程及药物的筛选乃至临床应用具有重要意義。
[参考文献]
[1]中国药典.一部[S]. 2015:169.
[2]刘华钢, 李丹妮, 刘丽敏. 氯化两面针碱抗肿瘤作用机制研究进展[J]. 广西科学院学报,2009, 25(3): 187.
[3]Jiang S G, Zhang Y, Zu Y G, et al. Antitumor activities of extracts and compounds from water decoctions ofTaxus cuspidata[J]. Am J Chin Med, 2010, 38(6): 1107.
[4]高超, 华子春. 细胞凋亡检测方法新进展[J]. 中国细胞生物学学报, 2011, 33(5): 564.
[5]蔡何青, 赵燕平, 朱伟玲. 拉曼光谱研究丹参注射液对人红细胞膜作用及机制讨论[J].中国中药杂志, 2012, 37(10):1467.
[6]贺艰,张雁.拉曼光谱快速检测酚磺乙胺注射液[J].中国现代应用药学, 2015, 32(1): 49.
[7]Smith E, Dent G. Modern Raman spectroscopy: a practical approach[M]. Hoboken: John Wiley &. Sons, Ltd, 2005.
[8]刘婉华, 刘健, 王杰芳, 等. 拉曼光谱研究不同剂量的光动力作用对肝癌细胞HepG2的杀伤效应[J]. 应用激光,2010,30(3):240.
[9]Keller M D, Varqis E, De Matos Grania N, et al. Development of a spatially offset Raman spectroscopy probe for breast tumor surgical margin evaluation[J]. J Biomed Opt, 2011, doi:10.1117/1.3600708.
[10]Guo J, Cai W, Bu B, et al. Raman spectroscopic investigation on the interaction of malignant hepatocytes with doxorubicin[J]. Biophys Chem, 2009, 140(1/3): 57.
[11]谢裕安, 冷朝辉, 孟令晶, 等. 乳腺上皮细胞与癌细胞的激光镊子拉曼光谱研究[J]. 中华肿瘤防治杂志, 2010, 17(20):1605.
[12]陶站华, 姚辉璐, 王桂文, 等. 利用拉曼光谱分析顺铂诱导的胃癌细胞凋亡[J]. 光谱学与光谱分析,2009, 29(9): 2442.
[13]Notingher I, Selvakumaran J, Hench L L. New detection system for toxic agents based on continuous spectroscopic monitoring of living cells[J]. Biosens Bioelectron, 2004, 20(4):780.
[14]杨文沛, 姚辉璐, 朱淼, 等. 单个肝癌细胞的拉曼光谱分析研究[J]. 激光与红外, 2007, 37(9):824.
[15]金弢, 胡伟琦, 方迪龙, 等. 苦参注射液与卡铂联合原发性肝癌细胞凋亡的研究分析[J]. 中华中医药学刊, 2014, 32(6): 1472.
[16]张金彦, 郭建宇, 蔡炜颖, 等. 拉曼光谱研究复方鹿仙草颗粒对SMMC-7721肝癌细胞的作用[J]. 光谱学与光谱分析, 2008, 28(11): 2574.
[17]刘丽敏, 刘华钢. 氯化两面针碱的抗肝癌活性及对DNA拓扑异构酶的影响[J]. 中国药理学通报, 2010, 26(4): 497.
[责任编辑 陈玲]