猪O型口蹄疫抗体水平检测与分析
猪O型口蹄疫抗体水平检测与分析
刘 鸽,于会举,张培生,张 倩,宋 敏,杨慧敏,吴圆圆,屈勇刚*
(石河子大学动物科技学院,新疆 石河子 832003)
为了解北疆地区口蹄疫(FMD)的免疫抗体水平,本试验选择克拉玛依、沙湾、石河子、玛纳斯、奇台5个不同区域的19个规模化猪场进行猪O型口蹄疫ELISA抗体水平检测并做出初步分析。980份试验血清中检出851份阳性血清,阳性率为86.84%(851/980);5个不同区域的19个猪场的猪O型口蹄疫抗体阳性率,克拉玛依85.13%、沙湾85.43%、石河子89.39%、玛纳斯85.63%、奇台79.19%;19个规模化猪场的猪O型口蹄疫抗体水平在70%(国家规定水平)以上者达100%,且19个猪场中猪O型口蹄疫抗体阳性率在90.00%及以上者有6个,占31.58%(6/19);抗体阳性率在80.00%及以上者有16个,占84.21%(16/19);只有3个猪场的猪O型口蹄疫抗体阳性率低于80.00%。此试验结果说明北疆地区猪O型口蹄疫抗体水平相对较高;猪群不同构成成分猪O型口蹄疫抗体水平存在一定差异,3个阶段的仔猪的猪O型口蹄疫抗体阳性率随日龄增大而下降。希望本试验结果在一定程度上可为北疆地区口蹄疫防疫工作提供一定的参考。
口蹄疫;ELISA;抗体水平;阳性率
口蹄疫(food and mouth disease,FMD)是由口蹄疫病毒引起的一种急性、热性和高度接触性的偶蹄动物传染病[1-5],被国际兽医局(OIE)列为必须上报的动物疫病,被我国列为一类动物传染病[6-8]。FMD属于小RNA病毒科口蹄疫病毒属,包括7个血清型(A、O、C、SATI、 SATⅡ、SATⅢ和亚洲I型,其中O型口蹄疫是世界上流行最广的一种血清型)和80多个血清亚型,并且各血清型之间无交叉免疫现象[9]。1514年,FMD被首次报道,现已在全球蔓延,并严重威胁畜牧业的健康发展,给畜牧业造成巨大损失[10-13]。在应对FMD方面,我国采取疫苗免疫接种和扑杀的综合防治措施,效果明显[14-16]。近些年,我国强制免疫中广泛使用猪口蹄疫O型灭活疫苗和猪口蹄疫O型合成肽疫苗。
2015年下半年至今,猪肉价格较高,激发了养猪单位中畜牧工作者的工作积极性,极大地促进了养猪事业的发展。为了解2014年1月—2016年9月北疆地区口蹄疫(FMD)的免疫抗体水平,本试验选择克拉玛依、沙湾、石河子、玛纳斯、奇台5个不同区域的19个规模化猪场进行猪O型口蹄疫ELISA抗体水平检测并做出初步分析,在一定程度上可为北疆地区口蹄疫防疫工作提供一定的参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
2014年1月至2016年9月采自新疆北疆地区的克拉玛依、沙湾、石河子、玛纳斯、奇台5个不同区域的19个规模化猪场不同类型猪群(0~10 d、11~ 20 d、21~30 d仔猪,后备母猪,经产母猪,种公猪),共采集血样980份。
1.1.2 材料和仪器
猪O型口蹄疫病毒 ELISA 抗体检测试剂盒(武汉科前生物)、自动酶标仪(美国 Bio Tek 仪器有限公司)、一次性5 mL兽用采血器、微量移液器(Eppendorf公司)、若干个移液枪头(已高压灭菌)、恒温培养箱(光明医疗仪器厂)、平板震荡仪等。
1.2 试验方法
1.2.1 采集样品
在采样过程中要保证规范性操作,如此才可保证后续工作的顺利开展。对已选定的猪群一次性从前腔静脉(左右各有一条,可根据操作者的优势手的习惯决定从哪侧采血)或耳静脉采集血液3~5 mL/头,室温静置 30 min左右,待血清析出后,收于采样箱中(里面放有冰袋)带回实验室,每份吸取 1 mL血清于灭菌的1.5 mL EP管中,逐管标记,4 000 r/min ,离心10 min,可立即进行ELISA检测,亦可放-20 ℃保存备用,在时间允许的条件下进行检测,但不能放置过长时间。
1.2.2 间接 ELISA 检测方法
按照试剂盒使用说明书的步骤测样品 OD630nm值。首先,将浓缩的洗涤液恢复到室温(25 ℃),然后按照 1∶20稀释浓缩的洗涤液,最好是当天用当天配(2~8 ℃,可存放一周时间)。试验中,在猪O型口蹄疫抗原包被微孔板加入经 1∶4倍稀释的对照血清和1∶32待检血清,在37 ℃恒温箱中温浴30 min,待抗原抗体结合后,洗涤后加羊抗猪酶标二抗,再次在37 ℃恒温箱中温浴30 min,洗涤后加底物A、B,混匀后在室温下避光显色 10 min,加终止液终止反应,在10 min内,用酶标仪630 nm 波长测定各反应孔中的OD630nm值,据OD630nm值对抗体水平进行判定。
1.2.3 结果判定
在酶标仪上测各孔OD630nm值。试验成立的条件是阳性对照孔平均OD630nm值 ≥ 0.8,阴性对照孔平均OD630nm值必须<0.3。
样品OD630nm值 ≥ 0.4,判为阳性;样品OD630nm值<0.4,判为阴性。
根据试剂盒说明书,按表1进行OD630nm值与间接血凝试验(IHA)的转换。
1.2.4 统计分析
用SPSS 软件、Excel 软件对试验数据进行统计分析,OD630nm值结果用平均值±标准差表示。
2 试验结果
2.1 不同地区不同猪场的猪瘟抗体阳性率及抗体水平
猪场A~E在克拉玛依区域,F~I在沙湾区域,J~M在石河子区域,N~Q在玛纳斯区域,R~S在克拉玛依区域。980份试验血清中检出851份阳性血清,阳性率为86.84%(851/980),A~S猪场的猪O型口蹄疫抗体阳性率依次为90.00%、85.71%、92.25%、75.00%、82.67%、83.33%、76.79%、93.02%、88.57%、91.11%、87.50%、94.74%、84.21%、86.96%、90.48%、82.93%、88.14%、80.00%、78.38%。其中,抗体阳性率在90.00%及以上者有6个,抗体阳性率在80.00%及以上者有16个,只有3个猪场的猪O型口蹄疫抗体阳性率低于80.00%,分别为75.00%、76.79%、78.38%,均高于70%(国家规定水平)。结果见表2。
2.2 北疆5个不同区域猪O型口蹄疫抗体分析结果
5个不同区域的19个猪场的猪O型口蹄疫抗体阳性率:克拉玛依85.13%、沙湾85.43%、石河子89.39%、玛纳斯85.63%、奇台79.19%;不难发现,石河子的抗体阳性率最高,为89.39%;奇台的抗体阳性率最低,为79.19%;克拉玛依、沙湾、玛纳斯的抗体阳性率相当。19个试验猪场的猪O型口蹄疫抗体检测平均OD630nm值:克拉玛依1.451,沙湾1.542石河子1.395,玛纳斯1.328,奇台1.096。对19个猪场的采样血清进行试验发现,间接血凝试验(IHA)均大于等于1∶1024。结果见表3。
2.3 19个规模化猪场猪群不同构成成分的猪O型抗体水平
分析19个试验猪场的猪O型抗体水平,0~10 d仔猪、11~20 d仔猪、21~30 d仔猪、后备母猪、经产母猪、种公猪的猪瘟抗体阳性率分别为 95.79%、91.58%、89.47%、75%、86.34%、98.82%。结果见表4。

表1 表1 猪O型口蹄疫抗体 ELISA 检测OD630nm值与间接血凝试验效价的转换
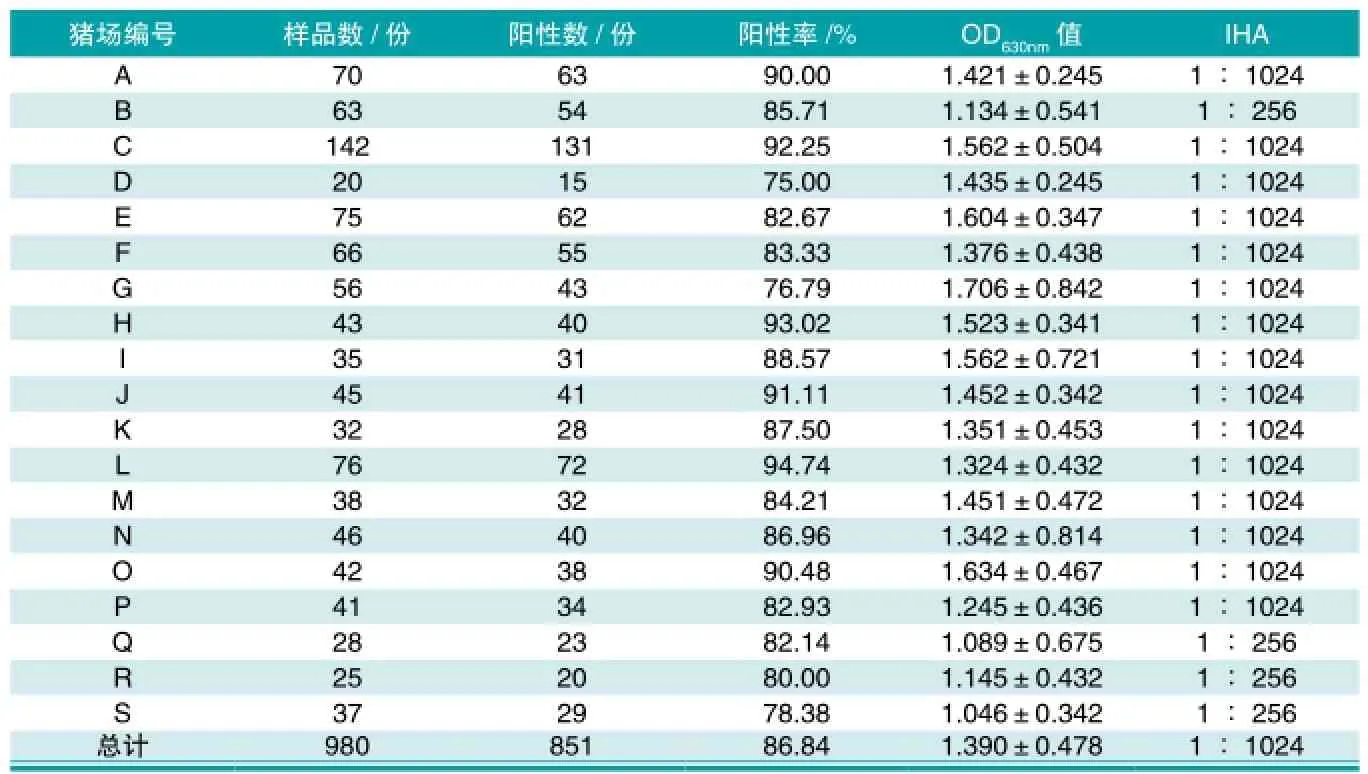
表2 北疆地区5个不同区域的19个猪场猪O型口蹄疫抗体检测结果

表3 北疆5个不同区域猪O型口蹄疫抗体分析结果

表4 19个规模化猪场不同构成成分猪群猪O型口蹄疫抗体水平
3 讨论
3.1 北疆地区猪O型口蹄疫抗体水平相对较高
分析试验结果发现,980份试验血清中检出851份阳性血清,阳性率为86.84%(851/980);北疆地区的克拉玛依、沙湾、石河子、玛纳斯、奇台5个不同区域的19个规模化猪场的猪O型口蹄疫抗体水平在70%(国家规定水平)以上者达100%,且19个猪场中猪O型口蹄疫抗体阳性率在90.00%及以上者有6个,占31.58%(6/19);抗体阳性率在80.00%及以上者有16个,占84.21%(16/19);只有3个猪场的猪O型口蹄疫抗体阳性率低于80.00%。此试验结果说明北疆地区猪O型口蹄疫抗体水平相对较高,对于那些猪O型口蹄疫抗体水平较低的猪场来说,应引起猪场工作人员的高度重视,从疫苗质量、免疫操作、猪群状况等几个方面入手,找到真正的原因并尽快解决,保障猪群健康,以求养猪事业更好更快发展,为国民提供健康放心猪肉。
3.2 猪群不同构成成分猪O型口蹄疫抗体水平存在一定差异
分析0~10 d仔猪、11~20 d仔猪、21~30 d仔猪、后备母猪、经产母猪和种公猪的猪O型口蹄疫抗体水平发现,种公猪的抗体阳性率最高,为98.82%,免疫水平较高;后备母猪的抗体阳性率最低,为75%,有待提高;0~10d仔猪、11~20 d仔猪、21~30 d仔猪的抗体阳性率依次为95.79%、91.58%、89.47%,都是较高的免疫水平,3个阶段仔猪的猪O型口蹄疫抗体阳性率随日龄增大而下降,其中仔猪出生10 d后抗体水平有下降增快的趋势,这可能与母源抗体有一定的关系,提示在仔猪出生后应在适宜的时间及时做好免疫接种工作,并保证饲养环境良好,采取适当的综合措施以促进仔猪的健康生长,为仔猪群的后续发展打下坚实基础。
3.3 加强饲养管理,有效预防疾病
加强饲养管理,是一项非常重要的措施,只有好的管理,才能有效保障猪群健康。鉴于猪口蹄疫的巨大危害,采取及时有效的免疫接种是行之有效的措施,在适当的时间应进行猪O型口蹄疫的免疫接种。对种公猪和繁殖母猪进行猪O型口蹄疫的全免,还要根据各自猪场的实际情况对免疫程序进行调整。在猪场的日常工作中,应将猪群免疫接种工作放到非常重要的位置,并采取严格的制度规范。
[1] 曲哲会,王君伟.口蹄疫病毒非结构蛋白3ABC基因的原核表达及其产物的活性检测[J].中国兽医科学,2006,36(9):696-700.
[2] KITCHING R P. Foot and mouth disease:current world situation [J]. Vaccine,1999,17:1772-1774.
[3] 杨苏珍,李清州,张改平,等.口蹄疫诊断技术研究进展[J].河南农业科学,2009(10):36-38.
[4] 倪卫忠,孙泉云.动物对口蹄疫病毒的免疫应答及口蹄疫疫苗的质量评估[J].现代农业科技,2008(16):273-274.
[5] 杨苏珍,张改平,鲍登克,等.O型口蹄疫病毒 VP1 蛋白的原核表达及功能鉴定[J].华北农学报,2009,24(6):11-14.
[6] 陈妍,田宏,吴锦燕,等.口蹄疫病毒各血清型的世界分布规律[J].中国兽医科学,2011,41:715-717.
[7] KING A M G, UNDERWOOD B O,M C C A H O N D,e t a 1. Biochemicalidenti cation of viruses causing the 1981 outbreak of foot and mouthinthe UK [J]. Nature,1981,293:479-480.
[8] 张永光,刘湘涛,朱长光,等.2006年口蹄疫发生趋势预测分析及其防控对策[J].中国兽医科学,2007,37:619-622.
[9] 曹轶梅,卢曾军,刘在新,等.口蹄疫自然感染动物与免疫动物鉴别诊断研究进展[J].动物医学进展,2003,24(6):22-24.
[10] 刘颖,冉多良,马扬.正向间接血凝试验监测家畜O型口蹄疫抗体[J].现代农业科技,2007(19):181-182.
[11] 韩惠瑛,师汇,左光明.口蹄疫流行原因分析与我国防控措施[J].山西农业科学,2007,35(3):76-78.
[12] PAEK S H,LEE S H,CHO J H,et al.Development of rapid one-step immunoch romatographicassay [J]. Methods,2000,22(1):53-60.
[13] 刘新生,王永录.口蹄疫病毒株 AF/72结构蛋白VP1克隆及其T细胞表位预测[J].华北农学报,2010,25(5):28-32.
[14] 莫丽娜,肖开鹏,张运,等.口蹄疫的防控[J].现代农业科技,2009(16):315-316.
[15] 丁伯良,马吉飞,李志荣.天津市养殖小区动物防疫问题的调查报告[J].天津农业科学,2007,13(3):1-4.
[16] 袁丽,郭凤英.春季猪口蹄疫病的发生与防治[J].现代农业科技,2011(5):347-348.
2016-10-12)
新疆石河子市农业科技攻关项目(编号:2013NY04)
作者 :刘鸽(1986-),男,山东省淄博人,硕士研究生,主要从事动物传染病诊断与防治工作
*通讯作者 :屈勇刚(1971-),男,陕西省渭南人,副教授,主要从事动物传染病诊断与防治工作
——军旅写生作品展

