急性肝损伤大鼠肝组织HSP60的变化及意义
急性肝损伤大鼠肝组织HSP60的变化及意义
曹 东,朱美意,吴江文,周 涛,欧阳军
目的 观察大鼠急性肝损伤过程中热休克蛋白60(heat shock protein 60,HSP60)的变化及其与肝损伤的相关性。方法 126只清洁级SD大鼠,随机分为空白组(n=42)、非肝损伤组(n=42)和肝损伤组(n=42)。空白组不作任何处理;非肝损伤组大鼠进行左腿大腿骨折处理,肝损伤组用改良型BIM-Ⅳ(biological impact machine-Ⅳ)生物撞击机撞击诱导急性肝损伤。各组处理后于6 h、12 h、1 d、2 d、3 d、5 d、7 d取血液检测丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)水平;之后杀鼠取肝,苏木精—伊红染色法(hematoxylin-eosin,HE)染色观察肝组织病理变化;免疫组化染色检测HSP60蛋白表达。结果 (1)空白组与非肝损伤组在上述各时间段的ALT、AST表达水平差异无统计学意义(P>0.05);与空白组及非肝损伤组相比,肝损伤组于6 h、12 h、1 d、2 d、3 d、5 d、7 d血清ALT、AST含量显著增高(P<0.05),且在6 h显著升高[(104.17±4.07)U/L,(271.00±15.84)U/L],12 h达到顶峰[(424.50±10.84)U/L,(787.70±32.68)U/L],之后不断下降,在3 d时恢复正常;(2)HE染色示,肝损伤组肝小叶结构排列紊乱,气球样变明显,在12 h最为明显;(3)免疫组化HSP60染色,肝损伤组织在6 h开始显著高于空白组和非肝损伤组,12 h达到顶峰,1~3 d持续高于空白组和非肝损伤组,5 d时恢复正常水平;(4)HSP60蛋白表达与血清中ALT(r=0.9064,P<0.05)、AST(r=0.9294, P<0.05)表达呈正相关。结论 大鼠急性肝损伤过程中HSP60的表达量有明显的动态变化规律, 与大鼠肝脏损伤程度变化一致。
大鼠;肝损伤; HSP60;丙氨酸转氨酶;天冬氨酸转氨酶
热休克蛋白( heat shock proteins, HSPs) 是生物体在受到缺氧、感染、寒冷、中毒、机械损伤等刺激时发生应激反应而合成的高度保守的蛋白质,广泛存在于微生物和动、植物体内[1]。1962年Ritossa将果蝇幼虫的饲养温度从25℃提高到30℃后30 min,观察到其唾液腺染色体上出现了特殊的“膨突”[2]。直到1974 年,Tissieres研究证实这种现象是因为温度升高增强了这一区域的基因转录,相应生成了一系列蛋白质,被命名为HSPs[3]。HSPs按照蛋白分子量不同分为五类,分别是HSP100、HSP90、HSP70、HSP60和小分子热休克蛋白[4]。早期研究证明,HSPs具有保护细胞不受刺激伤害,并促进细胞在各种刺激引起的损伤中自我修复的功能[5]。其中HSP60是线粒体蛋白,不仅在细胞周期进程和细胞程序性死亡中起着重要的作用,而且在翻译后的蛋白质修饰过程中可作为分子伴侣,帮助重新折叠错误构象的多肽链和蛋白质,还可以帮助清除已经发生不可逆损伤的蛋白,具有变性蛋白优先结合能力,从而保护细胞不受应激伤害[6]。肝脏是人体最大的腺体,参与体内消化、代谢、排泄、排毒及免疫等多种功能。现代工业的发展、生活方式的改变及各种暴力所致的肝损伤乃至肝病、肝衰竭严重影响患者预后。肝脏损伤或部分切除后,其预后主要取决于肝脏损伤后的修复再生能力。而肝脏再生能力的基础是其具有的结构与功能的可塑性,然而,肝细胞再生修复可塑性的分子机制至今仍未完全阐明。本实验主要研究HSP60蛋白在生物撞击诱导的大鼠急性肝损伤中的动态变化规律,进一步探讨HSP60蛋白在急性肝损伤中的作用。
1 材料与方法
1.1 材料 取8周龄、清洁级雌性SD大鼠126只,体重(180±20)g,由新疆医科大学动物饲养中心提供,实验动物许可证号[XJZZQ(XK)200301]。
1.2 试剂和仪器 2%戊巴比妥钠(45 mg/kg);肝素(20 U/ml);免疫组织化学链霉素卵白素(streptavidinperosidase,SP)试剂盒(北京博奥森生物技术有限公司);HSP60抗体(一抗为单克隆抗体,型号UB59457,购自于美国Abcam公司,相应二抗购于北京中杉金桥公司);丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)试剂盒(北京中杉金桥公司);BIM-Ⅳ型生物撞击机改良型:由钢球、钢管、二次撞击头、动物固定台、支架等组成;多功能生理监护仪(上海玉研科学仪器有限公司);Sartorius电子天平(深圳朗普电子科技有限公司);鼠板;CHK Olympus 显微镜 (Olympus 公司,日本)。
1.3 分组和模型制备 将大鼠适应性喂养1周,实验前8 h禁食,不禁水,并经普通观察无异常后,将 126 只大鼠采用区组随机化的方法分为3组:空白组、非肝损伤组、肝损伤组,每组 42 只;各组又随机化分亚组6 h、12 h、1 d、2 d、3 d、5 d、7 d,每组6只;大鼠先用2%戊巴比妥钠腹腔内注射麻醉后,取仰卧位固定于鼠板,腹部及右腹股沟部备皮。分离右股动脉并肝素化。右股动脉插管,通过压力传感器连接于多功能生理监护仪,监测心率及血压并用于取血。插管成功后,空白组不给予任何干预措施;非肝损伤组机械外力致伤大鼠左大腿造成骨折;肝损伤组将其置于BIM-Ⅳ改良型生物撞击机打击头下,采用质量363 g的钢球自撞击机导管1 m高处以自由下落的方式对打击头进行撞击,打击头直径1.2 cm。打击头获得动能和动量,对动物剑突与右肋弓夹角处行二次打击致肝脏钝性撞击破裂伤。
撞击过程的动力学参数:撞击动能E=mgh,g=9.8 m/s2;撞击动量P=mv;撞击速度v= 2gh≈4.427 m/s;自由落体运动时间T≈0.452 s;打击面积S=πr2≈3.14×0.62=1.1304 cm2;E=0.363×9.8×1≈3.557 J,P=0.363×4.427≈1.607 kg/(m·s)。
各组大鼠于处理后6 h、12 h、1 d、2 d、3 d、5 d、7 d股动脉取血2 ml装于促凝管中,血液室温静置30 min后3000 r/min离心10 min,取血清(即造模后血清)分装4℃保存,待统一进行血清指标检。取血后处死大鼠,分离出肝脏标本,置于10%甲醛溶液中固定,石蜡包埋。
1.4 血清肝功能 血清ALT、AST含量测定,均按照试剂盒说明书操作,采用全自动生化分析仪检测。
1.5 肝组织病理学观察 取肝组织石蜡块,制备切片(4~10 μm),苏木精—伊红染色法(hematoxylin-eosin stainin,HE)染色,显微镜下观察(×200)肝组织病理学变化。
1.6 免疫组化检测HSP60表达 取肝组织石蜡块,切片(4~10 μm),脱蜡后EDTA抗原修复液高压修复法修复抗原,恢复室温后3%的H2O2灭活内源性过氧化物酶,蒸馏水洗 3次,血清封闭液37℃封闭30 min,加入一抗[抗体浓度1∶200,溶于磷酸缓冲盐溶液(phosphate buffer saline,PBS)中],4℃孵育过夜后用PBS洗涤3次,再加二抗室温孵育30 min,用PBS洗涤3次,最后二氨基联苯氨(diaminobezidin,DAB)显色,HE轻度复染。脱水,透明,封片,光镜观察。每次实验均以PBS替代一抗体作为阴性对照。
1.7 评定标准 细胞浆中出现棕黄色颗粒判定为HSP60蛋白染色阳性。结果由2位病理医师独立判定评分,在高倍镜下随机取五个视野,免疫组化得分(immunoreactivity score,IS)由染色面积×染色强度来判断。A为染色面积,按切片中显色细胞比例评分,1分为显色细胞占切片中细胞总数的1/3 以下;2 分为1/3~2/3细胞显色;3分为2/3 以上细胞显色。B为染色强度,按切片中细胞显色有无及深浅评分,0分为细胞无着色;1分为显色浅黄色;2分为显色深黄色;3分为显色棕褐色。每例样本IS积分=A×B,按积分高低区分,<1分为阴性(-);2~4分为阳性(+);>5分为强阳性(++)。
1.8 统计学处理 所有数据均采用SPSS 17.0进行分析,计量资料以x ±s表示,其中符合正态分布的计量资料,三组间差异比较采用单因素ANOVA检验,组间两两比较采用LSD检验进行。正态分布资料采用Pearson相关,非正态分布资料采用Spearman相关分析。所有检验以双侧P<0.05为差异有统计学意义。
2 结 果
2.1 三组处理对大鼠肝功能影响 为观察诱导的急性肝损伤鼠肝脏功能的动态变化,用生化法检测大鼠血清ALT、AST水平。空白组、非肝损伤组及肝损伤组大鼠在处理后6、12 h及1、2、3、5、7 d时血清ALT、AST水平的变化,见表1。在各个时间段,非肝损伤组大鼠肝脏ALT、AST水平与空白组比较,差异无统计学意义;在6 h时,肝损伤组ALT、AST水平较空白组及非肝损伤组有显著升高(P<0.05),并且在12 h时ALT水平达到高峰(P<0.05),提示造模成功;在 1、2 d时,肝损伤组ALT、AST水平有所下降,但仍显著高于空白组及非肝损伤组 (P<0.05),3 d时肝损伤组ALT、AST表达仍高于空白组及非肝损伤组,但差异无统计学意义;5、7 d时ALT、AST表达恢复正常水平,其他组间差异无统计学意义。
2.2 三组处理后大鼠肝脏组织病理学的变化 为了进一步确定肝组织损伤情况,采用HE染色检测肝组织病理损伤情况,结果显示,空白组和非肝损伤组大鼠肝组织肝小叶结构正常、排列整齐;肝损伤组6 h时肝小叶结构排列紊乱,镜下肝细胞肿胀气球样,肝细胞点状和小片状坏死;肝损伤组12 h时,肝细胞发展为大片状坏死,由图可见本研究成功地建立了急性肝损伤模型(图1)。
2.3 各实验组大鼠肝组织HSP60的表达 采用免疫组化技术观察急性肝损伤大鼠肝脏HSP60表达的动态变化(图2、图3),结果发现,空白组和非肝损伤组大鼠肝脏中HSP60均有一定的基础表达,但两组表达差异无统计学意义;肝损伤组大鼠在处理后6 h的HSP60表达显著增强(P<0.05),12 h达到高峰(P<0.05); 1、2、3 d时肝细胞特异性染色明显减弱,但仍高于空白组和非肝损伤组(P<0.05);5、7 d时HSP60表达恢复到基础水平。
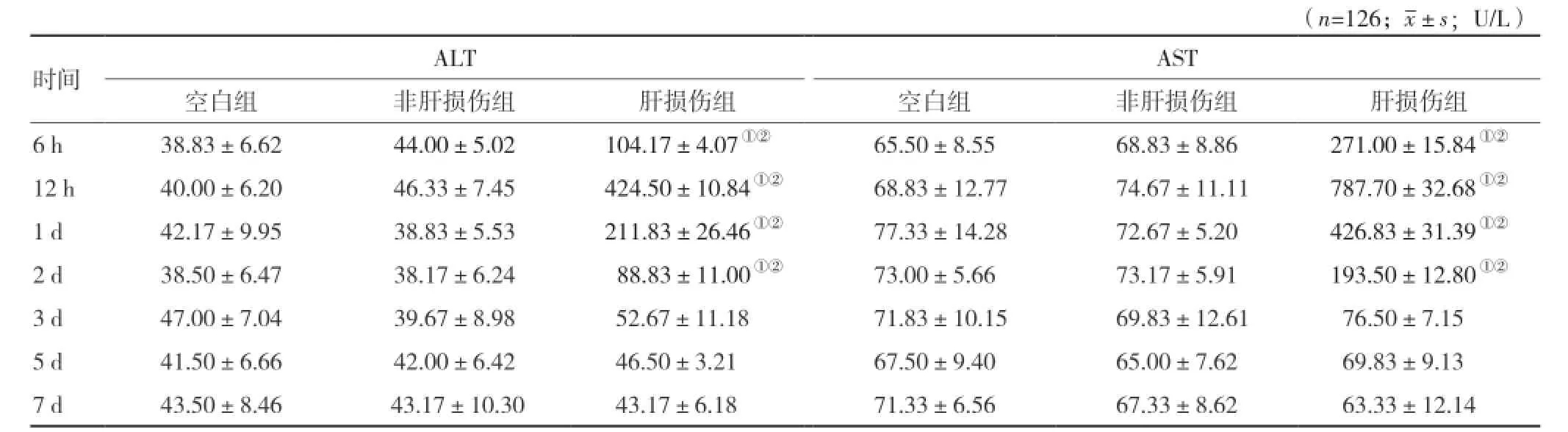
表1 三组处理后大鼠的血清ALT、AST表达
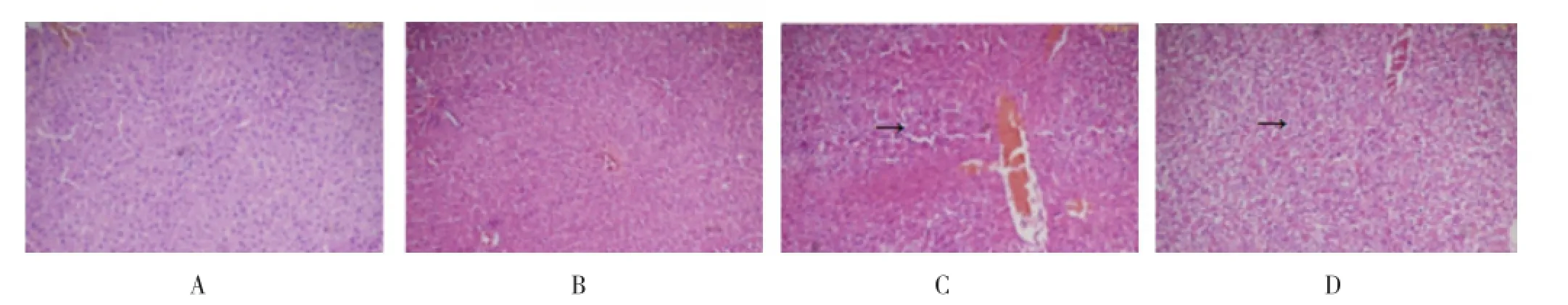
图1 三组急性肝损伤大鼠肝脏病理切片(HE×200)
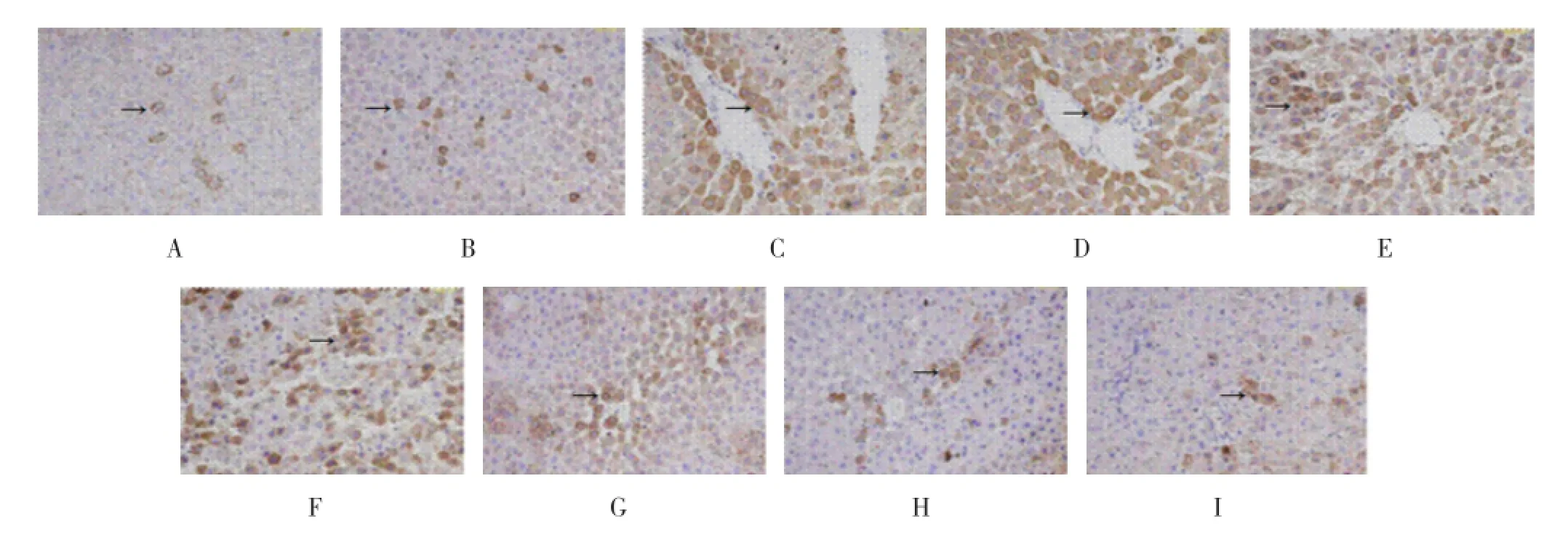
图2 三组处理后大鼠肝脏组织HSP60蛋白表达(免疫组化染色×200)
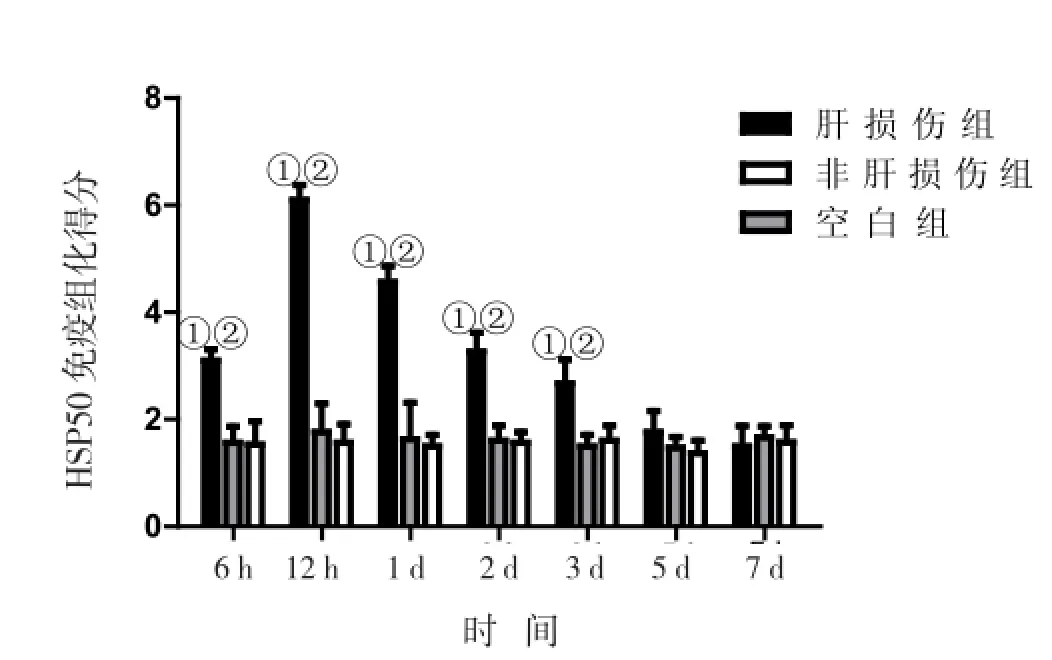
图3 三组处理后大鼠肝脏组织HSP60蛋白表达免疫组化评分
2.4 HSP60与肝损伤的相关性 相关性分析显示:HSP60表达与肝损伤大鼠血清中ALT之间存在显著的正相关(r=0.9064, P<0.05,图4),同时HSP60与肝损伤大鼠血清AST也呈正相关关系(r=0.9294, P<0.05,图5)。
3 讨 论
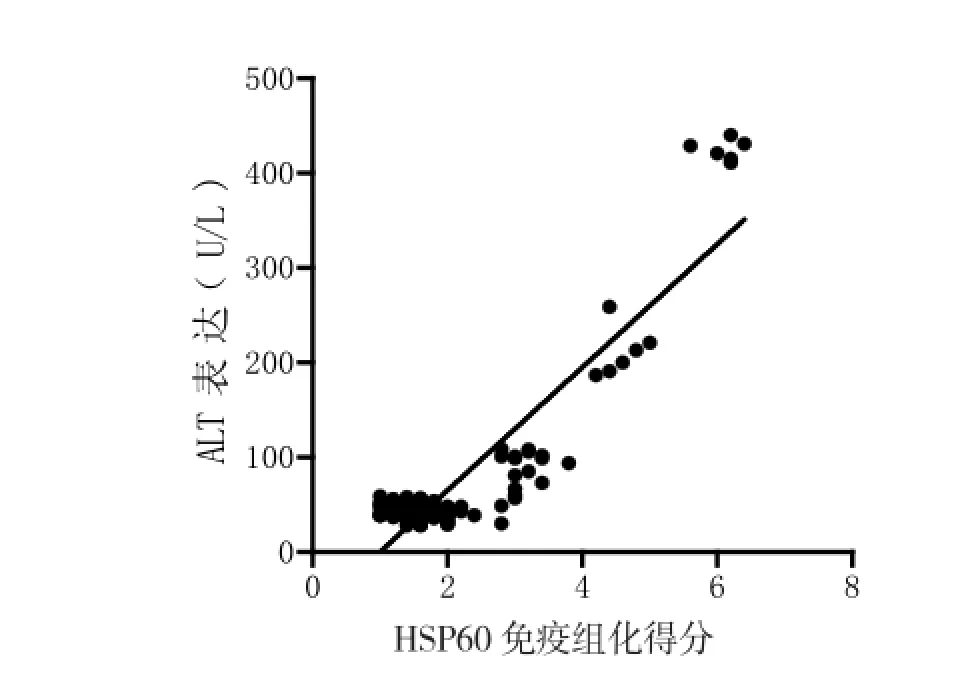
图4 HSP60表达与肝损伤大鼠血清中ALT呈正相关性(Person相关)
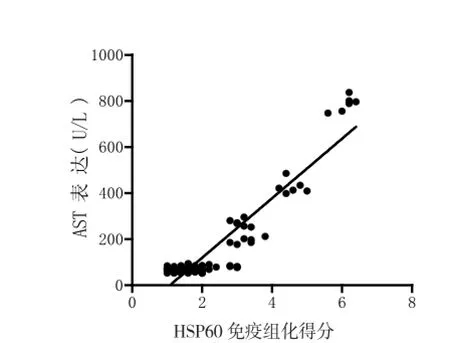
图5 HSP60表达与肝损伤大鼠血清AST呈正相关性(Person相关)
急性肝损伤是由于各种肝脏相关疾病、药物性肝损伤、大量饮酒、钝性撞击等所诱导的急性病变,如不及时治疗可发展为急性肝功能衰竭,病死率高[7]。因此,早期诊断、治疗急性肝功能损伤在临床上具有十分重要的意义。急性肝损伤可刺激机体产生应激反应,通过各种信号分子的传导从而增强机体的保护能力[8]。近年研究表明,预热和缺血预处理都会使肝脏组织HSP增加,HSPs在肝脏应激中起保护作用[9,10]。如在受热刺激的肉鸡肝脏中,HSP90累积,提高肝脏的耐热性[11]。大鼠经热休克处理24 h后,其心、肝、脑、肺、肾等五种组织中的HSP70含量均较正常对照组显著增加。在肝脏手术切除创伤研究中发现,HSP70表达的量与创伤程度呈正相关,因此,HSP70可作为评断手术创伤严重程度的指标。HSP70在大鼠酒精性肝损伤中同样具有重要的保护作用。相对于HSP70而言,HSP60作为热休克蛋白家族重要的一员,其在肝脏损伤及修复过程中的变化及作用却一直未被研究。因此,本研究制备了生物撞击机撞击诱导大鼠急性肝损伤的模型,观察空白组、非肝损伤组和肝损伤组大鼠肝脏组织的病理变化,检测了各组大鼠血清 ALT、AST 的变化趋势及肝组织中HSP60的动态表达,从而探讨HSP60在生物撞击诱导的大鼠急性肝损伤和肝再生中的作用。肝脏病理组织学结果和各组血清ALT、AST的变化趋势进一步证明了大鼠急性肝损伤的病理过程中伴随着肝脏的再生修复过程。在这个过程中,HSP60的表达量也随着急性肝损伤的加重,呈现出一定变化规律,说明HSP60可能与肝脏的应激保护机制存在密切联系。
ALT、AST主要分布于肝组织肝细胞的细胞浆和线粒体中,而血清中ALT、AST含量很少。当肝实质细胞受损或坏死时,细胞膜通透性增加并导致线粒体损伤,胞质中ALT、AST大量流出,血清中ALT、AST水平就明显升高,提示肝细胞破坏,所以ALT、AST是肝细胞损伤的敏感指标[12]。本实验过程中,肝损伤组采用生物撞击法处理大鼠,与空白组比较,血清中ALT、AST含量显著增高,提示肝细胞受损严重;而肝损伤组与非肝损伤组比较, ALT、AST 的增加,并且非肝损伤组ALT、AST水平与空白组无差别,说明ALT、AST升高主要由肝损伤引起,从而排除生物撞击引起其他组织损伤对ALT、AST水平的影响。进一步肝组织病理学检测发现,肝损伤组大鼠肝小叶结构破坏及肝细胞肿胀、坏死,空白组和非肝损伤组肝组织正常。
HSP60是热休克蛋白家族的一员,是一种线粒体蛋白,也是在机体损伤刺激导致的应激反应中起保护作用的一类高度保守的蛋白质[13]。HSP60在大鼠睾丸的缺血-再灌注后,表达高于正常水平,而相应的细胞凋亡减少,因此推测HSP60在缺血状态应激高表达,暂时抑制细胞凋亡,保护机体以减少损伤,这共同说明HSP60在机体损伤过程中起保护作用[14]。这可能与HSP60的各种重要生物学保护功能有关[15]:(1)分子伴侣作用,HSP10通过结合HSP60来调节其与底物的结合及三磷酸腺苷(adenosinetriphosphatase,ATP)酶的活性,从而帮助重新折叠错误构象的多肽链和蛋白质,并且帮助清除发生不可逆损伤的蛋白,使细胞不受应激伤害。(2)抗细胞凋亡的作用,有直接和间接两种方式。直接作用是指HSP60影响线粒体内的凋亡相关因子,抑制线粒体凋亡通路的激活;间接作用为HSP60通过维持正常的呼吸链运作,减少自由基的产生从而抑制凋亡。(3)抗氧化作用,应激时氧自由基增多,通过氧化脂质会对生物膜的液态性、流动性、通透性产生影响,而对细胞及亚细胞器如线粒体、溶酶体等造成破坏。HSP60与脂膜结合,防止自由基对脂膜的损伤。另外,HSP60可直接释放和增加内源性过氧化酶如超氧化物歧化酶(superoxide dismutase, SOD)水平,催化氧自由基发生歧化反应从而清除氧自由基。本实验结果证实,在急性肝损伤中,HSP60表达量与肝损伤进程密切相关:6、12 h, 肝损伤组ALT、AST不断增加,说明肝损伤逐渐加重,HSP60的表达量逐渐上升,可能是其对肝脏保护作用逐渐增强的表现。12 h后,血清标记物ALT、AST和组织观察肝脏的损伤程度也逐渐降低,HSP60的表达量开始下降,说明可能随着肝损伤逐渐得到修复,HSP60的保护作用下降;肝损伤在第3天恢复至正常,HSP60蛋白在第5天恢复正常,说明在肝损伤恢复正常过程中,HSP60的保护作用也逐渐消失。在整个急性肝损伤过程中, HSP60的表达量也随着肝损伤的加重或修复,呈现出一定变化规律,说明HSP60可能与肝脏的应激保护机制有关。综上所述,在生物撞击处理诱导的急性肝损伤过程中,肝脏产生HSP60增多与肝损伤程度呈正相关,因此HSP60可作为急性肝损伤的分子标记物,并可能在肝损伤过程中起保护作用,但其在肝损伤修复过程中的具体作用机制,仍有待深入研究。
[1]陈明帅,徐 超,宋新超.热休克蛋白的研究进展[J].经济动物学报,2016, 20(1):44-53. DOI: 10.13326/j. jea.2016.1116.
[2]Luo J, Shen W L, Montell C. TRPA1 mediates sensation of the rate of temperature change in Drosophila larvae [J]. Nat Neurosci, 2017, 20(1): 34-41. DOI: 10.1038/nn.4416.
[3]喻荷淋,陈 隽.热休克蛋白在动脉粥样硬化中的作用研究进展[J].重庆医学,2013, 42(5):585-587. DOI: 10.3969/j.issn.1671-8348.2013.05.042.
[4]栗振义,龙瑞才.植物热激蛋白研究进展[J].生物技术通报, 2016, 32(2): 7-13. DOI: 10.13560/j.cnki.biotech. bull.1985.2016.02.003.
[5]Yan Z, Wei H, Ren C, et al. Gene expression of Hsps in normal and abnormal embryonic development of mousehindlimbs [J]. Hum Exp Toxicol, 2015, 34(6): 563-574. DOI: 10.1177/0960327114555927.
[6]Shi J, Fu M, Zhao C, et al.Characterization and function analysis of Hsp60 and Hsp10 under different acute stresses in black tiger shrimp, Penaeus monodon [J]. Cell Stress and Chaperones, 2016, 21(2): 1-18. DOI: 10.1007/s12192-015-0660-6.
[7]齐 芬,任晓非,许建明.急性药物性肝损伤的临床研究[J].安徽医药, 2016, 20(8): 1603-1605. DOI: 10.3969/j.issn.1008-1704.2016.05.003.
[8]陈欣黎,孟 强,刘克辛. STAT3信号通路在肝损伤保护中的作用[J].世界华人消化杂志, 2014(8): 1051-1057. DOI: 10.11569/wcjd.v22.i8.1051.
[9]张 翌,蔡 逊,潘明新. 供肝缺血预处理保护作用的实验研究[J].华南国防医学杂志,2011, 25(3): 181-183.
[10]韩效帆, 张培建.热休克蛋白70保护肝缺血再灌注损伤的研究进展[J]. 中国普通外科杂志, 2013, 22(1): 98-103. DOI: 10.7659/j.issn.1005-6947.2013.01.023.
[11]雷 蕾, 鲍恩东.急性热应激肉鸡组织中Hsp90的表达与应激损伤[J]. 中国农业科学, 2008, 41(11):3816-3821. DOI: 10.3864/j.issn.0578-1752.2008.11.050.
[12]雷 箴,温 韬.松果菊苷对刀豆蛋白A所致急性肝损伤小鼠的保护作用及对细胞外组蛋白的影响[J].解放军医学杂志, 2016, 41(2): 97-102. DOI: 10.11855/j. issn.0577-7402.2016.02.03.
[13]张国锐,王元星.诱导热休克蛋白70形成预处理对心肌保护的研究进展[J].现代医药卫生, 2016, 32(14): 2199-2201. DOI: 10.3969/j.issn.1009-5519.2016.14.029.
[14]周利敏,姚冬梅.小鼠睾丸缺血-再灌注损伤过程中Hsp60的变化及其作用[J]. 成都医学院学报,2013,8(6): 640-643. DOI: 10.3969/j.issn.1674-2257.2013.06.002.
[15]Speciale A, Chirafisi J, Saija A. Nutritional antioxidants and adaptive cell responses: an update [J]. Current Molecular Med, 2011, 11(9): 770-789. DOI:10.2174/ 156652411798062395.
(2016-11-30收稿 2016-01-10修回)
(本文编辑 罗发菊)
Changes and significance of hepatic HSP60 in acute liver injury in rats
CAO Dong, ZHU Meiyi, WU Jiangwen, ZHOU Tao, and OUYANG Jun. Department of Emergency, The First Affiliated Hospital of Medical College, Shihezi University, Xinjiang Uygur Autonomous Region, Shihezi 832000, China
OUYANG Jun, E-mail:ouyang-jzk@163.com
Objective This study was designed to observe the changes of heat shock protein 60 (HSP60) in the development of acute hepatic injury and analyze the relationship between HSP60 and acute hepatic injury in rats. Methods 126 SD rats were randomly allocated into three groups: blank control group, non-liver injury group and liver injury group. Rats in the control group received no injury, rats in the non-liver injury group received a left leg fracture and rats in the liver injury group received an acute hepatic injury induced by a modified biological impact machine-IV(BIM-Ⅳ). Blood samples from the three groups were collected at 6 hours, 12 hours, 1 day, 2 days, 3 days, 5 days and 7 days to determine the alanine aminotransferase (ALT) and aspartate transaminase (AST) levels. The samples were cut and the livers of rats were disected soon after, and pathomorphological changes of liver tissue samples were examined under a microscope by means of hematoxylin-eosin (HE) stainning. Immunohistochemical staining was also used to detect the changes of HSP60 during acute liver injury in rats. Results (1) The levels of ALT and AST in non-hepatic injury group did not significantly change compared to the control group at each time point as mentioned above(P>0.05). Compared with the blank group and non-liver injury group, the serum ALT and AST levels in liver injury group were significantly higher at 6 hours, 12 hours, 1 day, 2 days, 3 days, 5 days and 7 days respectively (P<0.05 ), and they increased significantly at the 6 hour mark [(104.17±4.07) U/L, (271.00±15.84) U/L] and peaked at 12 hours [(424.50±10.84) U/L, (787.70±32.68) U/L], then went down and returned normal levels on the 3rd day. (2) HE staining showed inflammatory cell infiltration and cell degeneration in hepatic injury group, the damage was most marked at 12 hours. (3) The immunohistochemical staining showed the levels of HSP60 in the hepatic injury group was significantly increased compared to the control group at both the 6 and 12 hour mark and reached the its highest level at 12 hours. The expression of HSP60 went down on the 1st, 2nd, and 3rd day, but was still higher than the control group until the 5th day, when it returned to the basal level. (4) There was significant correlation between the level of HSP60 and ALT (r=0.9064, P<0.05) and AST (r=0.9294, P<0.05). Conclusions The expression of HSP60 significantly changes during acute liver injury, which is consistent with the change of degree of liver injury in rats.
rats; hepatic injury; heat shock protein 60; alanine aminotransferase; aspartate aminotransferase
R332;R364
10.13919/j.issn.2095-6274.2017.02.004
国家自然科学基金(81560312)
832000,新疆维吾尔自治区石河子大学医学院第一附属医院急诊科
欧阳军,E-mail:ouyang-jzk@163.com

