早期社会隔离对雌性ICR小鼠焦虑水平、社会行为及神经内分泌的影响
程广超, 谢立梦, 王建礼
(北方民族大学生物科学与工程学院,银川750021)
早期社会隔离对雌性ICR小鼠焦虑水平、社会行为及神经内分泌的影响
程广超, 谢立梦, 王建礼*
(北方民族大学生物科学与工程学院,银川750021)
许多证据表明早期生活应激会影响动物成年后的行为和神经化学改变,然而该过程的机制还不完全清楚。脑源性神经营养因子(BDNF)、催产素(OT)和糖皮质激素受体(GR)参与对应激的神经适应性反应。本实验将出生3 d后的雌性ICR小鼠幼仔每日隔离3 h直至出生21 d,在60日龄时检测其焦虑水平、社会行为及血清中皮质酮(CORT)和OT的水平,同时检测了中枢BDNF、OT和GR的阳性神经元表达。结果表明,与对照组相比,早期隔离组小鼠的焦虑水平增加,运动性和社会行为减少,同时血清中CORT水平上升、海马CA1和CA2/3区的BDNF及GR的阳性神经元表达下降,下丘脑室旁核和视上核的OT阳性神经元表达减少。这些结果表明,早期社会隔离下调了BDNF、OT和GR的水平,并通过调制应激系统影响雌性ICR小鼠的情绪与社会行为。
隔离;应激;焦虑;海马;雌性
幼体与亲本之间的社会互作是动物发育早期的主要社会经验。研究发现大鼠幼仔早期发育过程中,高水平的母性行为通过基因表达的组织特异性效应,可使幼仔成年后减弱下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA轴)对威胁行为的反应(Meaney,2000);相反,出生后母本隔离可诱发子代成年后的行为和神经变化,甚至可能导致精神疾病。例如,Wistar大鼠和C57BL/6小鼠的雄性幼仔每日与母鼠隔离3 h,会增加其攻击行为(Veenemaetal.,2006,2007)和焦虑水平(Lambás-Seasetal.,2009)。除行为变化外,母本隔离还会引起子代的神经化学变化。例如,增加大脑纹状体的多巴胺(dopamine,DA)水平,减少前扣带皮层和运动皮层等处5-HT1A受体的结合力(Ognibeneetal.,2008)以及海马和枕叶皮层的神经肽Y(neuropeptide Y,NPY)及钙调基因相关肽(calcitonin-gene related peptide,CGRP)的表达(Husumetal.,2002)。因此,动物的神经和行为水平在发育早期具有很高的可塑性,这一关键期的社会经验对其发育产生深远影响。
脑源性神经营养因子(brain derived neuro trophic factor,BDNF)分布于不同的脑区,包括海马和新皮层,具有支持神经元生存、调节轴突生长和促进突触可塑性等功能(Fumagallietal.,2007;Pillai & Mahadik,2008)。BDNF涉及神经生长、分化和突触发生时形态可塑性,具有调节早期社会经验对脑功能影响的作用。例如,对具有雄性参与抚育的棕色田鼠Microtusmandarinus研究发现,早期父本剥夺会减少幼仔成年后海马CA1和CA2/3区的BDNF表达 (Wuetal.,2014)。催产素(oxytocin,OT)是一种重要的神经肽,主要由下丘脑室旁核(paraventricular nucleus,PVN)与视上核(supraoptic nucleus,SON)产生,具有调制应激、情绪和社会行为等功能(Keverne & Curley,2004)。HPA轴是动物的应激反应轴,早期生活应激会升高皮质酮(corticosterone,CORT)的基础分泌值、延长应激诱导的CORT和促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)的分泌,并升高下丘脑促肾上腺皮质激素释放因子(corticotropic-releasing factor,CRF)的水平(Plotsky & Meaney,1993;Liuetal.,1997)。在HPA轴应激反应的负反馈调节中,海马糖皮质激素受体(glucocorticoid receptor,GR)是一个关键物质,它可以通过与CORT结合调节应激反应。因此,海马GR的激活对于减少焦虑和应激至关重要。
ICR小鼠除了母性抚育外,在幼仔出生3~5 d后,雄性能够识别自己的幼仔,并对幼仔表现出一定的亲本行为,如蹲伏、嗅舔和衔回幼仔,该行为对于提高幼仔的存活率具有重要意义(Liuetal.,2013)。其中,雄性ICR小鼠表现出配偶依赖的亲本衔回行为,这一行为在C57BL/6和BALB/c小鼠中没有被发现,具有品系专一性(Liuetal.,2013;Liangetal.,2014) 。因此,该品系小鼠亲子互作较为紧密,可以作为研究早期亲本隔离对子代影响的模型动物。早期隔离影响动物成年后的行为和神经化学改变的机制还不完全清楚。在此,本研究探讨了早期社会隔离(与双亲及同胞隔离)对雌性ICR小鼠情绪、社会行为和中枢BDNF、OT、GR以及血清OT和CORT的影响。
1 材料和方法
1.1 材料
ICR小鼠购自宁夏医科大学实验动物中心[生产许可证号:SCXK(宁)2011-0001,使用许可证号:SYXK(宁)2011-0001]。雌、雄鼠按2∶1的比例配对,塑料饲养笼饲养,木屑做垫料,饲料和饮水充足。室温25 ℃,光照周期12L∶12D。出生的幼仔日龄以分娩当日为0 d计算。实验分为2组:早期隔离组(n=12),幼仔出生3 d后进行隔离,每天早晨将要隔离的雌性幼仔单独置于有垫料和棉花的小烧杯中,烧杯放入恒温水浴以保持温度,每天隔离3 h后再放回巢中,隔离至出生21 d,第23天与亲本分窝,同性别集中饲养,并于60日龄进行实验;对照组(n=12)不进行社会隔离,其他程序与隔离组相同。
1.2 行为实验
1.2.1 旷场行为 旷场行为实验可用来评估实验动物的焦虑水平和运动能力(Fiore & Ratti,2007)。幼仔生长至60日龄开始实验,实验于09∶00进行。旷场箱的结构参照Fiore和Ratti (2007)描述而制:旷场箱(长50 cm×宽50 cm×高25 cm)底面16等分,中间4等分为中央区域(central area),剩余12等分为周围区域(peripheral area)。在旷场箱正上方1.5 m处安放4×60 W灯泡照明,使观察箱中心光照强度为400 lx。以中央区域停留时间的百分比评估焦虑样行为,穿格总次数评估运动性。行为观察开始时,小鼠被置于旷场箱中央区域,使用DV摄像机(HDR-XR260E,Sony)拍摄5 min。每只小鼠实验结束后,分别使用75%的酒精对旷场箱进行清洗以清除气味。
1.2.2 高架十字迷宫 所有测试鼠的旷场实验结束后,进行高架十字迷宫实验。高架十字迷宫是具有一对开放臂和一对封闭臂、距离地面50 cm高的行为测试架。开放臂和封闭臂的尺寸均为长30 cm×宽5 cm,4条臂的中间区域为5 cm×5 cm,封闭臂两侧有25 cm高的黑色金属墙。它利用动物对新异环境的探究特性和对高悬敞开臂的恐惧形成矛盾冲突行为来考察动物的焦虑状态。动物在开放臂停留的时间可以反映动物的焦虑水平,在开放臂停留的时间越短,焦虑情绪就越高(Carobrezetal.,2005)。实验时,将小鼠单独放在中间区域开始观察,用DV摄像机记录5 min内小鼠在开放臂的时间及进入开放臂的频次。
1.2.3 社会互作 所有测试鼠在高架迷宫实验结束后进行社会互作测试。测试在观察箱(长44 cm×宽22 cm×高16 cm)进行,箱底覆以2 cm厚的木屑。测试时选择1日龄和体质量与被测鼠相似的同性个体作为刺激鼠,刺激鼠背部作标记。将实验鼠和刺激鼠分别置于观察箱两侧,中央用木板隔开,待适应5 min 后,取掉挡板,用DV摄像机拍摄15 min内小鼠的行为。行为类型的划分参考关于社会行为的研究(Vanderschurenetal.,1995;Jiaetal.,2009)。
社会探究(social investigation):嗅闻或嗅舔刺激鼠身体的任何一个部分(包括肛殖区、面部及躯体)。
亲密行为(affiliative behavior):包括聚团、跨越身体和相互修饰等。
跟随(following behavior):刺激鼠走动,被测鼠紧随其后。
直立(rearing):后腿蹬在地上,直立身体嗅闻空气。
自饰(self-grooming behavior):舔舐或用爪有节律地在口部、面部、耳部、腹下、侧肋和肛殖区等处挠动。
1.3 酶联免疫吸附实验
社会互作测试后,小鼠(n=6)经腹腔注射戊巴比妥钠麻醉。通过眼球采血收集血液样本,收集后立即离心,血清在测定前贮存于-20 ℃。购买小鼠OT和CORT 酶联免疫试剂盒(苏州卡尔文科技公司)检测,检测方法遵循使用说明书。
1.4 免疫组织化学染色
先用4%多聚甲醛进行灌注固定。取出脑组织放入4%多聚甲醛进行后固定(4 ℃),其后4 ℃下置于30%蔗糖溶液直至组织沉底。用冰冻切片机对脑作冠状切片,切片厚度20 μm。用山羊血清封闭液37 ℃下封闭1 h。滴加由抗体稀释液稀释的一抗BDNF(1∶100;货号:sc-20981,Santa Cruz,中杉金桥生物技术有限公司分装)、OT(1∶2 000,货号:AB911,Upstate,Lake Placid,USA)和GR(1∶100;货号:sc-1004,Santa Cruz,中杉金桥生物技术有限公司分装),4 ℃下孵育72 h,0.01 M PBS漂洗5 min×3次。滴加生物素化羊抗兔IgG(博士德生物工程有限公司,武汉),37 ℃下孵育1.5 h,0.01 M PBS漂洗5 min×3次。滴加SABC试剂(博士德生物工程有限公司,武汉),37 ℃下孵育2.5 h。0.01 M PBS漂洗10 min×4次。DAB显色剂显色。常规酒精脱水,二甲苯透明,中性树胶封片。
各脑区参照Paxinos和Franklin(2001)编著的《The Mouse Brain in Stereotaxic Coordinates》定位。每只鼠的各核区选择3张连续的切片量化,利用显微测微尺,计算相同面积内单侧脑区核团的阳性神经元数目,包括海马CA1、CA2/3区和齿状回(dentate gyrus,DG)的BDNF和GR表达以及下丘脑PVN和SON的OT表达。
1.5 统计分析
小鼠各行为变量通过Jwatcher分析其持续时间。所有数据用SPSS 13.0进行统计分析。One-sample Kolmogorov-Smirnov检测数据正态性。独立样本t检验分析组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 旷场行为
与对照组相比,早期隔离组小鼠在旷场箱内的穿格总次数(t22=3.853,P=0.001)(图1:A)及在中央区域停留时间百分比(t22=2.577,P=0.017)(图1:B)显著下降。
2.2 高架十字迷宫
与对照组相比,早期隔离组小鼠在开放臂的停留时间百分比显著下降(t22=2.664,P=0.015)(图2:A),但进入开放臂的频次差异无统计学意义(t22=0.822,P=0.421)(图2:B)。
2.3 社会互作
与对照组相比,早期隔离组小鼠的社会探究行为(t22=2.025,P=0.049)、亲密行为(t22=6.426,P<0.001)及直立行为(t22=4.872,P<0.001)显著下降;跟随行为(t22=0.471,P=0.640)和自饰行为(t22=0.080,P=0.937)差异无统计学意义(图3)。
2.4 血清OT和CORT水平
与对照组相比,早期隔离组小鼠的血清CORT浓度(t10=-2.422,P=0.036)显著上升,但OT浓度(t10=-2.189,P=0.053 5)差异无统计学意义(图4)。

A. 穿格总次数, B. 中央区域停留时间百分比;*P<0.05; 下同。
A.Number of transitions, B. The percent of time in central area;*P<0.05; the same below.

A.开放臂停留时间百分比, B. 进入开放臂频次。
A. The percent of time in the open arms, B. Frequency of entering the open arms.
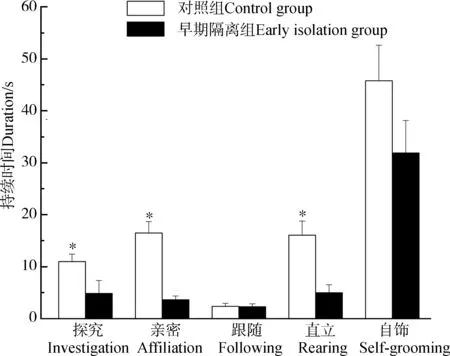
图3 雌性ICR小鼠的同性社会互作
2.5 BDNF、OT和GR的阳性神经元表达
与对照组相比,早期隔离组的ICR小鼠在海马CA1(t10=4.905,P=0.001)、CA2/3(t10=7.100,P<0.001)和DG区(t10=5.724,P<0.001)的BDNF阳性神经元表达下降(图5:A,图6);下丘脑PVN(t10=7.961,P<0.001)和SON(t10=3.165,P=0.010)的OT表达下降(图5:B,图7:A~D);海马CA1(t10=8.051,P<0.001)和CA2/3(t10=12.420,P<0.001)的GR表达下降,但DG的GR表达差异无统计学意义(t10=0.500,P=0.628)(图5:C,图7:E~H)。

图4 雌性ICR小鼠血清OT(A)和CORT(B)的浓度
Fig. 4 The concentrations of OT (A) and CORT (B) in serum of female ICR mice

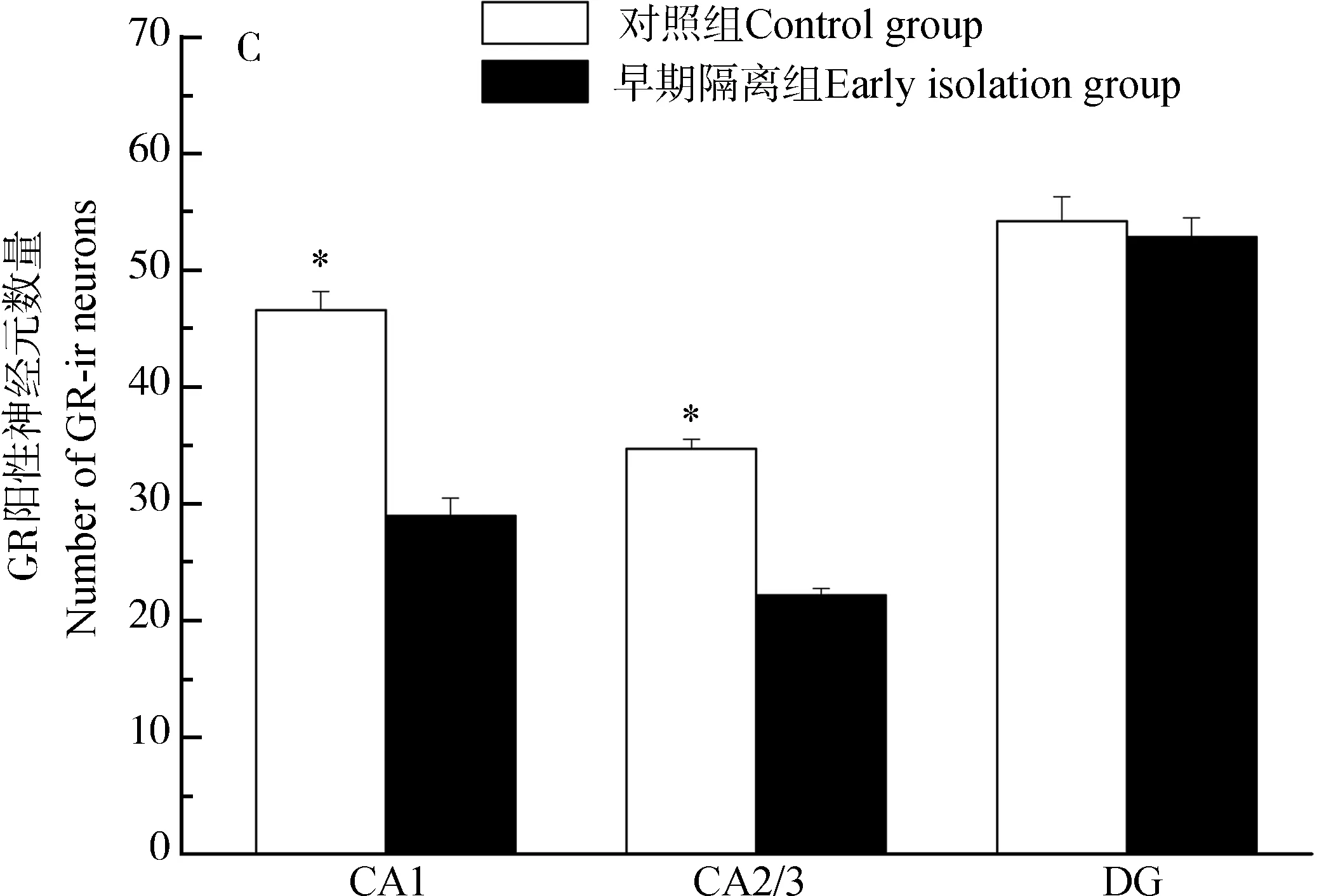
图5 雌性ICR小鼠BDNF、OT和GR的阳性神经元表达
DG. 齿状回, PVN. 室旁核, SON. 视上核。
DG. dentate gyrus, PVN. paraventricular nucleus, SON. supraoptic nucleus.
3 讨论
3.1 早期社会隔离对幼体成年后情绪和社会行为的影响
在旷场行为实验中,与对照组相比,早期隔离组小鼠的穿格总次数减少。穿格总次数反映了动物个体的运动性,该结果表明早期社会隔离降低了雌性ICR小鼠的运动性。与本实验结果不同的是,对成年的Wistar和Lister-Hooded大鼠进行隔离,会增加其运动性,但对Sprague-Dawley大鼠隔离没有影响(Weissetal.,2000)。对BALB/c小鼠研究发现,断乳后社会隔离会增加雌性的运动性(刘朝宝等,2016)。
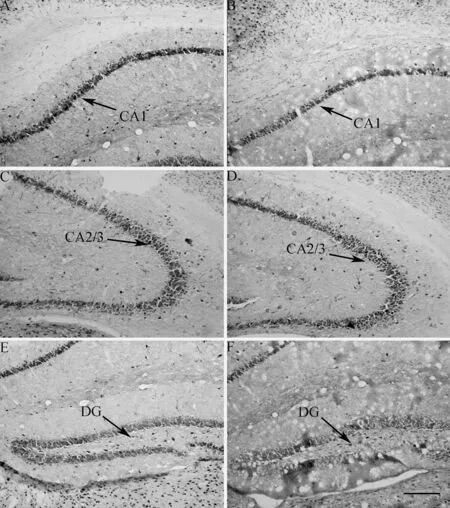
图6 雌性ICR小鼠海马CA1、CA2/3和DG的BDNF免疫染色
对照组(A、C、E), 早期隔离组(B、D、F); DG. 齿状回; 比例尺=100 μm。
Control group (A, C and E), early isolation group (B, D and F); DG. dentate gyrus; scale bar=100 μm.
因此,除了物种、品系的原因外,动物隔离时所处的发育阶段对隔离后的运动效应也非常重要。早期隔离后,小鼠在中央区域活动时间显著少于对照组,在高架十字迷宫实验中,早期隔离组在开放臂中的时间也少于对照组,提示早期隔离增加了雌性ICR小鼠的焦虑水平。这些发现与一些隔离实验的结果相似,例如,青春期的雌性Sprague-Dawley大鼠经历较短时间的隔离后,用高架十字迷宫测试,发现其在开放臂的时间减少(Leussis & Andersen,2008);经历每天3 h母本隔离的Wistar大鼠(Wigger & Neumann,1999)和C57BL/6小鼠(Romeoetal.,2003),幼仔成年后焦虑水平升高。对人类调查也发现早期双亲缺失或分离是成年期精神疾病,特别是焦虑症和抑郁症形成的重要诱发因素(Agidetal.,2000)。本实验中早期隔离的幼体不但与双亲隔离,同时也与同胞隔离,这种隔离模式对幼体而言是一种更为严酷的社会应激(Pryce & Feldon,2003),从而更有可能引起焦虑。
在社会互作测试中,早期隔离降低了雌性ICR小鼠成年后的社会探究行为和亲密行为。这一结果与先前一些实验结果相似。例如,对Wistar大鼠研究发现早期隔离减少了成年后个体的社会动机(Mintzetal.,2005);早期母子互作中断能够降低大鼠成年后社会交往的频次和时间(Caldjietal.,2000)。与正常抚育的幼仔相比,社会隔离的幼仔获得的亲本抚育更少,研究表明获得较多母性抚育的子代,其社会行为明显高于接受较少母性抚育的子代(Coutellieretal.,2009)。对早期父本剥夺的棕色田鼠幼仔研究发现,幼仔成年后对另一个体的探究和聚团行为显著减少(于鹏等,2010)。由于早期社会剥夺会导致奖赏动机的长时间下降(Levento-poulosetal.,2009),而个体间的社会互作是一种天然奖赏,因此,早期社会隔离造成社会行为减少可能源于奖赏动机的伤害。有趣的是,断乳后社会隔离会增加BALB/c小鼠的社会探究行为(刘朝宝等,2016),这表明出生后隔离与断乳后隔离对社会动机的影响不同。

图7 雌性ICR小鼠下丘脑的OT(A、B、C、D)和GR (E、F、G、H)的免疫染色
Fig. 7 OT (A, B, C and D) and GR (E, F, G and H) immunoreactive staining in the hypothalamus of female ICR mice
对照组(A、C、E、G), 早期隔离组(B、D、F、H); PVN. 室旁核, SON. 视上核; 比例尺=100 μm。
Control group (A, C, E and G), early isolation group (B, D, F and H); PVN. paraventricular nucleus, SON. supraoptic nucleus; scale bar=100 μm.
3.2 早期社会隔离对BDNF和OT水平的影响
早期隔离降低了海马CA1、CA2/3和DG区BDNF的表达。急性或慢性应激均会导致海马BDNF表达水平下降(Ueyamaetal.,1997;Tapia-Arancibiaetal.,2004)。经历母本剥夺的大鼠幼仔海马BDNF表达减少,神经发生受到抑制(Liuetal.,2000b;Mirescu & Peters, 2004);相反,群居且受到高水平母性抚育的小鼠幼仔海马BDNF水平较高(Branchietal.,2006)。断乳后隔离饲养的大鼠海马BDNF也会下调(Pisuetal.,2012),并影响情绪和感觉运动的控制(Carlsson,1988)。即使成年的C57BL/6J小鼠隔离后,焦虑水平也会增加,海马区BDNF表达水平下降(Berryetal.,2012)。这些实验结果说明不同发育阶段的社会隔离都可能引起BDNF水平下降。BDNF作为神经内分泌的效应物,参与应激反应及与焦虑相关的行为变化,并影响社会行为。
与对照组相比,早期隔离组血清OT水平没有发生显著变化,但隔离降低了PVN和SON的OT水平。研究表明母本隔离会减少雌性小鼠和大鼠PVN的OT表达(Veenemaetal.,2007;Tanakaetal.,2010),父本剥夺也会减少雄性棕色田鼠幼仔PVN的OT表达(Wangetal.,2012)。在母本育幼中,母鼠舔舐或修饰幼仔能够上调OT表达;相反,在母本隔离的环境下,母鼠舔饰行为的减少会下调OT分泌(Champagneetal.,2001)。本实验中,与对照组相比,早期隔离组的幼仔每日与双亲隔离3 h至断乳前,接受亲本嗅舔和修饰的育幼行为较少,这可能是OT下降的原因之一。此外,OT会减少应激诱导的CORT释放而导致焦虑(Windleetal.,1997)。因此,早期社会隔离使幼体与双亲和同胞的社会联系降低,抑制了中枢神经系统OT的表达,使得应激反应增强,从而导致动物的焦虑情绪。OT主要调节雌性的社会行为(Veenema & Neumann,2008),并通过调制DA的活动提高社会互作的奖赏价值(王建礼等,2011)。因此,本实验中OT水平的下调可能是社会探究行为和亲密行为减少的一个原因。
3.3 早期社会隔离对GR和CORT水平的影响
早期隔离升高了幼体血清CORT水平,降低了海马CA1和CA2/3区的GR表达。焦虑样行为与血浆CORT浓度呈正相关(Walesiuketal.,2006),经历母本隔离的大鼠幼仔和父本剥夺的棕色田鼠幼仔成年后CORT水平升高(Kalinichevetal.,2002;Wangetal.,2012),并且焦虑水平增加(Jiaetal.,2009)。因此,由早期隔离引起的焦虑水平升高与CORT的释放增加有关。当内源性糖皮质激素(GC)水平升高,HPA轴表现出对应激反应的负反馈调节时,海马GR具有重要作用。HPA轴对应激反应的减少与海马GR表达的增加相关(Plotsky & Meaney,1993)。同OT相似,母本嗅舔和修饰行为可部分地调制HPA轴的发育,如调制海马GR和下丘脑CRF的表达。接受母本舔舐和修饰较多的大鼠幼仔,成年后显示出稳定的GC负反馈(Liuetal.,2000a),并对新环境的探究行为增加(Caldjietal.,2000)。相反,产后母本隔离造成的嗅舔和修饰减少会诱导幼体应激反应增加(Wigger & Neumann,1999),降低海马的GR表达,使负反馈减少,CORT分泌增加(Liuetal.,1997)。母性环境尤其是母性嗅舔行为和修饰行为的强度可以改变GR启动子区域的甲基化模式,使GR的表达异常(Weaveretal.,2004)。因此,本实验中早期隔离引起的亲本嗅舔和修饰行为减少,导致海马CA1和CA2/3区GR水平下调,由此破坏了海马GR对HPA 轴负向调节能力,使得CORT增多,进而引起情绪或行为异常。
总之,BDNF和GR能够相互作用,研究发现抗应激的小鼠表达高水平GR时会呈现出高水平的BDNF(Ridderetal.,2005);注射CORT会减少DG和CA3区的BDNF mRNA表达(Smithetal.,1995)。本实验发现早期隔离的ICR小鼠幼仔成年后海马CA1和CA2/3区的BDNF和GR表达都呈现出较低的水平,也间接证实了二者的联系。此外,OT可以通过与HPA轴的应激激素相互作用调节情绪和社会行为(Lim & Young,2006)。因此,作为一种慢性应激,早期社会隔离可能通过下调BDNF、OT和GR水平损害应激系统的功能并影响与其有联系的脑区发育继而改变情绪和行为。
刘朝宝, 王建礼, 詹泊. 2016. 断乳后隔离对BALB/c小鼠的焦虑水平、社会行为及血清应激激素影响的性别差异[J]. 生命科学研究, 20(4): 325-357.
王建礼, 邰发道, 赵清梅. 2011. 社会互作奖赏效应的多巴胺依赖机制[J]. 生命科学, 23(5): 423-428.
于鹏, 贾蕊, 安晓雷, 等. 2010. 父本剥夺对子代棕色田鼠同性间行为及相关脑区神经元活性的影响[J]. 动物学杂志, 45(3): 37-46.
Agid O, Kohn Y, Lerer B. 2000. Environmental stress and psychiatric illness[J]. Biomedicine & Pharmacotherapy, 54(3): 135-141.
Berry A, Bellisario V, Capoccia S,etal. 2012. Social deprivation stress is a triggering factor for the emergence of anxiety- and depression-like behaviours and leads to reduced brain BDNF levels in C57BL/6J mice[J]. Psychoneuroendocrinology, 37(6): 762-772.
Branchi I, D’Andrea I, Fiore M,etal. 2006. Early social enrichment shapes social behavior and nerve growth factor and brain-derived neurotrophic factor levels in the adult mouse brain[J]. Biological Psychiatry, 60(7): 690-696.
Caldji C, Francis D, Sharma S,etal. 2000. The effects of early rearing environment on the development of GABAA, and central benzodiazepine receptor levels and novelty-induced fearfulness in the rat[J]. Neuropsychopharmacology, 22(3): 219-229.
Carlsson A. 1988. The current status of the dopamine hypothesis of schizophrenia[J]. Neuropsychopharmacology, 1(3): 179-186.
Carobrez AP, Bertoglio LJ. 2005. Ethological and temporal analyses of anxiety-like behavior: the elevated plus-maze model 20 years on[J]. Neuroscience & Biobehavioral Reviews, 29(8): 1193-1205.
Champagne F, Diorio J, Sharma S,etal. 2001. Naturally occurring variations in maternal behavior in the rat are associated with differences in estrogen-inducible central oxytocin receptors[J]. Proceedings of the National Academy of Sciences of the United States of America, 98(22): 12736-12741.
Coutellier L, Friedrich AC, Failing K,etal. 2008. Variations in the postnatal maternal environment in mice: effects on maternal behaviour and behavioural and endocrine responses in the adult offspring[J]. Physiology & Behavior, 93(1-2): 395-407.
Fiore L, Ratti G. 2007. Remote laboratory and animal behaviour: an interactive open field system[J]. Computers & Education, 49(4): 1299-1307.
Fumagalli F, Molteni R, Racagni G,etal. 2007. Stress during development: impact on neuroplasticity and relevance to psychopathology[J]. Progress in Neurobiology, 81(4): 197-217.
Husum H, Termeer E, Mathé AA,etal. 2002. Early maternal deprivation alters hippocampal levels of neuropeptide Y and calcitonin-gene related peptide in adult rats[J]. Neuropharmacology, 42(6): 798-806.
Jia R, Tai F, An S,etal. 2009. Effects of neonatal paternal deprivation or early deprivation on anxiety and social behaviors of the adults in mandarin voles[J]. Behavioural Processes, 82(3): 271-278.
Kalinichev M, Easterling KW, Plotsky PM,etal. 2002. Long-lasting changes in stress-induced corticosterone response and anxiety-like behaviors as a consequence of neonatal maternal separation in Long-Evans rats[J]. Pharmacology Biochemistry & Behavior, 73(1): 131-140.
Keverne EB, Curley JP. 2004. Vasopressin, oxytocin and social behaviour[J]. Current Opinion in Neurobiology, 14(14): 777-783.
Leussis MP, Andersen SL. 2008. Is adolescence a sensitive period for depression?Behavioral and neuroanatomical findings from a social stress model[J]. Synapse, 62(1): 22-30.
Leventopoulos M, Russig H, Feldon J,etal. 2009. Early deprivation leads to long-term reductions in motivation for reward and 5-HT1A binding and both effects are reversed by fluoxetine[J]. Neuropharmacology, 56(3): 692-701.
Liang M, Zhong J, Liu HX,etal. 2014. Pairmate-dependent pup retrieval as parental behavior in male mice[J]. Frontiers in Neuroscience, 8: 186.
Lim MM, Young LJ. 2006. Neuropeptidergic regulation of affiliative behavior and social bonding in animals [J]. Hormones and Behavior, 50(4): 506-517.
Liu D, Caldji C, Sharma S,etal. 2000a. Influence of neonatal rearing conditions on stress-induced adrenocorticotropin responses and norepinepherine release in the hypothalamic paraventricular nucleus[J]. Journal of Neuroendocrinology, 12(1): 5-12.
Liu D, Diorio J, Day JC,etal. 2000b. Maternal care, hippocampal synaptogenesis and cognitive development in rats[J]. Nature Neuroscience, 3(8): 799-806.
Liu D, Diorio J, Tannenbaum B,etal. 1997. Maternal care, hippocampal glucocorticoid receptors, and hypothalamic-pituitary-adrenal responses to stress[J]. Science, 277(5332): 1659-1662.
Liu HX, Lopatina O, Higashida C,etal. 2013. Displays of paternal mouse pup retrieval following communicative interaction with maternal mates[J]. Nature Communications, 4(1): 273-275.
Meaney MJ. 2000. Maternal care, gene expression, and the transmission of individual differences in stress reactivity across generations[J]. Annual Review of Neuroscience, 24(24): 1161-1192.
Mintz M, Rüedi-Bettschen D, Feldon J,etal. 2005. Early social and physical deprivation leads to reduced social motivation in adulthood in Wistar rats[J]. Behavioural Brain Research, 156(2): 311-320.
Mirescu C, Peters JE. 2004. Early life experience alters response of adult neurogenesis to stress[J]. Nature Neuroscience, 7(8): 841-846.
Ognibene E, Adriani W, Caprioli A,etal. 2008. The effect of early maternal separation on brain derived neurotrophic factor and monoamine levels in adult heterozygous reeler mice[J]. Progress in Neuro-psychopharmacology & Biological Psychiatry, 32(5): 1269-1276.
Paxinos G, Franklin KBJ. 2001. The mouse brain in stereotaxic coordinates 2nd ed[M]. New York: Academic Press.
Pillai A, Mahadik SP. 2008. Increased truncated TrkB receptor expression and decreased BDNF/TrkB signaling in the frontal cortex of reeler mouse model of schizophrenia [J]. Schizophrenia Research, 100(1-3): 325-333.
Pisu MG, Dore R, Mostallino MC,etal. 2011. Down-regulation of hippocampal BDNF and Arc associated with improvement in aversive spatial memory performance in socially isolated rats[J]. Behavioural Brain Research, 222(1): 73-80.
Plotsky PM, Meaney MJ. 1993. Early, postnatal experience alters hypothalamic corticotropin-releasing factor (CRF) mRNA, median eminence CRF content and stress-induced release in adult rats[J]. Molecular Brain Research, 18(3): 195-200.
Pryce CR, Feldon J. 2003. Long-term neurobehavioural impact of the postnatal environment in rats: manipulations, effects and mediating mechanisms[J]. Neuroscience & Biobehavioral Reviews, 27(1-2): 57-71.
Ridder S, Chourbaji S, Hellweg R,etal. 2005. Mice with genetically altered glucocorticoid receptor expression show altered sensitivity for stress-induced depressive reactions[J]. Journal of Neuroscience, 25(26): 6243-6250.
Romeo RD, Mueller A, Sisti HM,etal. 2003. Anxiety and fear behaviors in adult male and female C57BL/6 mice are modulated by maternal separation[J]. Hormones & Behavior, 43(5): 561-567.
Smith MA, Makino S, Kvetnansky R,etal. 1995. Stress and glucocorticoids affect the expression of brain-derived neurotrophic factor and neurotrophin-3 mRNAs in the hippocampus[J]. Journal of Neuroscience, 15(1): 1768-1777.
Tanaka K, Osako Y, Yuri K. 2010. Juvenile social experience regulates central neuropeptides relevant to emotional and social behaviors[J]. Neuroscience, 166(4): 1036-1042.
Tapia-Arancibia L, Rage F, Givalois L,etal. 2004. Physiology of BDNF: focus on hypothalamic function[J]. Frontiers in Neuroendocrinology, 25(2): 77-107.
Ueyama T, Kawai Y, Nemoto K,etal. 1997. Immobilization stress reduced the expression of neurotrophins and their receptors in the rat brain[J]. Neuroscience Research, 28(2): 103-110.
Vanderschuren LJ, Niesink RJ, Spruijt BM,etal. 1995. Influence of environmental factors on social play behavior of juvenile rats[J]. Physiology & Behavior, 58(1): 119-123.
Veenema AH, Blume A, Niederle D,etal. 2006. Effects of early life stress on adult male aggression and hypothalamic vasopressin and serotonin[J]. European Journal of Neuroscience, 24(6): 1711-1720.
Veenema AH, Bredewold R, Neumann ID. 2007. Opposite effects of maternal separation on intermale and maternal aggression in C57BL/6 mice: link to hypothalamic vasopressin and oxytocin immunoreactivity[J]. Psychoneuroendocrinolog, 32(5): 437-450.
Veenema AH, Neumann ID. 2008. Central vasopressin and oxytocin release: regulation of complex social behaviours[J]. Progress in Brain Research, 170: 261-276.
Walesiuk A, Trofimiuk E, Braszko JJ. 2006.Ginkgobiloba, normalizes stress and corticosterone-induced impairment of recall in rats[J]. Pharmacological Research: the Official Journal of the Italian Pharmacological Society, 53(2): 123-128.
Wang JL, Tai FD, Yan XF,etal. 2012. Paternal deprivation alters play-fighting, serum corticosterone and the expression of hypothalamic vasopressin and oxytocin in juvenile male mandarin voles[J]. Journal of Comparative Physiology, 198(11): 787-796.
Weaver IC, Cervoni N, Champagne FA,etal. 2004. Epigenetic programming by maternal behavior[J]. Nature Neuroscience, 7(8): 847-854.
Weiss IC, Iorio LD, Feldon J,etal. 2000. Strain differences in the isolation-induced effects on prepulse inhibition of the acoustic startle response and on locomotor activity[J]. Behavioral Neuroscience, 114(2): 364-373.
Wigger A, Neumann ID. 1999. Periodic maternal deprivation induces gender-dependent alterations in behavioral and neuroendocrine responses to emotional stress in adult rats[J]. Physiology & Behavior, 66(2): 293-302.
Windle RJ, Shanks N, Lightman SL,etal. 1997. Central oxytocin administration reduces stress-induced corticosterone release and anxiety behavior in rats[J]. Endocrinology, 138(7): 2829-2834.
Wu RY, Song ZZ, Wang S,etal. 2014. Early paternal deprivation alters levels of hippocampal brain-derived neurotrophic factor and glucocorticoid receptor and serum corticosterone and adrenocorticotropin in a sex-specific way in socially monogamous mandarin voles[J]. Neuroendocrinology, 100(2-3): 119-128.
Effects of Early Social Isolation on Anxiety Levels, Social Behaviors, and Neuroendocrine in Female ICR Mice
CHENG Guangchao, XIE Limeng, WANG Jianli*
(College of Biological Sciences and Engineering, Beifang University of Nationalities, Yinchuan 750021, China)
Accumulating evidence showed that early life stress induces significant behavioral and neurochemical changes in adulthood. However, the mechanisms of this process are not well understood. Brain-derived neurotrophic factor (BDNF), oxytocin (OT) and glucocorticoid receptor (GR) are implicated in the neuroadaptational response to stress. In this study, female ICR mice pups were subjected to repeated separation 3 h per day from postnatal day (PND) 3 to PND 21. On PND 60, the anxiety levels, social behaviors, serum corticosterone (CORT) and OT were assessed, while the expression of BDNF-, OT- and GR-immunoreactive (ir) neurons were also examined. The results showed that early social isolation enhanced anxiety levels and resulted in a reduction in locomotion and social behaviors compared to the control. Along with these changes, isolation treatment significantly up-regulated the levels of CORT in serum, and decreased the BDNF-ir and GR-ir expression in the CA1 and CA2/3 of the hippocampus, as well as OT-ir expression in the paraventricular nucleus and supraoptic nucleus. These findings demonstrated that early social isolation down-regulated the levels of BDNF, OT and GR, which were involved in mediating the stress system to affect emotion and social behaviors.
isolation; stress; anxiety; hippocampus; female
2016-09-05 接受日期:2016-10-31
国家自然科学基金项目(31260513; 31460565); 北方民族大学研究生创新基金项目(YCX1646)
程广超(1990—), 男, 硕士研究生, 研究方向:动物行为学
*通信作者Corresponding author, E-mail:wang_jianli@163.com
10.11984/j.issn.1000-7083.201600240
Q958.12
A
1000-7083(2017)01-0039-09

