谷子BAS1基因生物信息学分析及其在干旱胁迫下的表达分析
郭莎莎,温思钰,乔亚琪,武懿茂,段杰,李红英
(1.山西农业大学农学院,山西太谷030801;2.农业部黄土高原作物基因资源与种质创制重点实验室,山西太原030031;3.山西农业大学农业生物工程研究所,山西太谷030801)
谷子BAS1基因生物信息学分析及其在干旱胁迫下的表达分析
郭莎莎1,温思钰1,乔亚琪1,武懿茂1,段杰1,李红英2,3
(1.山西农业大学农学院,山西太谷030801;2.农业部黄土高原作物基因资源与种质创制重点实验室,山西太原030031;3.山西农业大学农业生物工程研究所,山西太谷030801)
BAS1是一种过氧化物酶,广泛存在于植物中,具有清除生物体内ROS、调节细胞内信号传导和分子伴侣的功能,在盐胁迫、光氧化、干旱及低温胁迫等方面起着重要的作用。通过生物信息学分析了谷子中的8个SiBAS1基因,并与近缘种高粱中SiBAS1基因进行亲缘关系比对。结果发现,高粱和谷子的SiBAS1基因家族同源性极高;对谷子SiBAS1基因进行启动子分析,结果发现,很多与干旱胁迫相关的响应元件包括干旱响应MYB结合位点MBS、低温响应元件LTR、热响应元件HSE、真菌诱导响应元件Box-W1、乙烯响应元件ERE、赤霉素响应元件P-box、水杨酸响应元件TCA-element和脱落酸响应元件ABRE等;通过对勾勾母鸡咀(GG,耐干旱品种)和晋汾16(JF16,干旱敏感品种)的SiBAS1基因转录组表达情况的分析发现,干旱胁迫下不同品种中同一SiBAS1基因的表达水平不同,且差异较大。其结果可为深入研究SiBAS1基因与谷子抗旱性的关系提供依据,且有助于SiBAS1基因对干旱的响应机制及作用机制的后续研究。
谷子;BAS1;干旱胁迫;抗旱性
谷子(Setaria italica)古称粟,去皮即小米,是禾本科黍族狗尾草属1年生草本植物,是我国北方主要的粮食作物之一[1]。谷子在我国分布广泛,几乎全国都有种植,但目前其产区主要分布在北方各省的干旱、半干旱地区[2]。有研究表明,近50 a来,东北、华北大部、西北东部降水量明显减少,干旱化趋势非常突出[3]。由于谷子主产区降水量逐年下降,干旱逐渐成为作物产量的主要限制因素。随着人们对小米的了解逐渐加深,对小米的需求不断增加,而谷子产量却受到高温、低温、干旱等不良环境因素的极大影响,导致供给与需求之间存在很大差距。因此,研究谷子抗逆机制显得尤为重要。
植物体内的2-cys过氧化物酶被称为BAS1[4],是过氧化蛋白(Prxs)的一种。第1个被发现并被确定的Prxs是巯基特异性抗氧化蛋白thiol-specific antiorident protein(TSA),其能够保护酵母和哺乳动物的谷胱甘肽合成酶与DNA的完整性[5-6]。根据Cys残基数目和位置的不同,将Prxs分为6种亚型(PrxsⅠ~Ⅵ),这6种亚型又可分为3个亚类[7](2-Cys Prxs、非典型2-Cys Prxs和1-Cys Prxs)。其中,2-Cys Prxs具有清除生物体内ROS、调节细胞内信号传导[8-10]和分子伴侣[11-12]的功能。
2-cys过氧化物酶在生物体内普遍存在,已有研究重组大麦、大白菜、豌豆、油菜和水稻BAS1的酶学性质,结果发现,小球藻、拟南芥和大麦BAS1在盐、光氧化、干旱及低温胁迫中参与去除活性氧毒性、抗氧化防御及氧化还原信号传导,这种功能多样性与BAS1的分子组成、亚细胞分布、组织特异性和胁迫因子有关[13]。然而,有关谷子SiBAS1基因家族的研究鲜见报道,谷子抗旱基因的研究也相对较少。
本研究就谷子中SiBAS1基因进行分析,并分析勾勾母鸡咀(GG,耐干旱品种)和晋汾16(JF16,干旱敏感品种)在PEG干旱胁迫下BAS1基因的表达情况,旨在研究谷子SiBAS1基因是否参与谷子对干旱逆境的胁迫应答,为进一步弄清谷子抗旱机制打下基础。
1 材料和方法
1.1 研究材料
供试材料勾勾母鸡咀和晋汾16由山西农业大学农业生物工程研究所提供[14]。
1.2 研究方法
1.2.1 谷子BAS1基因的生物学分析利用网站Phytozome v 11.0中谷子、高粱、拟南芥、水稻、谷子基因组数据(https://phytozome.jg i.doe.gov/pz/portal. html)进行关键词搜索,进一步结合NCBI,GenBank等网站获取BAS1基因的信息,并下载整理[15]。
使用PlantCARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html/)在线分析启动子元件。使用MEGA 7.0软件中的Neibor-joining算法对下载的谷子BAS1氨基酸序列构建系统发育树。使用Multalin(http://multalin.toulouse.inra.fr/multalin/multalin.html)进行在线双序列比对。
1.2.2 干旱情况下谷子BAS1基因的表达情况分析GG和JF16在人工气候室中培养,采用营养土∶蛭石为3∶1的混合土种植,培养条件为:14 h光照28℃/10 h黑暗23℃,相对湿度为50%左右,光强为500 μmol/(m2·s)。出苗后2 d浇一次蒸馏水,培养21 d后,采用20%PEG-6000模拟干旱,处理材料0.5 h;对照用蒸馏水处理相同时间。每个处理取3株用于RNA的提取,并进行表达谱测序[14]。
2 结果与分析
2.1 谷子BAS1基因的基本信息
利用网站Phytozome v11.0中谷子、高粱、拟南芥、水稻基因组数据进行关键词搜索,结合NCBI网站获取以上4种作物的部分BAS1的氨基酸序列共27个(其中,谷子有8个,高粱有11个,拟南芥有3个,水稻有5个),并制作了亲缘关系分布图(图1)。然后取与谷子BAS1基因亲缘关系最近的其他作物氨基酸序列进行双序列比对。

按照上述方法从谷子基因组中鉴定了8个SiBAS1基因,根据与高粱BAS1基因的同源性,暂时命名为SiBAS1-1~SiBAS1-8。从图1可以观察到各基因起源与进化间的关系,所有BAS1基因被分为3组,谷子BAS1基因分布在3个不同的组中,Ⅰ组中包含SiBAS1-1,SiBAS1-2,SiBAS1-4和SiBAS1-6;Ⅱ组中包含SiBAS1-3和SiBAS1-5;Ⅲ组中包含SiBAS1-7和SiBAS1-8。在每组中还存在着平行同源性基因对。根据双序列比对图得出,SiBAS1-1基因与Sobic.004G086400.1基因,SiBAS1-2基因与Sobic.010G182966.1基因,SiBAS1-6基因与Sobic.002G398600.1基因(图2),SiBAS1-4基因与Sobic.002G398600.1基因的氨基酸序列相似性极高,也表明谷子的BAS1可能与高粱的BAS1基因同源性极高。


表1 谷子BAS1基因的基本信息
由表1可知,SiBAS1-2基因和SiBAS1-3基因在第4染色体上,SiBAS1-1基因、SiBAS1-5基因、SiBAS1-7基因和SiBAS1-8基因在第1染色体上,SiBAS1-4基因在第2染色体上,SiBAS1-6基因在第5染色体上。
谷子BAS1基因家族中不同BAS1基因的内含子数目、大小都存在差异(表1)。8个SiBAS1基因中,SiBAS1-4基因和SiBAS1-5基因均含有1个内含子,SiBAS1-3基因含2个内含子,SiBAS1-7基因和SiBAS1-8基因均含有6个内含子,SiBAS1-1基因、SiBAS1-2基因和SiBAS1-6基因均含有4个内含子。
2.2 谷子BAS1基因家族启动子元件
根据谷子的全基因组序列,选取CDS区上游3 000 bp的核苷酸序列作为启动子,用PlantCARE进行在线分析,结果发现,除了基本启动子元件TATA-box和CAAT-box外,谷子BAS1基因还含有很多与胁迫响应相关的顺式作用元件,包括脱落酸响应元件ABRE、干旱响应MYB结合位点MBS、热响应元件HSE、低温响应元件LTR、水杨酸响应元件TCA-element、光响应元件light等(表2)。

表2 启动子顺式元件个
利用PlantCARE在线分析8个谷子SiBAS1基因启动子上游3 000 bp的顺式作用元件,统计分析发现,每个基因含有至少130个调控元件,最少的是SiBAS1-5基因,含有133个顺式作用元件。调控SiBAS1-2基因的顺式作用元件最多,高达167个。在SiBAS1-4中,与病虫害胁迫相关的茉莉酸甲酯响应元件TGACG-motif多达14个,是家族成员中最多的。有7个BAS1基因家族成员包含2~9个脱落酸响应元件ABRE,其中,SiBAS1-2基因和SiBAS1-3基因均含有9个;SiBAS1-6基因没有脱落酸响应元件ABRE。BAS1家族成员包含1~5个干旱响应MYB结合位点MBS,其中,SiBAS1-3基因和SiBAS1-4基因均含有5个。7个谷子BAS1基因家族成员中都包含30个以上的光响应调控元件,其中,SiBAS1-2基因最多,高达57个。
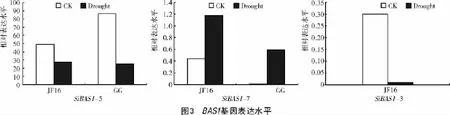
2.3 谷子BAS1基因在干旱胁迫下的表达情况
对耐干旱品种勾勾母鸡咀(GG)和干旱敏感品种晋汾16(JF16)分别进行模拟干旱胁迫处理,使2个品种的处理组(Drought)和对照组(CK)中BAS1基因进行表达,并对表达情况进行分析,结果表明,2个品种的SiBAS1-5基因在正常情况(CK)下的表达量都明显高于各自在干旱胁迫情况(Drought)下的表达量,而且耐干旱品种GG在正常情况下表达量较高,但在干旱胁迫下表达量却显著下调(图3)。
2个品种的SiBAS1-7基因在干旱胁迫情况(Drought)下的表达量都明显高于各自在正常情况(CK)下的表达量,而且JF16品种的2种情况下的基因表达水平高于GG品种2种情况下基因表达水平。耐干旱品种GG的SiBAS1-7基因在正常情况下几乎不表达,而在干旱胁迫下表达量显著上调(图3)。
干旱敏感品种JF16的SiBAS1-3基因在正常情况(CK)下的表达量显著高于其在干旱胁迫情况(Drought)下的表达量;此基因在干旱胁迫情况(Drought)下的表达量显著下降,且在干旱胁迫下几乎不表达(图3)。
3 讨论与结论
BAS1是植物抗逆的重要物质,广泛存在于植物基因组中。通过对谷子SiBAS1基因组的分析,有利于我们了解SiBAS1基因基本特征及功能,对后续研究具有重要意义。
谷子BAS1基因在谷子基因组中呈不均匀分布,集中分布在第1,2,4,6染色体上。BAS1系统发育树结果表明,谷子、高粱、拟南芥、水稻4种植物的BAS1家族可以分为3组,在每组中还存在着平行同源性基因对,其中,SiBAS1-6基因与Sobic. 002G398600.1基因的同源性最高。
通过对谷子SiBAS1基因启动子上游约3000bp进行启动子分析,发现其中含有多个与逆境相关的顺式作用元件,包括低温响应元件LTR、热响应元件HSE、真菌诱导响应元件Box-W1、干旱响应MYB结合位点MBS、乙烯响应元件ERE、赤霉素响应元件P-box、水杨酸响应元件TCA-element和脱落酸响应元件ABRE等。这些结果表明,BAS1基因可能正是通过这些顺式作用元件参与了谷子对胁迫信号传导途径的应答,在植物响应胁迫过程中发挥作用。
通过对谷子3个SiBAS1基因的表达情况分析发现,耐干旱品种GC的SiBAS1-7基因在正常情况下几乎不表达,而且在干旱胁迫下表达量显著上调;而且此基因在干旱胁迫下干旱敏感品种JF16中表达量也增加,说明该基因对干旱胁迫有响应,只是在不同品种中对干旱的响应程度不同;2个品种的SiBAS1-7基因在干旱胁迫下均高表达,是否意味着它在谷子抗旱中的重要性,还值得更详细和深入的研究。耐干旱品种GG和干旱敏感品种JF16的SiBAS1-5基因在干旱胁迫情况下表达量均下降,且耐干旱品种GC表达量下调明显,说明该基因对干旱胁迫有响应,且在2个品种中不具有表达特异性;干旱敏感品种JF16的SiBAS1-3基因在干旱胁迫情况下的表达量显著下降,表明此基因可能与干旱胁迫有关。
结合启动子顺式调控元件的预测结果分析,并未找出胁迫相关的调控元件与BAS1基因表达之间的关联。我们推测,可能有5个原因:一是同一基因在不同组织中的表达水平不同;二是SiBAS1基因的表达非常复杂,不仅会受其他外界条件的调控如光、温度等,还会受内部因素的诱导如内源植物激素的影响;三是各种逆境之间存在信号交叉,并非所有BAS1都只与干旱胁迫相关,如在拟南芥的叶片生长中,BAS1能够保护光合组织免遭氧化胁迫[16];四是在谷子的不同生育期,GG和JF16的抗旱性也有差别,如在孕穗期GG抗旱性较JF16强,但在灌浆期JF16抗旱性较GG强[14];五是SiBAS1基因家族各成员的表达模式可能不尽相同,这与SiBAS1基因参与逆境应答调控的信号途径不同有一定的关系。
综合以上分析,初步研究表明谷子BAS1家族中部分SiBAS1基因受干旱的强烈诱导,因此推断谷子中一些SiBAS1基因可能参与谷子对干旱逆境的胁迫应答。目前,还不清楚SiBAS1基因的具体功能,而且其在谷子中的作用机制也不清楚,因此,要解决这一系列的困惑,仍需对进化树中垂直同源、平行同源基因对中基因的具体功能与作用机制进行更深入的研究。
[1]李荫梅.谷子作物学[M].北京:中国农业出版社,1997.
[2]山西省农业科学院.中国谷子栽培学[M].北京:农业出版社,1987.
[3]邓振镛,王强,张强,等.中国北方气候暖干化对粮食作物的影响及应对措施[J].生态学报,2010,30(22):6278-6288.
[4]周伟辉,薛大伟,张国平.高温胁迫下水稻叶片的蛋白响应及其基因型和生育期差异[J].作物学报,2011,37(5):820-831.
[5]KIMK,KIMI H,LEE K Y,et al.The isolation and purification of a specific"protector"protein which inhibits enzyme inactivation by a thiol/Fe(Ⅲ)/O2mixed-function oxidation system[J].Journal ofBiological Chemistry,1988,263(10):4704-4711.
[6]CHANG T S,JEONG W,CHOI S Y,et al.Regulation of peroxiredoxinsⅠactivity by cdc2-mediated phosphorylation[J].Journal of Biological Chemistry,2002,227(28):25370-25376.
[7]程雷,王蕾蕾,程备久,等.玉米过氧化物还原蛋白BAS1的原核表达及其功能研究[J].中国生物工程杂志,2010,30(11):24-29.
[8]CHANG T S,CHO C S,PARK S,et al.PeroxiredoxinⅢ,a mitochondrion-specific peroxidase,regulates apoptotic signaling by mitochondria[J].Journal of Biological Chemistry,2004,279(40):41975-41984.
[9]NONN L,BERGGREN M,POWIS G.Increased expression of mitochondrial peroxiredoxin-3(thioredoxin peroxidase-2)protects cancer cells against hypoxia and drug-induced hydrogen peroxide-dependent apoptosis[J].Molecular Cancer Research,2003,1(9):682-689.
[10]PETERSONT M,LUCKHART S.A mosquito2-Cys peroxiredoxin protects against nitrosative and oxidative stresses associated with malaria parasite infection[J].Free Radical Biology and Medicine,2006,40(6):1067-1082.
[11]NOH D Y,AHN S J,LEE R A,et al.Overexpression of peroxiredoxin in human breast cancer[J].Anticancer Research,2001,21(3B):2085-2090.
[12]YANAGAWA T,ISHIKAWA T,ISHII T,et al.PeroxiredoxinⅠexpression in human thyroid tumors[J].Cancer Letters,1999,145(1/2):127-132.
[13]TRIPATHI B N,BHAT T I,DIETZ K J.Peroxiredoxins a less studied component of hydrogen peroxide detoxification in photosynthetic organisms[J].Protoplasma,2009,235(1/4):3-15.
[14]张雁明.不同谷子品种抗旱性比较及干旱相关基因表达分析[D].太谷:山西农业大学,2014.
[15]李昊阳,施杨,丁亚娜,等.杨树扩展蛋白基因家族的生物信息学分析[J].北京林业大学学报,2014,36(2):59-67.
[16]BAIER M,DIETZKJ.Protective function ofchloroplast 2-cysteine peroxiredoxin in photosynthesis:evidence from transgenic Arabidopsis[J].Plant Physiology,1999,119:1407-1414.
Bioinformatics Analysis ofBAS1Genes from Foxtail Millet(Setaria italica(L.)Beauv.)and Its Expression under Drought Stress
GUOShasha1,WENSiyu1,QIAOYaqi1,WUYimao1,DUANJie1,LI Hongying2,3
(1.College ofAgronomy,Shanxi Agricultural University,Taigu 030801,China;2.KeyLabaratoryofCrop Gene Resources and GermplamEnhancement on Loess Plateau,MinistryofAgriculture,Taiyuan 030031,China;3.Institute ofAgricultural Bioengineering,Shanxi Agricultural University,Taigu 030801,China)
BAS1 is a kind of peroxiredoxin in plant,which is widely distributed in almost every plant genome.BAS1 can remove ROS,which plays a vital role in the varies of aspects,such as the salt stress,light oxidation,drought and low temperature stresses,etc. This paper analysed eight SiBAS1 gene offoxtail millet through bioinformatics,and compared their relationship between SiBAS1 genes in sorghum.The results showed that foxtail mille was high homologous with sorghum.And analysed SiBAS1 genes promoter,and the result found that many was elements related to drought stress response including drought response MYB binding sites of MBS,lowtemperature response element LTR,thermal response element HSE,fungus induced response element Box-W1,ethylene response elements ERE, gibberellin response element P-box,salicylic acid response element TCA-element and abscisic acid response element ABRE,etc.And analysed GG(drought resistant varieties)and JF16(drought sensitive cultivars)peroxide protease gene expression,and the result found that for one SiBAS1 gene,its expression level was different in different varieties under drought stress.These results not only provide a foundation for the further study of the relationship between SiBAS1 gene and millet drought resistance,but also are helpful for further research on the response mechanismofthe SiBAS1 gene todrought.
foxtail millet;BAS1;drought stress;drought-resistance
S515
A文献标识码:1002-2481(2017)02-0151-05
10.3969/j.issn.1002-2481.2017.02.01
2016-09-13
国家自然科学基金项目(31471556);地方高校国家级大学生创新创业训练计划项目(2015082)
郭莎莎(1993-),女,山西长治人,在读本科,研究方向:作物遗传。李红英为通信作者。

