拟南芥独脚金内酯突变体叶绿素荧光特性分析
李国栋,田曼青,沈仁芳
(1.中国科学院 南京土壤研究所 土壤与农业可持续发展国家重点实验室,江苏 南京210008;2.中国科学院大学,北京 100049;3.浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安311300)
拟南芥独脚金内酯突变体叶绿素荧光特性分析
李国栋1,2,3,田曼青3,沈仁芳1
(1.中国科学院 南京土壤研究所 土壤与农业可持续发展国家重点实验室,江苏 南京210008;2.中国科学院大学,北京 100049;3.浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安311300)
独脚金内酯是新发现的起源于类胡萝卜素生物合成途径的信号分子,调控着植物生长发育中的各种生理过程。为了解独脚金内酯及其信号途径对植物光合特性的影响,以拟南芥Arabidopsis thaliana独脚金内酯合成突变体max1和信号突变体max2为材料,测定叶片的光合色素质量分数及叶绿素荧光特性。结果发现:max1突变体与max2突变体在光合荧光特性存在明显的差异。max1叶绿素质量分数较野生型并没有显著降低,但叶绿素a/b发生了变化,max1突变体叶绿素初始荧光Fo和Y(NO)显著高于野生型,但Fv/Fm,Y(Ⅱ),qP等荧光参数较野生型并没有显著变化。快速光响应曲线发现max1突变体在强光下的ETR,Y(Ⅱ)和QNP等参数低于野生型。而max2突变体叶片的叶绿素a和叶绿素b质量分数显著低于野生型(P<0.05),叶绿素荧光参数Fv/Fm,Y(Ⅱ),qP等光化学参数也显著降低,但QNP,qN等光保护参数显著升高(P<0.05)。这些结果说明独脚金内酯可能参与了调控植物光合对环境的适应,而其信号传导蛋白MAX2则可能对植物光系统的建成具有基础作用。图1表3参29
植物生理学;拟南芥;独脚金内酯;突变体;光合色素;叶绿素荧光参数
独脚金内酯(strigolactones)是一些天然的独脚金醇类化合物及人工合成类似物的总称[1]。独脚金内酯由植物根系分泌,并刺激了寄生植物种子发芽[2-3]和丛枝(AM)菌根的分枝生长[1,4]。独脚金内酯几乎存在于所有的高等植物之中,在调节植物生长发育过程中起着重要的作用。除了被鉴定为控制植物侧枝发育的关键信号物质外[5-6],独脚金内酯还在调控根部构型[7]、叶片衰老[8]以及抗旱胁迫[9-10]上起着重要的作用。另外,近年来研究发现,独脚金内酯处理能特异地促进植物叶片捕光色素蛋白相关基因的表达[11],说明了独脚金内酯也可能调节植物光系统的构成,目前,对独脚金内酯与植物光合关系的研究还较少。虽然目前独脚金内酯的生物合成及信号通路还没有被完全揭示,但部分参与其生物功能的关键基因已经被发现。其中D27,MAX1,MAX3和MAX4等蛋白酶参与了独脚金内酯的合成[12-15],而D14和MAX2等蛋白则与独脚金内酯的信号传递相关[16-18]。植物的叶绿素荧光信号能表征植物对光能的利用情况,是光合生理研究的重要探针[19]。利用调制叶绿素荧光测定仪可通过荧光诱导的方法构建植物的叶绿素荧光动力学参数,从而快速而灵敏地探测植物的光合及生理状态信息。笔者通过对拟南芥Arabidopsis thaliana独脚金内酯合成突变体max1与信号突变体max2与野生型拟南芥叶片的光合色素及叶绿素荧光特性的分析,探讨独脚金内酯对植物光合系统的影响,从而为深入了解独脚金内酯的生物功能及作用机制提供依据。
1 材料与方法
1.1 试验材料
实验材料拟南芥独脚金内酯突变体max1,max2和野生型(WT)均为哥伦比亚生态型,种子为日本东京大学浅见忠男惠赠。将种子播种在包含1/2 MS(Murashige and Skoog)盐及质量分数为1%蔗糖的固体培养基上,于黑暗下4℃春化3 d,然后转移到人工气候培养箱,生长温度为22~23℃,光照强度为120 μmol·m-2·s-1,光周期为16 h光照/8 h黑暗。培养7 d后,选择长势一致的拟南芥幼苗,转移到泥炭和珍珠岩混合基质中进行培养。在拟南芥生长30 d后进行叶绿素荧光动力学参数测定,并采集叶片测定光合色素质量分数。
1.2 光合色素质量分数测定
参照分光光度法测定植物叶片的光合色素质量分数[20]。剪取50~100 mg的拟南芥功能叶的叶片,用体积分数为95%乙醇在室温下暗处浸提叶片至完全变白(24 h)后,用UV-2600(SHIMADZU)分光光度计分别测定在664.2,648.6和470.0 nm波长的吸光度,并通过公式计算叶绿素a,叶绿素b,总叶绿素,类胡萝卜素质量分数以及叶绿素a/b。
1.3 叶绿素荧光参数的测定
选择成熟的莲座功能叶3~4片,采用德国Walz公司的Imaging-PAM叶绿素荧光仪进行叶绿素荧光诱导动力学曲线和快速光响应曲线的测定。在测定前,将拟南芥幼苗暗处理30 min。测定叶绿素荧光诱导动力学曲线时,先用弱光照射测定初始荧光(Fo),随后进行饱和脉冲光(2 800 μmol·m-2·s-1)处理,得到最大荧光(Fm),然后打开可以测量光(102 μmol·m-2·s-1),当荧光基本稳定时测定稳态荧光(Fs)。之后再进行饱和脉冲光处理,1个脉冲关闭后,得到光化光下的最大荧光(Fm′)。充分暗适应PSⅡ的最大光化学量子产量(Fv/Fm),表观电子传递速率(ETR),PSⅡ光化学能量转化的有效量子产量[Y(Ⅱ)],光化学猝灭系数(qP),非光化学猝灭系数(qN,QNP),非调节性能量耗散的量子产量[Y(NO)]等各参数数值均是在选定模式下系统自动计算生成。将经过叶绿素荧光诱导动力学后的叶片样品,立即进行快速光响应曲线的测定,将叶片连续暴露在连续光强梯度(PAR)0,9,40,75,133,210,248,319,455,577,730,800 μmol·m-2·s-1下,20 s·步-1,测定相对电子传递速率ErTR及其他荧光参数。
1.4 数据处理和统计方法
各参数值导出后,用Excel进行基本的数据统计,不同突变体之间的差异采用SPSS统计软件进行方差分析和最小显著差法(LSD)多重比较。
2 结果与分析
2.1 独脚金内酯突变体幼苗叶片光合色素质量分数
从表1可以看出:2个独脚金内酯突变体光合色素质量分数均低于野生型。其中max1突变体的叶绿素a质量分数相对于野生型降低了13%,但叶绿素b的质量分数却基本没有变化;而max2的叶绿素a,叶绿素b和总叶绿素质量分数分别较野生型降低了18%,19%和18%,差异显著(P<0.05),说明MAX2蛋白可能参与了植物叶绿素合成的调控。比较叶绿素a/b发现,max1的叶绿素a/b显著低于野生型和max2(P<0.05),虽然max2的叶绿素a和b质量分数相对于野生型均显著降低,但叶绿素a/b没有显著变化。独脚金内酯突变体叶片中类胡萝卜素质量分数也低于野生型,其中max1降低了最多,达到24%,而max2只降低了12%。因此,max1类胡萝卜素与叶绿素的比值低于野生型和max2,并与max2达到了显著性差异(P<0.05)。

表1 拟南芥独脚金内酯突变体叶片光合色素质量分数及部分比值Table 1 Content and partial ratio of photosynthetic pigments in leaves of strigolactione mutants and WT of Arabidopsis thaliana
2.2 独脚金内酯突变体幼苗叶片荧光参数比较
初始荧光Fo表示光系统Ⅱ(PSⅡ)反应中心处于完全开放时的荧光产量,最大荧光Fm表示PSⅡ反应中心处于完全关闭时的荧光产量[21]。Fv/Fm表示光合中心将吸收的光能用于光化学反应的最大效率,是表征 PSⅡ反应中心光能转化效率的关键指标[22]。Fv/Fo值表示PSⅡ潜在的光化学活性大小,反映光能吸收转化机构的完整性[21]。如表2所示,与野生型相比,max1的Fo和Fm分别较野生型增加了20%和21%(P<0.05),这种同比例上升的结果,虽然没有显著改变Fv/Fm值,但造成了Fv/Fo的显著下降。而在max2突变体中,Fm相对野生型和max1均显著降低,导致Fv/Fm显著下降。
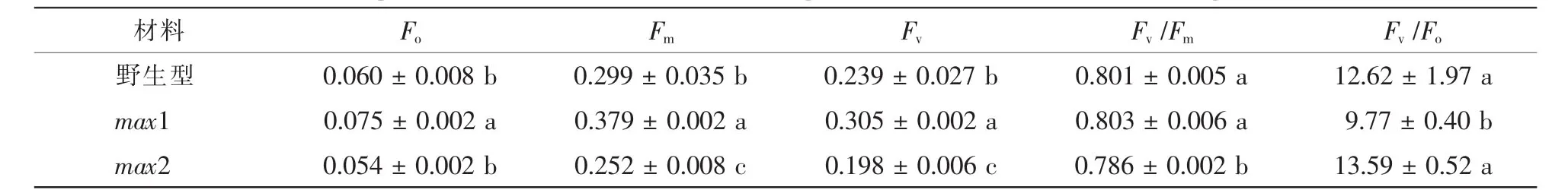
表2 拟南芥独脚金内酯突变体叶片Fv/Fm和Fv/Fo参数比较Table 2 Comparison of Fv/Fmand Fv/Fobetween strigolactione mutants and WT of Arabidopsis thaliana
进一步比较不同拟南芥中PSⅡ实际量子产量Y(Ⅱ),光化学淬灭系数qP,非光化学淬灭系数qN和QNP,非调节性能量耗散的量子产量Y(NO)以及电子传递速率ETR等荧光参数。结果如表3所示:独脚金内酯信号突变体max2的Y(Ⅱ),qP及ETR等参数较野生型降低了21%,17%和21%,均达到显著差异(P<0.05);而叶片的qN,QNP则显著升高,Y(NO)较野生型没有显著变化。而max1突变体则与max2不同,其Y(Ⅱ),ETR等较野生型略有降低,但没达到显著差异。虽然max1的qP值较对照降低,但仍然显著高于max2;而max1的qN和QNP与对照比没有显著差异,但Y(NO)值却显著高于野生型和max2(P<0.05)。

表3 拟南芥独脚金内酯突变体叶片Y(Ⅱ),qP,qN,QNP,Y(NO)和ETR参数比较Table 3 Comparison of Y(Ⅱ),qP,qN,QNP,Y(NO)and ETRbetween strigolactione mutants and WT of Arabidopsis thaliana
2.3 独脚金内酯突变体幼苗叶片快速光响应曲线
为进一步分析不同突变体叶绿素荧光参数对光强的响应,分别分析PSⅡ的有效量子产量Y(Ⅱ),光化学猝灭系数qP,非光化学猝灭系数QNP以及相对电子传递速率ErTR随光照强度变化。图1是不同拟南芥独脚金内酯突变体的快速光响应曲线。结果显示:叶片的ErTR与qNP随光照强度的增加而增加,Y(Ⅱ)与qP随光照强度的增加而减小。其中在弱光和低光强时,突变体max1的光化学荧光指标与野生型差异不大,但随着光强的增加,max1的qP和QNP均低于野生型。而max2突变体的ErTR,Y(Ⅱ)和qP等指标随着光强的增加较野生型和max1显著降低,但QNP则显著高于野生型和max1。野生型在光强达到577 μmol·m-2·s-1时ErTR达到最大值,光强继续增加到800 μmol·m-2·s-1时ErTR基本保持稳定;而max1和max2的最大ErTR值则较野生型延后,出现在更高的光强水平(730 μmol·m-2·s-1),随光强继续增加则ErTR显著降低。

图1 拟南芥独脚金内酯突变体叶片叶绿素荧光的快速光响应曲线Figure 1 Rapid light-response curve of chlorophyll fluorescence parameters in the leaves of strigolactione mutants of Arabidopsis thaliana
3 讨论
MAX1解码一个细胞色素P450单加氧酶 (Cyt P450),可以将独脚金内酯的前体物质己内酯(carlactone)水解成具活性的独脚金内酯类物质,是独脚金内酯合成中的关键步骤[23-24]。MAX2编码一个F-box蛋白,通过形成SCF(skp1-cullin-f-box)蛋白复合体,参与蛋白泛素化并介导蛋白质降解。独脚金内酯可以促进MAX2结合蛋白的降解,从而推动独脚金内酯的信号传递[25-26],而MAX2的突变体抑制了独脚金内酯信号的传递。本研究结果表明:独脚金内酯及其信号对植物的光合系统有着重要的影响。其中max1突变体的叶绿素质量分数较野生型并没有显著降低,但叶绿素a/b却发生了显著改变。叶绿素a/b的变化对植物利用不同波长的光能具有重要意义[27],突变体max1叶绿素a/b的变化说明独脚金内酯可能通过调节植物叶片光合色素的结构,从而改变对光能的俘获能力,这与在番茄Lycopersicon esculentum中发现的独脚金内酯处理能促进叶片捕光基因表达的结果是一致的[11]。不同研究均发现:独脚金内酯是重要的与环境互作的植物信号分子,比如独脚金内酯重要功能之一就是调节植物株型从而响应环境中低磷营养的胁迫[28]。本实验结果说明了独脚金内酯也可能与参与了植物光合的调节来适应环境的改变。而max2突变体的叶绿素质量分数显著低于野生型,但叶绿素a/b并没有显著变化,说明MAX2蛋白自身可能参与了植物光和色素合成的调控,同时由于阻断了独脚金内酯信号的传递,max2突变体无法通过调节独脚金内酯的信号来改变调节植物叶绿素的组成。
比较叶绿素荧光参数发现,max1和max2突变体在荧光特性上存在显著差异。max1突变体的叶绿素荧光参数与野生型相比并没有显著降低,但初始荧光(Fo)和Y(NO)值较野生型增加显著。Fo增加说明max1突变体的PSⅡ反应中心可能遭到破坏,而Y(NO)是表征光损伤的重要指标,说明max1更易受到光损伤。从max1的快速光曲线可以看出,虽然这些破坏在低的光强下可能并不影响植物的光合效率,但在高光强下max1可能更容易受到损伤。max2突变体的Fv/Fm,Y(Ⅱ)以及qP值均显著低于野生型,说明max2突变体叶片PSⅡ反应中心的光能转化效率较低,植物的光合作用潜力较小,MAX2蛋白可能对植物光系统的建成具有基础作用。另外,max2突变体具有较高的qNP,说明突变体能将过剩的光能以热的形式耗散出去,从而保护光系统免于破坏,暗示max2的光保护系统仍然健全。
独脚金内酯合成突变体max1,max3和max4等与信号突变体max2在植物发育上的差异在不同研究中均有体现。如在植物光形态建成的研究中发现,max2突变体对光形态建成不敏感,但独脚金内酯合成突变体max1,max3和max4则与野生型相一致[29],显示了max2突变体与独脚金内酯合成突变体对光信号响应的差异。在对独脚金内酯在抗旱胁迫上的作用上也发现,max2突变体的抗旱能力显著下降,但max3,max4等合成突变体的耐旱性下降并不明显[10]。说明了MAX2蛋白除了介导独脚金内酯信号的传导,还具有调控植物发育及形态建成等多方面的功能,而独脚金内酯则通过MAX2蛋白的介导从而调节植物生长发育以及对环境响应。本研究也发现,max1和max2突变体在光和色素质量分数及叶绿素荧光参数上存在显著差异。综合来看,MAX2蛋白可能对植物光系统的建成具有基础作用,而独脚金内酯则通过MAX2蛋白调控植物光合变化从而适应环境的改变。
[1] XIE Xiaonan,YONEYAMA K,YONEYAMA K.The strigolactone story[J].Annu Rev Phytopathol,2010,48(1):93 -117.
[2] COOK C E,WHICHARD L P,TURNER B,et al.Germination of witchweed (Striga lutea Lour.):isolation and properties of a potent stimulant[J].Science,1966,154(3753):1189-1190.
[3] COOK C E,WHICHARD L P,MONROE W E,et al.Germination stimulants(Ⅱ)Structure of strigol,a potent seed germination stimulant for witchweed(Striga lutea)[J].J Am Chem Soc,1972,94(17):6198-6199.
[4] AKIYAMA K,MATSUZAKI K I,HAYASHI H.Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi[J].Nature,2005,435(7043):824-827.
[5] UMEHARA M,HANADA A,YOSHIDA S,et al.Inhibition of shoot branching by new terpenoid plant hormones[J]. Nature,2008,455(7210):195-200.
[6] GOMEZ-ROLDAN V,FERMAS S,BREWER P B,et al.Strigolactone inhibition of shoot branching[J].Nature,2008, 455(7210):189-194.
[7] KAPULNIK Y,KOLTAI H.Strigolactone involvement in root development,response to abiotic stress,and interactions with the biotic soil environment[J].Plant Physiol,2014,166(2):560-569.
[8] YAMADA Y,FURUSAWA S,NAGASAKA S,et al.Strigolactone signaling regulates rice leaf senescence in response to a phosphate deficiency[J].Planta,2014,240(2):399-408.
[9] van HA C,LEYVA-GONZÁLEZ M A,OSAKABE Y,et al.Positive regulatory role of strigolactone in plant responses to drought and salt stress[J].Proc Nat Acad Sci USA,2014,111(2):851-856.
[10] BU Qingyun,LÜ Tianxiao,SHEN Hui,et al.Regulation of drought tolerance by the F-box protein MAX2 in Arabidopsis[J].Plant Physiol,2014,164(1):424-439.
[11] MAYZLISH-GATI E,LEKKALA S P,RESNICK N,et al.Strigolactones are positive regulators of light-harvesting genes in tomato[J].J Exp Bot,2010,61(11):3129-3136.
[12] LIN Hao,WANG Renxiao,QIAN Qian,et al.DWARF27,an iron-containing protein required for the biosynthesis of strigolactones,regulates rice tiller bud outgrowth[J].Plant Cell,2009,21(5):1512-1525.
[13] LAZAR G,GOODMAN H M.MAX1,a regulator of the flavonoid pathway,controls vegetative axillary bud outgrowth in Arabidopsis[J].Proc Nat Acad Sci USA,2006,103(2):472-476.
[14] BOOKER J,AULDRIDGE M,WILLS S,et al.MAX3/CCD7 is a carotenoid cleavage dioxygenase required for the synthesis of a novel plant signaling molecule[J].Curr Biol,2004,14(14):1232-1238.
[15] SOREFAN K,BOOKER J,HAUROGNÉ K,et al.MAX4 and RMS1 are orthologous dioxygenase-like genes that regulate shoot branching in Arabidopsis and pea[J].Genes Dev,2003,17(12):1469-1474.
[16] ARITE T,UMEHARA M,ISHIKAWA S,et al.d14,a strigolactone-insensitive mutant of rice,shows an accelerated outgrowth of tillers[J].Plant Cell Physiol,2009,50(8):1416-1424.
[17] NAKAMURA H,XUE Youlin,MIYAKAWA T,et al.Molecular mechanism of strigolactone perception by DWARF14[J].Nature Commun,2013,4:2613.doi:10.1038/ncomms3613.
[18] STIRNBERG P,FURNER I J,LEYSER H M O.MAX2 participates in an SCF complex which acts locally at the node to suppress shoot branching[J].Plant J,2007,50(1):80-94.
[19] BAKER N R.Chlorophyll fluorescence:a probe of photosynthesis in vivo[J].Annu Rev Plant Biol,2007,59(1):89 -113.
[20] LICHTENTHALER H K.Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[J].Methods Enzymol,1987,148(1):350-382.
[21] 张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.
ZHANG Shouren.A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].Chin Bull Bot,1999,16(4):444-448.
[22] 许大全,张玉忠,张荣铣.植物光合作用的光抑制[J].植物生理学通讯,1992,28(4):237-243.
XU Daquan,ZHANG Yuzhong,ZHANG Rongxian.Photoinhibition of photosynthesis in plants[J].Plant Physiol Commun,1992,28(4):237-243.
[23] SETO Y,SADO A,ASAMI K,et al.Carlactone is an endogenous biosynthetic precursor for strigolactones[J].Proc Nat Acad Sci U S A,2014,111(4):1640-1645.
[24] ABE S,SADO A,TANAKA K,et al.Carlactone is converted to carlactonoic acid by MAX1 in Arabidopsis and its methyl ester can directly interact with AtD14 in vitro[J].Proc Nat Acad Sci USA,2014,111(50):18084-18089.
[25] ZHOU Feng,LIN Qibing,ZHU Lihong,et al.D14-SCFD3-dependent degradation of D53 regulates strigolactone signalling[J].Nature,2013,504(7480):406-410.
[26] WANG Yuan,SUN Shiyong,ZHU Wenjiao,et al.Strigolactone/MAX2-induced degradation of brassinosteroid transcriptional effector BES1 regulates shoot branching[J].Dev Cell,2013,27(6):681-688.
[27] DALE M P,CAUSTON D R.Use of the chlorophyll a/b ratio as a bioassay for the light environment of a plant[J]. Funct Ecol,1992,6(2):190-196.
[28] YONEYAMA K,XIE Xiaonan,KISUGI T,et al.Nitrogen and phosphorus fertilization negatively affects strigolactone production and exudation in sorghum[J].Planta,2013,238(5):885-894.
[29] SHEN Hui,ZHU Ling,BU Qingyun,et al.MAX2 affects multiple hormones to promote photomorphogenesis[J].Mol Plant,2012,5(3):750-762.
Analysis of chlorophyll fluorescence parameters in leaves of strigolactone mutants of Arabidopsis thaliana
LI Guodong1,2,3,TIAN Manqing3,SHEN Renfang1
(1.State Key Laboratory of Soil and Sustainable Agriculture,Institute of Soil Science,Chinese Academy of Sciences, Nanjing 210008,Jiangsu,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300, Zhejiang,China)
Strigolactones are a class of carotenoid-derived compounds and play as novel signaling molecules to regulate various processes of growth and development in plant.For understanding the roles of strigolactone and its signaling protein in plant photosynthesis,we measured the contents of photosynthetic pigments and chlorophyll fluorescence parameters in the leaves of strigolactone biosynthesis mutant max1,strigolactone insensitive mutants max2 and wild type of Arabidopsis thaliana,and the results showed that features of photosynthetic fluorescence are obvious differences in max1 and max2 mutants.The contents of chlorophyll and values of photochemical-related parameters weren’t significantly decreased in max1 mutant,but ratio of content of chlorophyll a to chlorophyll b was reduced and the value of minimal fluorescence (Fo)and Y(NO)were increased than WT plant.Furthermore,rapid light-response curve of PSⅡchlorophyll fluorescence parameters showed that the value of electron transport rate through PSⅡ(ETR),Y(Ⅱ)and QNPin max1 mutant is lower than WT under intensive light.However,in max2 mutant,the contents of chlorophyll and values of photochemical-related param-eters including maximum quantum efficiency of PSⅡphotochemistry (Fv/Fm),actual photochemical rate of PSⅡ[Y(Ⅱ)]and photochemical dissipation(qP)are significantly lower than WT(P<0.05),while the values of photoprotection-related parameters,such as nonphotochemical quenching(QNP)and non-photochemical dissipation(qN),are significantly higher than WT(P<0.05).These results demonstrated that strigolactone are possibly involved in modulating photosynthesis adaptability in response to environmental cues,and MAX2 protein has specific roles in plant photosystem and photosynthesis that different with strigolactone,which possibly participates in regulation of structure of photosystem of plant.[Ch,1 fig.3 tab.29 ref.]
plant physiology;Arabidopsis thaliana;strigolactone;mutant;photosynthetic pigment;chlorophyll fluorescence parameters
S718.3;Q945.1
A
2095-0756(2017)01-0036-06
2016-03-15;
2016-04-22
浙江省重中之重林学一级学科开放基金资助项目(KF201307)
李国栋,从事植物生理研究。E-mail:gdli_p@163.com。通信作者:沈仁芳,教授,博士生导师,从事植物营养学等研究。E-mail:rfshen@issas.ac.cn
浙 江 农 林 大 学 学 报,2017,34(1):42-49
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2017.01.007

