多不饱和脂肪酸结构酯酶法合成工艺的研究
刘爽,杨洋,聂开立,王萌,邓利
1.开封高级中学,开封 475003
2.北京化工大学生命科学与技术学院,北京 100029
3.厦门北化生物产业研究院有限公司,厦门 361026
多不饱和脂肪酸结构酯酶法合成工艺的研究
刘爽1,杨洋2,聂开立3,王萌2,邓利2
1.开封高级中学,开封 475003
2.北京化工大学生命科学与技术学院,北京 100029
3.厦门北化生物产业研究院有限公司,厦门 361026
运用低温溶剂结晶法富集藻油中多不饱和脂肪酸,最佳结晶条件为-20℃静置结晶72h,丙酮溶剂与藻油的体积质量比30∶1(v/wt, mL/g)。在此条件下,藻油sn-2位的脂肪酸组成中PUFA含量从74.8%提高到92.2%。以富集后的藻油和癸酸为底物,合成富含PUFA的结构酯,优化了酸解反应条件:以脂肪酶Ls-20为催化剂,以正己烷为反应介质,底物藻油与癸酸的摩尔比1∶10,酶用量10%(占底物藻油的质量百分比),氮气保护,40℃,180rpm反应25h。利用低温溶剂结晶法分离纯化酸解产物,在丙酮与油脂的体积质量比1.6∶1(v/wt, mL/g),-20℃下结晶24h,结构酯回收率达到78.7%。
多不饱和脂肪酸结构酯;脂肪酶;酸解反应;低温溶剂结晶;结构酯
多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)是主碳链上有多个不饱和键的脂肪酸,主要来源于深海鱼和微藻。以二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳五烯酸(docosapentaenoic acid,DPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)等PUFA为主要营养成分的医药保健产品备受消费者关注[1-2]。研究表明,PUFA在预防和改善心血管疾病、抑制肿瘤生长、预防老年痴呆、促进视力和脑神经发育等方面具有重要的生理活性和广阔的应用前景[3-4]。
目前,市场上含有PUFA的保健品主要有脂肪酸型、乙酯型和甘油酯型三种形式。研究显示,甘油酯型的PUFA生物利用度最高[5]。但是多不饱和脂肪酸甘油酯因碳链较长而携带的能量多,不适于减肥者和运动员。此外,高不饱和度的碳链容易氧化,会产生过多自由基。因此,通过化学催化或酶催化改变甘油酯中的脂肪酸组成(脂肪酸种类及含量)和脂肪酸位置分布所得到的人工设计合成的结构酯,不仅能够保留其营养保健作用,而且能最大限度地降低脂质对人体的副作用。国内关于多不饱和脂肪酸结构酯的文献较少,主要利用鱼油作为PUFA来源,由于鱼油的PUFA含量有限,产物结构酯中PUFA含量不高[6-7]。Senanayake等[8-9]利用月见草油、琉璃苣油、海兽油等富含PUFA油脂合成多不饱和脂肪酸结构酯,但存在工艺复杂、成本高的缺点。
利用脂肪酶催化酸解反应合成结构酯的工艺相对简单,原料来源更广泛,生产成本更低,是最具工业化前景的油脂改性工艺。采用笔者课题组开发的脂肪酶Ls-20作为催化剂,在成本上较商品化脂肪酶有更显著的优势。作为PUFA的两大来源,藻油相对于鱼油有诸多优势,如PUFA含量较高、污染较小、成分简单、易人工培养等。
采用低温溶剂结晶法富集藻油中的多不饱和脂肪酸甘油酯,考察了结晶时间、油与溶剂比例等对结晶效果的影响,并对影响脂肪酶催化酸解反应的条件进行了优化,最后比较了不同分离方法对产品的纯化效果,为开发新型结构酯的合成工艺及微藻资源的高值利用提供依据。
1 实验部分
1.1 原料与试剂
藻油由天津微藻公司提供;脂肪酶Novo435、RMIM、TLIM,诺维信公司;脂肪酶Ls-20,北京凯泰新世纪公司;分子筛,国药集团化学试剂有限公司;十七烷酸甲酯,Sigma公司;其他化学试剂均为分析纯。
1.2 仪器
气相色谱仪,GC-2012,日本岛津;色谱柱,DB-wax 30×0.53×1,美国Agilent;TLC-FID,MK-65,日本Iatron Laboratories;高速台式离心机,美国Beckman;超低温冰箱,DW-86W100,青岛海尔特种电器公司;RE52-99型旋转蒸发器,上海亚荣生化仪器厂;BP211D电子天平,德国Sartorius。
1.3 甘油酯分析
棒状薄层氢离子火焰检测器色谱仪(TLC-FID)检测藻油甘油酯组成。展开剂为V石油醚∶V乙醚∶V98%甲酸=70∶30∶1,空气流量2L/min,氢气流量160mL/min。
1.4 脂肪酸组成检测
气相色谱分析甘油酯脂肪酸的组成,脂肪酸甲酯化方法依据国标方法[10]。DB-WAX色谱柱,30m×0.53mm,膜厚1μm,载气为氮气,氢火焰离子化检测器。初始温度50℃,保留时间1min;以10℃/min的速率升温到150℃,保留2min;然后以4℃/min的速率升温到228℃,保留37min。利用十七烷酸甲酯作为内标分析油脂中脂肪酸的相对含量。
1.5 脂肪酸位置分析
甘油酯sn-2位脂肪酸分析参照国标方法[11],略有改动,以反应混合产物直接作为水解底物,并延长反应时间至5min。sn-1/3位脂肪酸组成分析根据Angers等[12]的报道。
1.6 脂肪酶催化酸解反应
以正己烷为溶剂,在50mL锥形瓶中加入甘油酯、癸酸和脂肪酶,转速180rpm,恒温振荡反应。间隔12h取样分析。
1.7 低温结晶
将藻油或反应液溶解于一定量的丙酮中,-20℃下静置冷藏,利用布氏漏斗和减压抽滤瓶分离固相和液相,旋转蒸发液相中的丙酮,称重。
纯化过程中液相油脂回收率R1(%),PUFA(DPA、DHA)回收率R2(%),棕榈酸回收率R3(%),甘油酯的回收率R4(%)的计算公式如下。

式(1)~(4)中,m0、m1、m2、m3分别为原料质量、液相质量、回收的甘油酯质量和酸解反应液中甘油酯质量,mg;ρ0、ρ1、ρ2、ρ3分别为原料PUFA(DPA、DHA)含量、液相中PUFA(DPA、DHA)含量、液相棕榈酸含量和原料棕榈酸含量,%。
2 结果与讨论
2.1 PUFA的富集
2.1.1 结晶条件优化
富集多不饱和脂肪酸的方法很多,但大多数方法会改变甘油酯结构,且结构酯含量不高,因此本研究采用低温溶剂结晶法分级富集藻油中的PUFA。如图1所示,随着溶剂比例增加,油脂的溶解度提高,去结晶后的液相中油脂的PUFA(DHA和DPA,未见EPA)回收率增加,但是棕榈酸的回收率和回收率增幅要低得多。在溶剂与藻油比例为30mL/g时富集效果不再提高,此时DHA回收率达73%,DPA回收率为66%,棕榈酸回收率为25%。通过低温溶剂结晶法分级富集藻油中的PUFA,获得与Morales-Medina等[13]利用同样方法富集沙丁鱼油中的PUFA相似的效果。
结晶时间对液相中油脂及油脂中的脂肪酸的回收也有一定的影响(图2)。液相中油脂的各主要脂肪酸的结晶状态随时间动态变化,液相中油脂中PUFA的回收率先提高后降低,液相中油脂的回收率与液相油脂中的棕榈酸的回收率随时间的变化趋势一致,缓慢增加后缓慢降低。结晶72h时液相中油脂回收率和油脂中PUFA回收率最高,而结晶时间大于72h,液相中油脂的PUFA回收率降低。因而将低温溶剂结晶时间确定为72h。
2.1.2 结晶对甘油酯及sn-2位脂肪酸的影响
结晶对液相油脂中和油脂中sn-2位脂肪酸的影响如图3所示,在不计其他少量饱和脂肪酸情况下,藻油结晶前后液相油脂中脂肪酸组成发生显著变化。PUFA 由53.9%提高到80.9%,棕榈酸则由46.1%减少至19.1%;sn-2位上的脂肪酸组成PUFA 从74.8%上升至92.2%,棕榈酸从25.2%降低至7.8%。由此可见,低温溶剂结晶富集法获得了液相油脂中sn-2位富含PUFA的甘油酯。
2.2 脂肪酶催化合成结构酯的条件优化
2.2.1 脂肪酶种类
选择Novo435、RMIM、TLIM和Ls-20四种脂肪酶作为考察对象。Novo435不具有位置专一性和链长专一性[14],Ls-20是具有sn-1/3位选择性的游离脂肪酶[15],RMIM、TLIM均为具有sn-1/3位置专一性的固定化脂肪酶。
分析表明(图4),富含PUFA的原料藻油中不含有癸酸,而酸解产物中均不同程度的并入一定量的癸酸。选择并入一定量的癸酸是由于其在反应条件下呈液态,比棕榈酸对心血管等更具生理功效等。从癸酸含量分析可知,Ls-20和RMIM的催化能力大于Novo435和TLIM。Ls-20催化酸解产物结构酯中癸酸的含量为36.8%,能有效置换原甘油酯中的饱和脂肪酸棕榈酸,棕榈酸在甘油酯中的含量从13.4%降低至2.4%。由于Ls-20和RMIM的催化能力相当,综合考虑催化效果和催化剂成本,选择Ls-20作为催化剂。
2.2.2 反应时间
反应时间对酸解合成结构酯非常重要。反应时间过短,结构酯产率较低,反应时间过长,会发生酰基转移。根据癸酸并入甘油酯和甘油酯sn-2位和sn-1/3位的相对量变化情况可以决定最佳的反应时间。如图5所示,癸酸并入甘油酯sn-1/3位的量,在反应25h后达到平衡,癸酸并入甘油酯和甘油酯sn-2的相对量增长缓慢。研究目的是合成sn-1/3位富含癸酸sn-2位富含PUFA的结构酯,因此要求sn-1/3位较多地加入癸酸,而sn-2位较多地保留PUFA。因此,选择25h为最佳的反应时间。
2.2.3 底物摩尔比
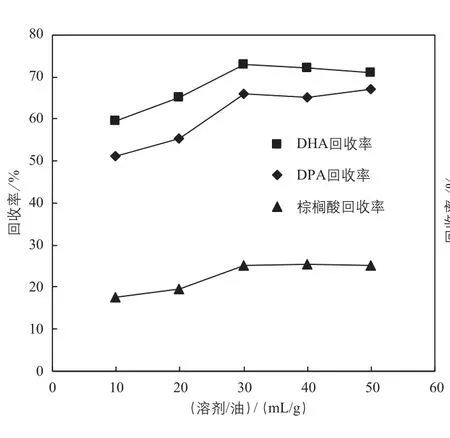
图1 溶剂与藻油的比例对液相中油脂的主要脂肪酸回收率的影响

图2 结晶时间对液相中油脂的PUFA和棕榈酸回收率的影响
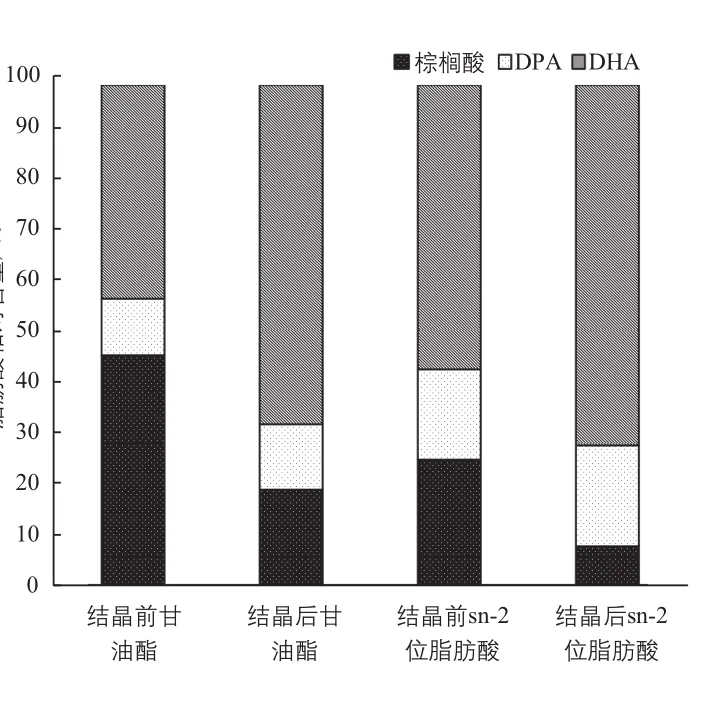
图3 结晶对甘油酯及其sn-2位脂肪酸的影响
目标结构酯理论上含有2分子癸酸和1分子PUFA,癸酸在甘油酯中相对质量比为50%左右最接近结构酯的脂肪酸组成。反应系统中癸酸过量,有利于平衡向生成目标产物的方向进行。Mu等[16]提出高的脂肪酸/甘油酯比例可以缩短反应时间,避免酰基转移。但是在过高的脂肪酸/甘油酯比例下,反应初期脂肪酸会酸化微水环境而抑制脂肪酶的活力[17]。在不影响酶活性的前提下,可以尽量提高癸酸与甘油酯的比例,促进结构酯合成。考虑到脂肪酸过多,还会增加后期的分离难度。因此,本研究选择富含PUFA的甘油酯与癸酸的摩尔比1/10为酸解反应条件(图6)。
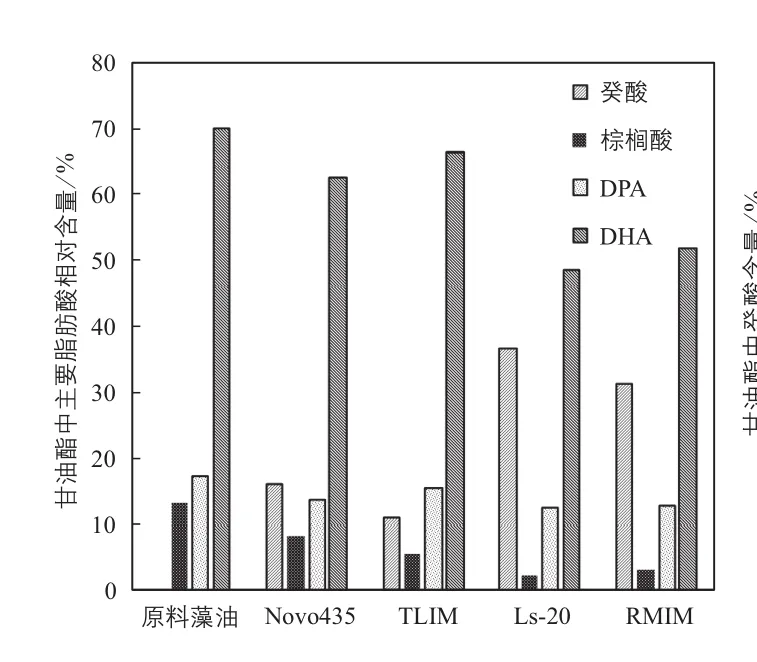
图4 不同脂肪酶催化对甘油酯脂肪酸组成的影响
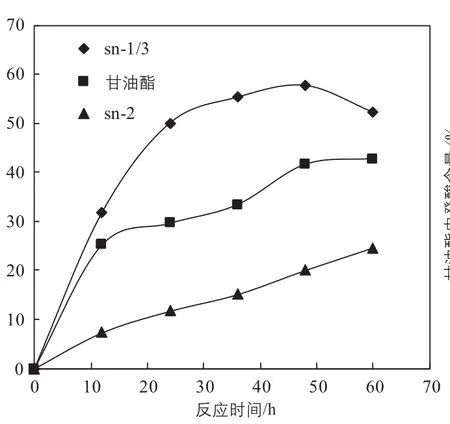
图5 酸解反应中癸酸在甘油酯、甘油酯的sn-2位和sn-1/3位中相对含量的变化

图6 底物摩尔比对酸解过程的影响
2.2.4 酶用量
如图7所示,随着脂肪酶用量的增加,产物甘油酯中癸酸相对含量增加。虽然从反应初始速率来看,8%和10%的酶用量对反应速率的影响几乎相同,但在反应12h后,10%酶用量的催化效果略好于8%的催化效果。虽然增加酶用量可以提高反应速率,但研究表明,过高的酶用量会增加酰基转移,不利于结构酯的生成[18]。考虑到需要避免酰基转移的发生及降低生产成本,本研究选择10%的酶用量为酸解条件。
2.2.5 温度
酶催化过程中,反应温度升高可以促进反应向正反应方向进行,而且高温可以增加溶剂溶解度和降低黏度,有利于癸酸在甘油酯中含量的提高。研究表明,45℃时能够获得更接近于理想的癸酸的相对质量,但是温度过高容易造成酶的失活和增加酰基转移[16]。温度过高还会显著影响各种植物油脂的氧化过程,尤其是含有n-3型多不饱和脂肪酸的油脂。综上分析,选择40℃为反应温度。
基于以上结果确定以正己烷为溶剂,40℃,富含PUFA的甘油酯与癸酸摩尔比为1/10,脂肪酶Ls-20用量10%,氮气保护,180rpm摇床反应,反应时间25h为优化的反应条件(图8)。
2.2.6 酸解反应产物组成分析
对酸解反应的产物组成进行分析(见图9),产物结构酯sn-2位脂肪酸的组成中PUFA含量占78.1%,sn-1/3位脂肪酸的组成中癸酸占51%。合成了sn-1/3位富含癸酸、sn-2位富含PUFA的结构酯。
2.3 产物分离
选用碱中和法、液-液萃取法和低温溶剂结晶法分离酸解产物,对比三种分离方法的分离效果(表1),低温溶剂结晶法液相回收的油脂中结构酯含量为89%,游离脂肪酸含量为11%,液相中结构酯回收率为78.7%。综合考虑结构酯回收率和结构酯纯度,选择低温溶剂结晶法分级酸解产物。

图7 酶用量对酸解反应的影响

图8 温度对酸解反应的影响
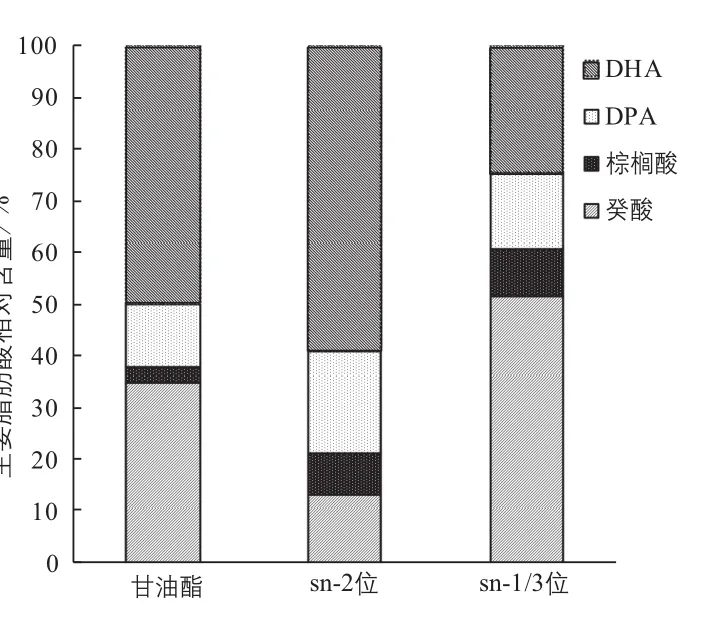
图9 酸解反应产物脂肪酸组成分析

表1 三种分离方法效果的比较
3 结 论
采用低温溶剂结晶法直接富集含有PUFA的天然油脂,得到富含PUFA的液体相中的甘油酯,不仅简化了富集步骤,而且得到sn-2位上富含PUFA的甘油酯。
以富含PUFA的甘油酯和癸酸为反应底物进行脂肪酶催化的酸解反应,癸酸更容易置换甘油骨架上sn-1/3位上的脂肪酸,有利于合成sn-1/3位富含癸酸和sn-2位富含PUFA的结构酯。
低温溶剂结晶法不仅工艺简单,还有利于加工中的PUFA稳定。综合考虑产物结构酯回收率和纯度,低温溶剂结晶法最适合分级酸解产物。
[1] 郝颖,汪之和. EPA,DHA 的营养功能及其产品安全性分析[J]. 现代食品科技,2006,22(3):180-183.
[2] 王红梅,刘晓岚,张轶华. 气相色谱法测定鱼油保健品中EPA和DHA[J]. 中国保健营养,2014,2:722.
[3] 李湛. EPA DHA对体内脂质代谢影响的研究进展[J]. 生物技术世界,2015,1:117-118.
[4] MA X Y,JIANG Z Y,LAI C Q. Signif cance of increasing n-3 PUFA content in pork on human health[J]. Critical Reviews in Food Science and Nutrition,2016,55(5):858-870
[5] DYERBERG J,MADSEN P,MØLLER J M,et al. Bioavailability of marine n-3 fatty acid formulations[J]. Prostaglandins,Leukotrienes and Essential Fatty Acids,2010,83(3):137-141.
[6] XU X,BALCHEN S,JONSSON G,et al. Production of structured lipids by lipase-catalyzed interesterification in a flat membrane reactor[J]. J Am Oil Chem Soc,2000,77(10):1035-1041.
[7] 杨春芳,王永华,杨博. 酶法催化金枪鱼油酸解合成结构酯[J]. 农业机械,2011,35:36-39.
[8] SENANAYAKE S P J N,SHAHIDI F. Enzymatic incorporation of docosahexaenoic acid into borage oil[J]. J Am Oil Chem Soc,1999,76(9):1009-1015.
[9] SENANAYAKE S P J N,SHAHIDI F. Incorporation of docosahexaenoic acid (DHA) into evening primrose (Oenothera biennis L.) oil via lipase-catalyzed transesterification[J]. Food Chem,2004,85(4):489-496.
[10] 国家粮食储备局西安优质科学研究设计院.动植物油脂脂肪酸甲酯制备:GB/T 17376—2008[S]. 北京:中国标准出版社,2008.
[11] 国家粮食局科学研究院. 动植物油脂甘三酯2位脂肪酸组分的测定:GB/T 24894—2010[S].北京:中国标准出版社,2010.
[12] ANGERS P,ARUL J. A simple method for regiospecif c analysis of triacylglycerols by gas chromatography[J]. J Am Oil Chem Soc,1999,76(4):481-484.
[13] MORALES-MEDINA R,LEÓN G D,MUNIO M,et al. Mass transfer modeling of sardine oil polyunsaturated fatty acid (PUFA)concentration by low temperature crystallization[J]. Journal of FoodEngineering,2016,183:16-23.
[14] LEE K T,AKOH C C. Characterization of enzymatically synthesized structured lipids containing eicosapentaenoic,docosahexaenoic,and caprylic acids[J]. Journal of Oil & Fat Industries,1998,75(4):495-499.
[15] YANG T,XU X,HE C,et al. Lipase-catalyzed modif cation of lard to produce human milk fat subsititutes[J]. Food Chem,2003,80(4):473-481.
[16] MU H,XU X,HØY C E. Production of specific-structured triacylglycerols by lipase-catalyzed interesterif cation in a laboratoryscale continuous reactor[J]. J Am Oil Chem Soc,1998,75(12):1187-1193.
[17] KUO S J,PARKIN K L. Substrate preferences for lipase-mediated acyl-exchange reactions with butteroil are concentrationdependent[J]. J Am Oil Chem Soc,1993,70(4):393-399.
[18] XU X. Enzymatic production of structured lipids:process reactions and acyl migration[J]. International News on Fats,Oils and Related Materials,2000,11(10):1121-1129.
Study on enzymatic synthesis process of polyunsaturated fatty acid structured esters
LIU Shuang1,YANG Yang2,NIE Kaili3,WANG Meng2,DENG Li2
1. Kaifeng High School, Kaifeng 475003, China
2. College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China
3. Amoy-BUCT Industrial of Bio-technovation Institute, Xiamen 361026, China
Using low temperature solvent crystallization to enrich polyunsaturated fatty acids from algae oil and the optimal crystallization conditions were acetone vs algae oil ratio 30:1(v/wt, mL/g), -20℃ and 72h. The content of PUFA in the sn-2 position fatty acid of algae oil was increased from 74.8% to 92.2% under the optimal conditions. Structured lipid with enriched PUFA was synthesized by utilizing the extracted algae oil and capric acid as substrates. The optimized conditions for acidolysis reaction were lipase Ls-20 as biocatalyst, hexane as reaction medium, algae oil vs capric acid ratio 1:10, nitrogen protection, 40℃, 180rpm and 25h. Employing low temperature solvent crystallization to purify the products, recovery rate of structured esters reached 78.7% under the conditions of acetone vs modif ed algae oil ratio 1.6∶1(v/wt, mL/g), -20℃ and 24h.
polyunsaturated fatty acid esters; lipase; acidolysis reaction; low temperature solvent crystallization; structured esters
10.3969/j.issn.1674-0319.2017.01.017
邓利,教授。主要研究方向为功能性油脂加工、生物基化学品等。E-mail:dengli@mail.buct.edu.cn
国家自然科学基金(21476017),北京化工大学学科建设项目基金(XK1537)