枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能、血常规指标、血清生化指标及免疫球蛋白含量的影响
郭军蕊 董晓芳佟建明
(中国农业科学院北京畜牧兽医研究所,北京 100193)
枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能、血常规指标、血清生化指标及
免疫球蛋白含量的影响
郭军蕊 董晓芳∗佟建明
(中国农业科学院北京畜牧兽医研究所,北京 100193)
本试验旨在研究枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能、血常规指标、血清生化指标及免疫球蛋白含量的影响。选用27周龄健康的海兰褐壳蛋鸡360只,随机分为5个组,每个组6个重复,每个重复12只鸡。对照组(1组)饲喂基础饲粮,试验组(2~5组)分别在基础饲粮中添加1.0×105、1.0×106、1.0×107和1.0×108CFU/g枯草芽孢杆菌CGMCC 1.921。试验期24周。结果表明:各组产蛋率、采食量、蛋重、只产蛋量及死淘率均无显著差异(P>0.05),但试验2、4、5组料蛋比显著低于对照组(P<0.05);饲粮添加枯草芽孢杆菌CGMCC 1.921显著升高了血清葡萄糖含量(第2、3、12、16、20周)(P<0.05),显著降低了血清尿素含量(第2、3、8、12周)(P<0.05);饲粮添加枯草芽孢杆菌CGMCC 1.921显著提高了血液白细胞(第1、3、4、8、12、16、20、24周)和淋巴细胞数目(第2、3、4、8、12、16、20、24周)(P<0.05),显著升高了血清免疫球蛋白G(第1、4周)和免疫球蛋白M含量(第2、4、8、16周)(P<0.05)。综上所述,饲粮中添加枯草芽孢杆菌CGMCC 1.921降低了料蛋比,对血清葡萄糖、尿素含量和血常规指标指标有一定改善作用,且在一定程度上促进了蛋鸡免疫力的提升。
蛋鸡;枯草芽孢杆菌;生产性能;血常规指标;血清生化指标;免疫球蛋白
近些年来,微生物饲料添加剂在动物生产中的应用越来越广泛。乳酸菌是目前认为应用最早,为生产者、养殖者所认可的一种益生菌,而芽孢杆菌因其在高温、酸性环境等不利条件下具有较高的稳定性[1]也逐渐受到人们的青睐。其中,枯草芽孢杆菌已于1999年被农业部列入《允许使用的饲料添加剂品种目录》。研究表明,在动物饲粮中添加枯草芽孢杆菌,可以提高肠道蛋白酶、淀粉酶等消化酶的活性[2],改善肠道结构[3],提高营养物质利用率[4],促进动物的生长发育[5-6];抑制病原菌定植[7],增强机体抗病能力[8];减少有害物质的排放,改善养殖环境[9-10]等。但关于枯草芽孢杆菌对产蛋鸡的影响未见有进行长期连续性的观察。本试验旨在研究饲粮中添加不同水平的枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能、血常规指标、血清生化指标及免疫球蛋白含量的影响,为其在蛋鸡饲粮中的应用提供理论参考依据。
1 材料与方法
1.1 试验菌种
试验选用的枯草芽孢杆菌CGMCC 1.921菌种购自中国普通微生物菌种保藏中心,由沧州华雨药业有限公司生产制备,含量为 1.105× 1010CFU/g。
1.2 试验动物与试验设计
选用27周龄健康的海兰褐壳蛋鸡360只,随机分为5组,每组6个重复,每个重复12只鸡。1组为对照组,饲喂不添加枯草芽孢杆菌CGMCC 1.921的基础饲粮,试验2~5组在基础饲粮中分别添加1.0×105、1.0×106、1.0×107和1.0×108CFU/g枯草芽孢杆菌CGMCC 1.921。试验期24周。基础饲粮参照NRC(1994)蛋鸡营养需要配制,其组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.3 饲养管理
采用 2层笼养,每个重复由相邻 2笼组成(80 cm×60 cm×50 cm),每笼6只鸡。每日饲喂3次,自由采食;乳头式饮水器,自由饮水。采用16 h光照(06:00—22:00),自动控温、供暖、通风。
1.4 测定指标及方法
1.4.1 生产性能
试验期间,以重复为单位每天记录产蛋数、蛋重、死淘鸡只数,每周结料,称取并记录剩余料重,计算产蛋率、采食量、蛋重、料蛋比、只产蛋量和死淘率。
1.4.2 血清生化指标测定
试验开始前(第0周)及试验第 1、2、3、4、8、12、16、20、24周,以重复为单位随机选取4只鸡,采血前禁食12 h,自由饮水。通过翅下静脉采集血液于普通真空采血管中,静置待有少量血清析出后,2 000 r/min离心10 min,取上清液于EP管中待测。用日本东芝TBA-120FR全自动生化分析仪进行血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及总蛋白(TP)、白蛋白(ALB)、总胆红素(TBIL)、葡萄糖(GLU)、尿素(UREA)、尿酸(UA)、肌酐(CREA)、甘油三酯(TG)和胆固醇(CHOL)含量的测定。
1.4.3 血常规指标测定
试验开始前(第0周)及试验第 1、2、3、4、8、12、16、20、24周,以重复为单位随机选取4只鸡,采血前禁食12 h,自由饮水。通过翅下静脉采集血液分别于5 mL的乙二胺四乙酸(EDTA)抗凝真空采血管和2 mL柠檬酸钠抗凝真空采血管,轻轻混匀。采用电阻抗法,由江西特康全自动三分群血细胞分析仪(TEK-Ⅱmini)进行白细胞(WBC)、淋巴细胞(LYM)、中间细胞(MID)、中性粒细胞(NEU)、红细胞(RBC)、血小板(PLT)数目及红细胞压积(HCT)和血红蛋白(HGB)含量测定;采用魏氏法,由北京普利生XC-40B全自动RBC沉降率测定仪进行红细胞沉降率(ESR)的测定。
1.4.4 血清免疫球蛋白含量的测定
采样方法同1.4.2。血清中免疫球蛋白 A(IgA)、免疫球蛋白 G(IgG)、免疫球蛋白 M(IgM)含量采用双抗体夹心酶联免疫吸附法(ELISA),按照上海朗顿生物科技有限公司提供的鸡免疫球蛋白(IgA、IgG、IgM)酶联免疫吸附检测试剂盒进行测定。
1.5 数据统计与分析
试验数据采用SPSS 19.0进行统计分析。采用单因素方差分析(one-way ANOVA)和最小显著差数(LSD)法进行多重比较,显著水平设为P<0.05,试验数据表示为平均值±标准差。
2 结果与分析
2.1 枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能的影响
由表2可知,饲粮中添加枯草芽孢杆菌CGMCC 1.921对第1~24周产蛋率、蛋重、采食量、只产蛋量以及死淘率均无显著影响(P>0.05);但试验2、4、5组的料蛋比显著低于对照组(P<0.05),试验3组料蛋比与其他各组之间无显著差异(P>0.05)。
2.2 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清生化指标的影响
由表 3可知,试验 2、5组(第 1周)的血清ALT活性显著高于对照组(P<0.05),而各试验组(第 24周)血清 ALT活性有降低趋势(P=0.072);对于血清AST活性,仅试验3(第2周)、4(第8周)、5组(第3、20周)显著高于对照组(P<0.05)。

表2 枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能的影响Table 2 Effects ofBacillus subtilisCGMCC 1.921 on performance of laying hens

表3 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清ALT和AST活性的影响Table 3 Effects ofBacillus subtilisCGMCC 1.921 on serum ALT and AST activities of laying hens U/L
由表4可知,试验5组(第3周)的血清TP和GLB含量显著高于其他各组(P<0.05),试验5组(第2周)血清ALB含量显著高于对照组和试验3组(P<0.05),试验2组(第2周)血清GLB含量显著高于对照组和试验3、5组(P<0.05)。试验2组(第2周)血清白蛋白/球蛋白(A/G)显著低于对照组和试验5组(P<0.05),试验5组(第3周)血清A/G显著低于其他各组(P<0.05)。

表4 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清TP、ALB、GLB含量及A/G的影响Table 4 Effects ofBacillus subtilisCGMCC 1.921 on serum TP,ALB,GLB content and A/G of laying hens
由表5可知,对于血清CREA含量,试验5组(第16周)显著高于对照组和试验 2、3组(P<0.05),试验2(第 0、8周)、3(第 0周)、4(第 1、2周)、5组(第1周)显著低于对照组(P<0.05)。对于血清TBIL含量,试验5组(第1周)显著高于其他各组(P<0.05),而其他各组(第3周)显著低于对照组(P<0.05)。

表5 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清CREA及TBIL含量的影响Table 5 Effects ofBacillus subtilisCGMCC 1.921 on serum CREA and TBIL contents of laying hens μmol/L
由表6可知,对于血清UREA含量,试验2、3、5组(第1周)显著高于对照组(P<0.05),而试验2(第8、12周)、4(第 3、12周)、5组(第 2、3、12周)显著低于对照组(P<0.05);对于血清UA含量,试验2、5组(第20周)显著低于对照组和试验3组(P<0.05)。
由表7可知,对于血清GLU含量,试验3(第1、8周)、4(第8周)、5组(第1、8周)显著低于对照组(P<0.05),试验 2(第 12周)、3(第 2、3、20周)、4(第 3、12、16周)、5组(第 2、3、12、16、20周)显著高于对照组(P<0.05)。
其他时间点,各组间血清ALT、AST活性及TP、ALB、GLB、TBIL、CREA、UREA、UA含量和A/G(数据未列出)均无显著差异(P>0.05)。饲粮中添加枯草芽孢杆菌 CGMCC 1.921对血清CHOL和TG含量(数据未列出)无显著影响(P>0.05)。
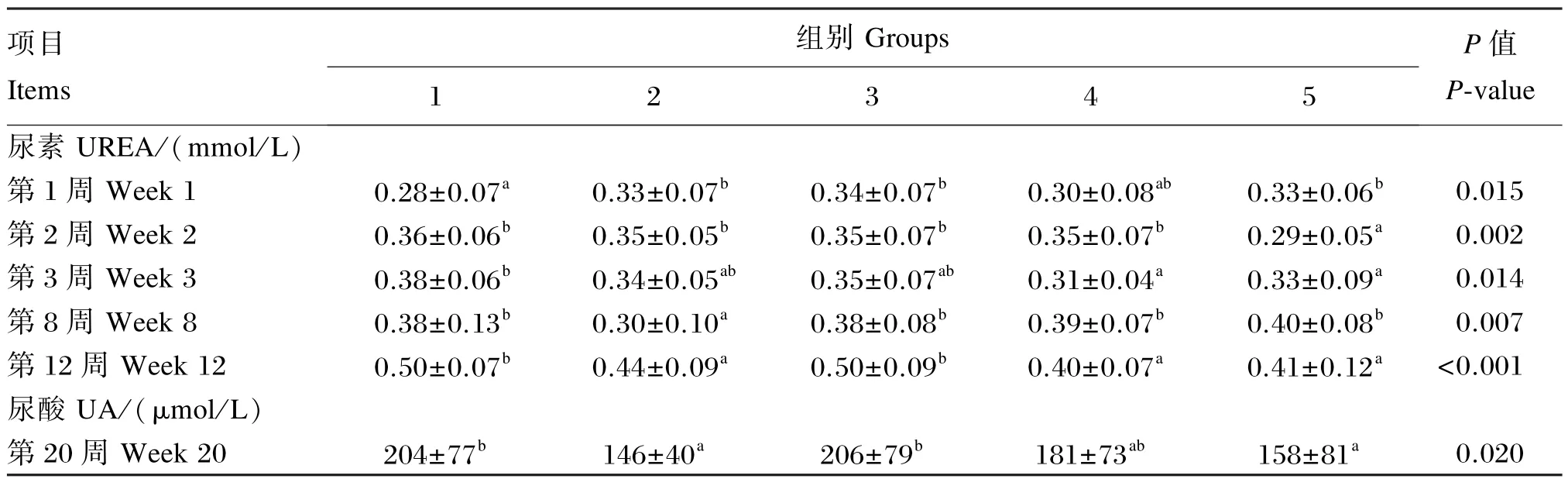
表6 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清UREA及UA含量的影响Table 6 Effects ofBacillus subtilisCGMCC 1.921 on serum UREA and UA contents of laying hens

表7 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清GLU含量的影响Table 7 Effects ofBacillus subtilisCGMCC 1.921 on serum GLU content of laying hens mmol/L
综上所述,饲粮中添加枯草芽孢杆菌CGMCC 1.921除在一定程度上升高了血清GLU含量,降低了UREA含量之外,在整个试验期对其他血清生化指标的影响不大。
2.3 枯草芽孢杆菌CGMCC 1.921对蛋鸡血常规指标的影响
由表8可知,对于血液WBC数目,试验2(第1、12、16、24周)、3(第 3、16、20、24周)、4(第 1、3、4、8、16、20、24周)、5组(第 1、3、4、8、20、24周)显著高于对照组(P<0.05),试验2组(第12周)显著高于试验3、4组(P<0.05),试验3组(第20周)显著高于试验2组(P<0.05),试验4组(第3、4周)显著高于试验2、3组(P<0.05),试验4组(第8、20周)显著高于其他各组(P<0.05),试验5组(第1周)显著高于其他各组(P<0.05),试验5组(第3、4、20周)显著高于试验2组(P<0.05)。
由表9可知,对于血液LYM数目,试验2(第12、16、24周)、3(第2、3、4、20、24周)、4(第 3、4、8、20、24周)、5组(第3、4、8、20、24周)显著高于对照组(P<0.05),而试验4组(第0、12、16周)显著低于其他各组(P<0.05),试验2组(第4周)显著低于对照组(P<0.05),试验3、4、5组(第3、4、8周)显著高于试验2组(P<0.05)。
由表10可知,对于血液MID数目,试验2(第1、12周)、3(第16周)、4(第0、12、16、20、24周)、5组(第0、1、3、12、16、20、24周)显著高于对照组(P<0.05),试验4、5组(第0、20、24周)显著高于其他各组(P<0.05),试验5组(第1、3周)显著高于试验3、4组(P<0.05)。

表8 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液WBC数目的影响Table 8 Effects ofBacillus subtilisCGMCC 1.921 on blood WBC count of laying hens 109/L
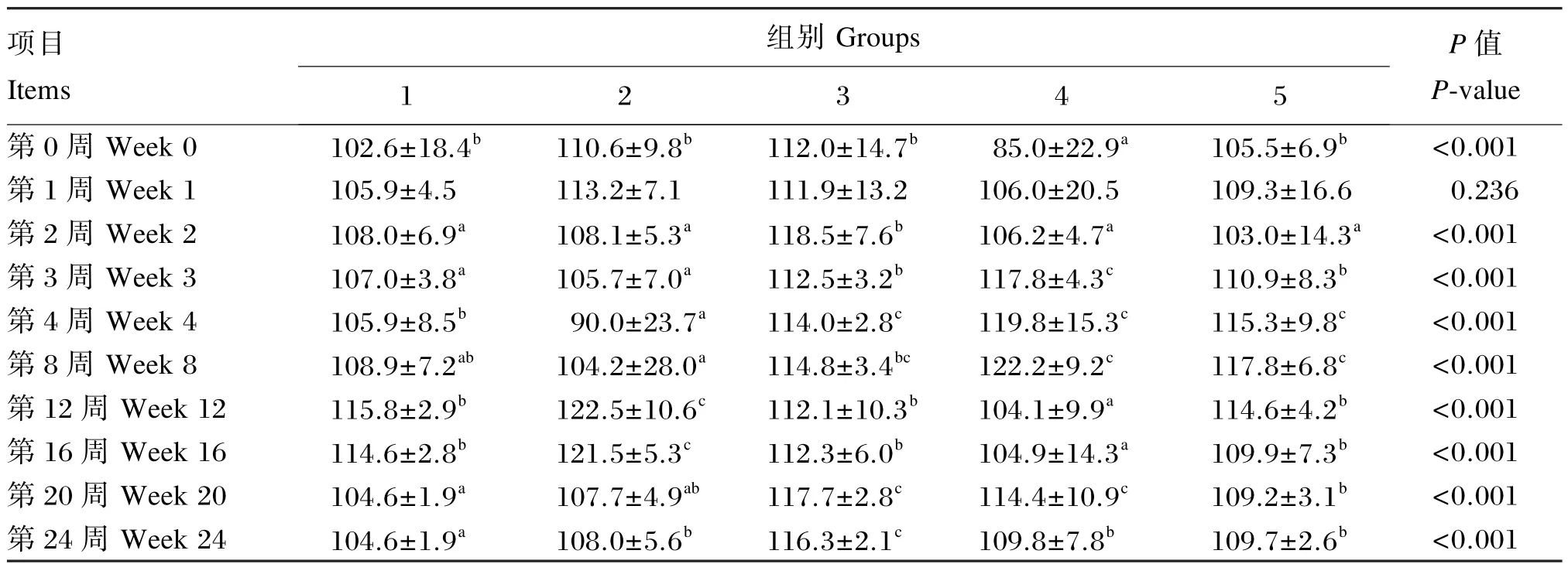
表9 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液LYM数目的影响Table 9 Effects ofBacillus subtilisCGMCC 1.921 on blood LYM count of laying hens 109/L

表10 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液MID数目的影响Table 10 Effects ofBacillus subtilisCGMCC 1.921 on blood MID count of laying hens 109/L
由表11可知,对于血液NEU数目,试验2(第1周)、3(第 16周)、4(第 0、12、16、24周)、5组(第0、12、16、24周)显著高于对照组(P<0.05),试验3组(第 0、2、20周)显著低于对照组(P<0.05),试验4、5组(第0、12、24周)显著高于试验2、3组(P<0.05)。

表11 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液NEU数目的影响Table 11 Effects ofBacillus subtilisCGMCC 1.921 on blood NEU count of laying hens 109/L
由表12可知,对于血液RBC数目,试验2(第1、3周)、4(第2、12周)、5组(第1、2、3、12周)显著低于对照组(P<0.05),而试验3、4、5组(第16、20周)显著高于对照组和试验2组(P<0.05)。

表12 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液RBC数目的影响Table 12 Effects ofBacillus subtilisCGMCC 1.921 on blood RBC count of laying hens 1012/L
由表13可知,对于血液HGB含量,试验2(第1、3、4、20周)、3(第 3、20、24周)、4(第 1、3、12周)、5组(第1、12周)显著低于对照组(P<0.05),而试验3、4、5组(第16周)显著高于对照组和试验2组(P<0.05)。
由表14可知,对于血液 HCT,试验2(第3周)、4(第2、3、12周)、5组(第1、2、3、12周)显著低于对照组(P<0.05);试验 2(第 24周)、3(第16、20、24周)、4(第 16、20、24周)、5组(第 16、20、24周)显著高于对照组(P<0.05)。
由表15可知,对于血液PLT数目,试验2(第24周)、3(第24周)、4(第16、24周)、5组(第16、24周)显著高于对照组(P<0.05)。

表13 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液HGB含量的影响Table 13 Effects ofBacillus subtilisCGMCC 1.921 on blood HGB content of laying hens g/L
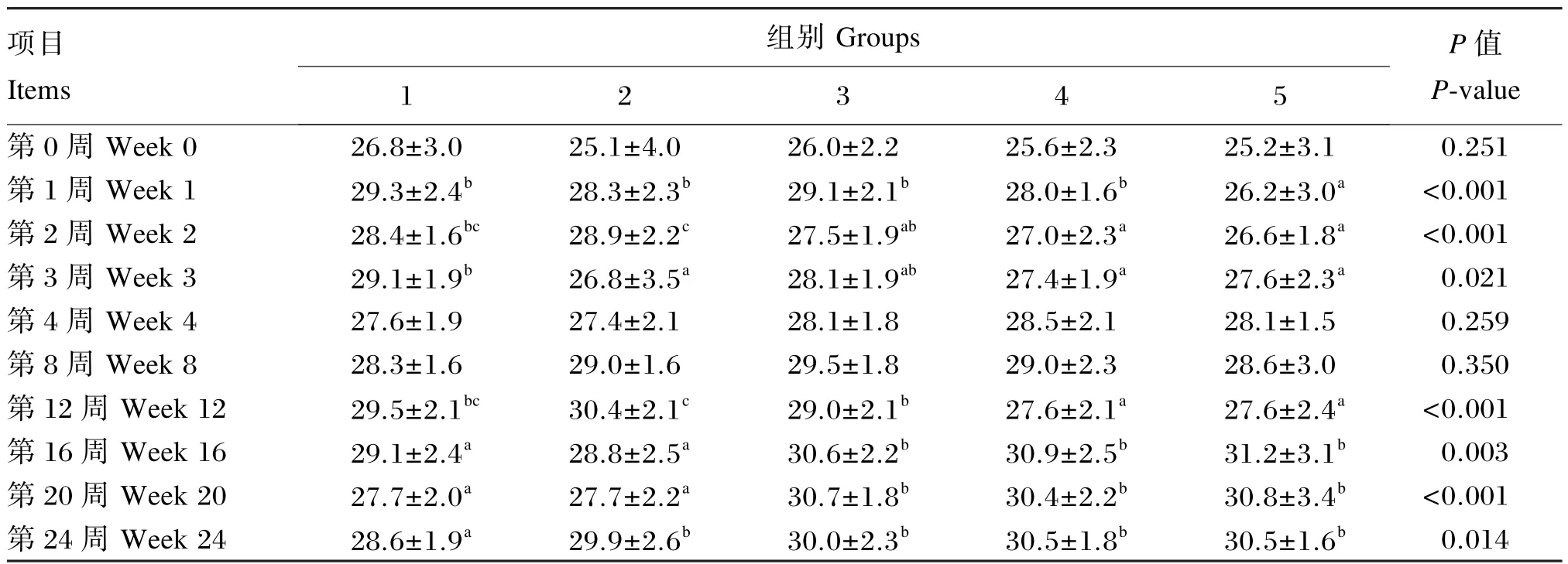
表14 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液HCT的影响Table 14 Effects ofBacillus subtilisCGMCC 1.921 on HCT in blood of laying hens %
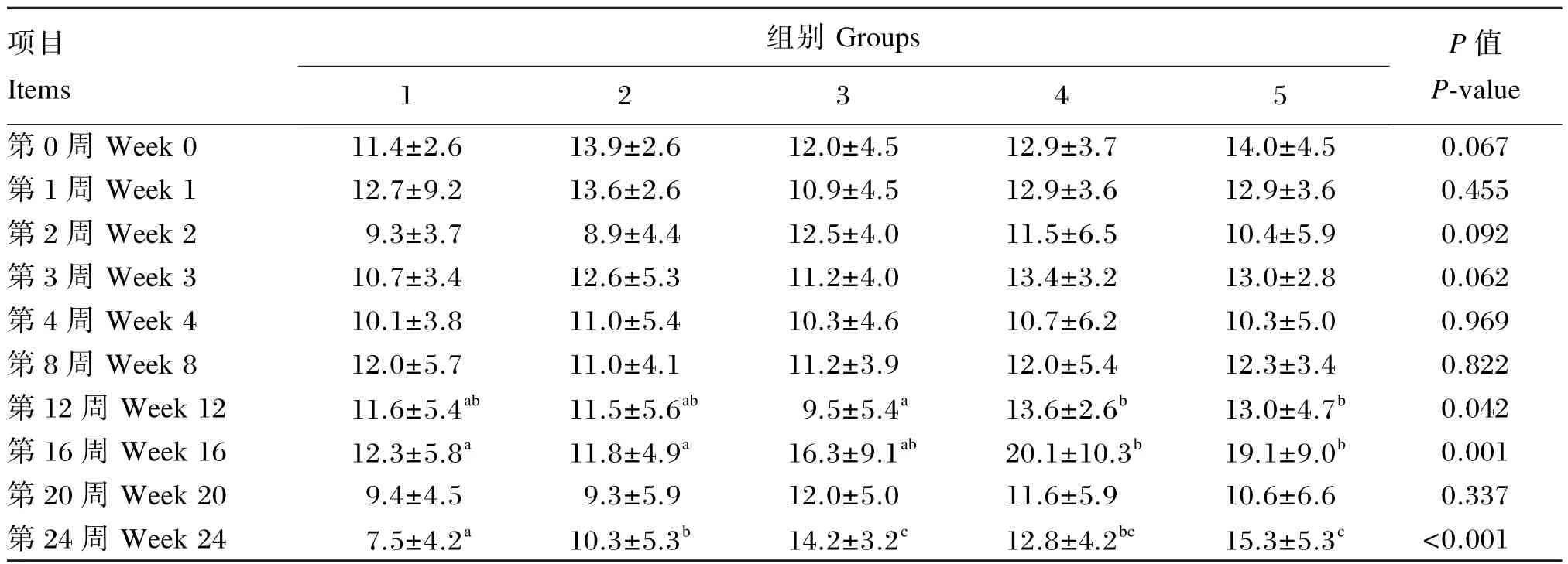
表15 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液PLT数目的影响Table 15 Effects ofBacillus subtilisCGMCC 1.921 on blood PLT count of laying hens 109/L
由表16可知,对于血液ESR,试验2(第20周)、3(第3、20、24周)、4(第3、20周)、5组(第3、4、8、20周)显著高于对照组(P<0.05)。
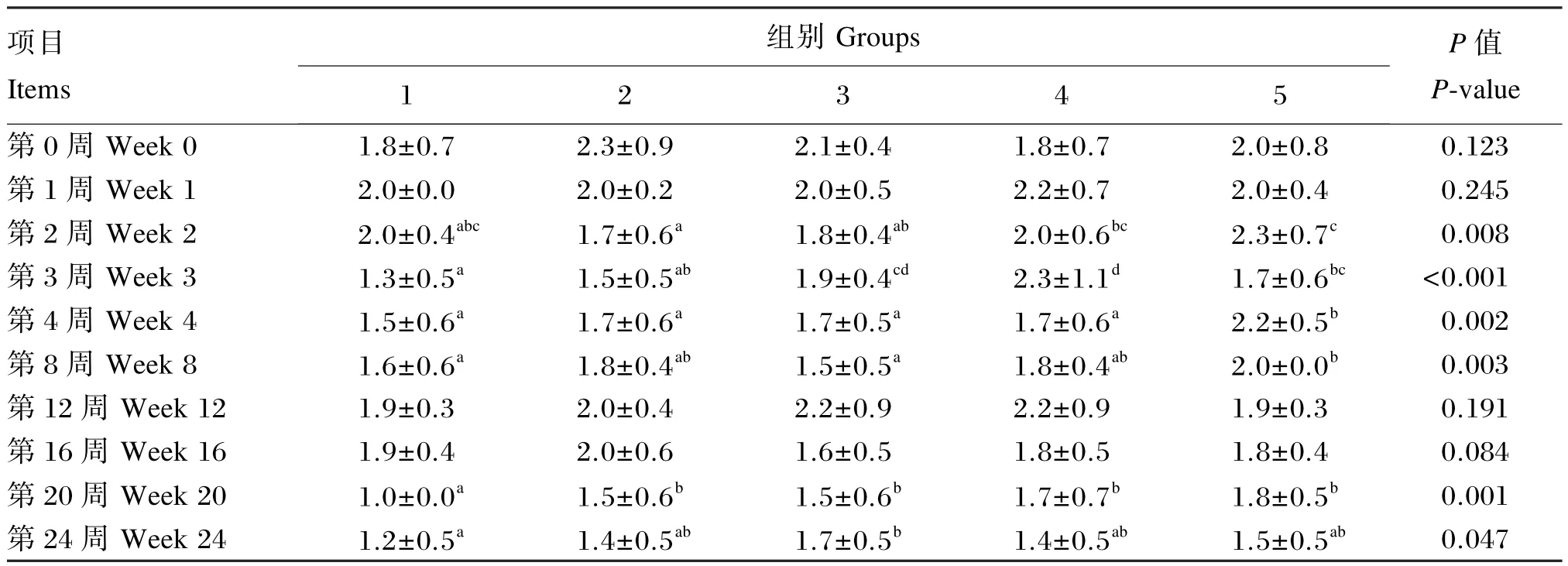
表16 枯草芽孢杆菌CGMCC 1.921对蛋鸡血液ESR的影响Table 16 Effects ofBacillus subtilisCGMCC 1.921 on ESR in blood of laying hens mm/h
综上所述,饲粮添加枯草芽孢杆菌CGMCC 1.921提高了血液WBC和LYM数目,降低了试验第1、2、3和12周的血液RBC数目和HCT,但提高了试验第16、20和24周的血液RBC、PLT数目和HCT。
2.4 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清免疫球蛋白含量的影响
由表17可知,饲粮中添加枯草芽孢杆菌CGMCC 1.921对血清IgA含量(第3周)有升高趋势(P=0.083)。对于血清IgG含量,试验5组(第1周)显著高于对照组和试验2、3组(P<0.05),试验4、5组(第4周)显著高于对照组(P<0.05),而试验2组(第20周)显著低于对照组和试验3组(P<0.05)。对于血清IgM含量,试验5组(第2、8周)显著高于其他各组(P<0.05),试验3、4、5组(第4周)显著高于对照组(P<0.05),试验3组(第16周)显著高于其他各组(P<0.05)。其他时间点,各组间血清IgA、IgG和IgM含量(数据未列出)无显著差异(P>0.05)。

表17 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清免疫球蛋白含量的影响Table 17 Effects ofBacillus subtilisCGMCC 1.921 on serum immunoglobulins contents of laying hens mg/mL
3 讨 论
3.1 枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能的影响
有研究表明,饲粮中添加益生菌可以提高动物的生产性能,但其相关研究的结论不尽相同。本研究表明,与对照组相比,添加1×105、1×106、1×107和1×108CFU/g枯草芽孢杆菌 CGMCC 1.921对产蛋率影响不显著,但较对照组产蛋率分别提高了3.24%、3.35%、3.35%和4.02%;且饲粮添加1×105、1×107和1×108CFU/g枯草芽孢杆菌CGMCC 1.921显著降低了料蛋比,而添加1×105、1×106、1×107和1×108CFU/g枯草芽孢杆菌CGMCC 1.921的各组间无显著差异,故在本试验条件下枯草芽孢杆菌CGMCC 1.921适宜添加水平为1×105CFU/g。Zhang等[11]研究表明,饲粮中添加3.6×106CFU/g枯草芽孢杆菌可以显著降低料蛋比,对产蛋率、蛋重、采食量影响不显著,但在一定程度上提高了产蛋率,这与本试验结果相一致。Ribeiro等[12]在饲粮中添加8×105CFU/g枯草芽孢杆菌可以提高产蛋率和蛋重。另外,有研究表明,饲粮中添加枯草芽孢杆菌、植物乳杆菌等对肉鸡[13]、仔猪[14]及水产动物[15]的生长性能均有一定的改善作用。Deng等[16]试验发现,饲粮添加1×107CFU/g地衣芽孢杆菌可以缓解热应激对蛋鸡生产性能造成的不利影响。这可能与益生菌可以提高消化酶的活性[17]、改善肠道结构[18-19],从而提高了营养的利用率有关[20]。 而 Forte等[21]发现添加0.1%嗜酸乳杆菌和0.05%枯草芽孢杆菌对海兰蛋鸡的生产性能均无显著影响。Sobczak等[22]报道添加枯草芽孢杆菌ATCC PTA-6737没有改善罗曼褐蛋鸡的生产性能。这可能与添加水平、动物的生产周期、饲养环境或者菌株特性有关。
3.2 枯草芽孢杆菌CGMCC 1.921对蛋鸡血清生化指标的影响
本试验发现饲粮添加不同水平枯草芽孢杆菌CGMCC 1.921在试验期间对血清ALT、AST活性基本无影响。ALT、AST主要存在于肝细胞中,其活性高低反映肝细胞的损伤程度,当肝细胞受损时,大量ALT、AST进入血液,则血清中两者活性增高。有研究表明,饲粮中添加益生菌可以显著降低血清 ALT和 AST活性[21,23]。 而 Li等[24]和Ma等[25]报道,饲粮添加枯草芽孢杆菌对绍兴鸭和蛋鸡血清ALT和AST活性无显著影响,与本试验结果相一致。血清TP、ALB、GLB含量及A/G是衡量肝脏合成和储备功能的指标,血清TBIL含量反映肝脏的分泌和排泄功能是否正常。ALB是由肝脏合成的,肝脏损伤则血清ALB含量减少;而若肝脏发生炎症则会引起血清GLB和TBIL含量的升高。对于血清TP、ALB、GLB、TBIL含量及A/G,各试验组与对照组之间总体上没有大的差异,说明饲粮添加不同水平枯草芽孢杆菌CGMCC 1.921对蛋鸡肝脏功能没有产生不良影响。UREA、UA和CREA是衡量肾脏功能的重要指标,本试验表明,饲粮添加枯草芽孢杆菌CGMCC 1.921对血清UA和CREA含量没有明显改善作用,但降低了血清UREA含量。UREA是蛋白质代谢的产物,反映动物机体蛋白质的分解代谢水平。一般而言,血清UREA含量升高说明蛋白质的沉积率下降,本试验血清UREA含量降低,说明饲粮添加枯草芽孢杆菌CGMCC 1.921提高了蛋白质的沉积,减少了UREA在肾脏的积累,从而在一定程度上起到了保护肾脏的作用。Hatab等[26]在蛋鸡饲粮中添加枯草芽孢杆菌和屎肠球菌显著降低了血清UA含量,对血清CREA含量无显著影响,另外,蛋鸡血清GLU含量显著升高。本试验也发现添加枯草芽孢杆菌CGMCC 1.921在一定程度上提高了血清GLU含量,GLU是机体所需能量的主要来源,其含量的升高说明枯草芽孢杆菌CGMCC 1.921的添加可以给机体提供相对较多的能量。而血清GLU含量的升高可能是因为益生菌的添加增强了对碳水化合物的消化、糖原的分解以及糖异生的发生。对于血清 CHOL和 TG含量,Forte等[21]和Hatab等[26]报道添加枯草芽孢杆菌和屎肠球菌可以减少蛋鸡血清CHOL和TG的含量。本试验结果表明,添加不同水平枯草芽孢杆菌CGMCC 1.921对各试验时期血清CHOL和TG含量没有影响。Sobczak等[22]报道饲粮中添加枯草芽孢杆菌 ATCC PTA-6737没有对蛋鸡血清CHOL和TG的含量产生显著影响,与本试验研究结果相一致。这可能与试验周期、菌种或菌株等因素有关。
3.3 枯草芽孢杆菌CGMCC 1.921对蛋鸡血常规指标和免疫球蛋白含量的影响
全血血常规指标反映机体的健康状况。WBC是机体血液中十分重要的一类血细胞,具有抵御病原体的能力。LYM反映机体的免疫功能水平,在机体免疫应答过程中发挥主要作用。MID包括单核细胞、嗜酸性粒细胞和嗜碱性粒细胞,单核细胞和NEU具有强大的吞噬功能,在非特异性细胞免疫系统中起重要作用。研究表明,益生菌具有预防疾病、控制感染、提高机体免疫力的作用[27]。Khan等[28]研究多菌株制剂对蛋鸡血液指标的影响发现其显著提高了LYM百分比。本研究表明,饲粮添加枯草芽孢杆菌CGMCC 1.921可以提高血液WBC和LYM数目,其中添加1×107和1× 108CFU/g枯草芽孢杆菌CGMCC 1.921效果更明显。Kim等[29]在蛋鸡饲粮中添加益生菌制剂(枯草芽孢杆菌、乳酸菌及酵母)也显著提高了血液WBC和LYM数目,与本试验结果相似。这提示益生菌或其代谢产物可能对机体产生刺激从而对机体起到一定的免疫调节作用。Park等[30]饲喂给用鼠伤寒沙门氏菌KCCM 40253进行攻毒的肉鸡含枯草芽孢杆菌RX7和B2A饲粮10 d,结果表明其对血液WBC和LYM数目无显著影响。RBC是血液中数量最多的一种血细胞,它不仅是机体通过血液运送氧气的主要媒介,而且还具有免疫功能。Gheisar等[31]在肉鸡饲粮中添加屎肠球菌对血液 RBC数目无显著影响。而 Strompfova等[32]研究表明,饲粮添加屎肠球菌的仔猪血液RBC数目和HCT均有显著升高。Bonsu等[33]在肉鸡饲粮中添加多菌株制剂对血液RBC数目无影响,但降低了血液HGB含量。本研究表明,饲粮添加枯草芽孢杆菌 CGMCC 1.921的蛋鸡血液HGB含量及试验前12周的血液RBC数目和HCT有一定的降低,而试验16、20和24周血液RBC数目和HCT显著升高,这可能与动物的生理状态有关,但具体作用机制尚需进一步研究。对于血液PLT数目,Elzey等[34]报道 PLT在免疫系统中起重要作用,且正常小鼠血液中PLT数目减少会导致特异性抗体生成的减少。本试验结果表明,与对照组相比,试验5组在试验16和20周显著提高了血液PLT数目。Telli等[35]研究发现,在高饲养密度下的尼罗罗非鱼中添加枯草芽孢杆菌对血液PLT数目影响不显著,但在低饲养密度下可以显著提高血液PLT数目。对于血液ESR,本试验结果表明血液ESR在一定程度上稍有升高,血液ESR的升高可能与血液 RBC数目减少或血清GLU含量升高等有关,但其他各项血液指标无明显不良变化,说明血液ESR的变化没有对机体产生影响。此外,饲粮中添加枯草芽孢杆菌CGMCC 1.921在一定程度上可以提高血清免疫球蛋白的含量,尤其可以显著提高血清IgM含量,且在本试验条件下,枯草芽孢杆菌CGMCC 1.921添加水平为1×108CFU/g时效果最佳。说明枯草芽孢杆菌CGMCC 1.921在一定程度上可以提高机体的免疫防御机制。Kim等[29]饲喂蛋鸡乳酸菌制剂显著提高了血清IgG含量,对肉鸡血清IgG含量有提高但差异不显著。而Choi等[36]饲喂断奶仔猪含枯草芽孢杆菌、嗜酸乳杆菌、酿酒酵母的益生菌制剂对血清中IgA、IgG和IgM含量无显著影响。鲍延娥等[37]添加 1×105、1×106、1×107、1×108CFU/g约氏乳杆菌极显著降低了试验第7天和第35天的血清IgA含量,但极显著提高了试验第28天的血清IgA含量。
4 结 论
①饲粮中添加枯草芽孢杆菌CGMCC 1.921可以降低蛋鸡料蛋比,适宜添加水平为 1.0× 105CFU/g。
②饲粮中添加枯草芽孢杆菌CGMCC 1.921在一定程度上可以升高血清GLU含量,降低血清UREA含量,但对其他血清生化指标无明显改善作用。
③饲粮中添加枯草芽孢杆菌CGMCC 1.921可以提高血液WBC和LYM数目,提高血清免疫球蛋白含量,在一定程度上增强了蛋鸡的免疫机能,且适宜添加水平为1.0×108CFU/g。
[1]SETLOW P.Mechanisms which contribute to the longterm survival of spores of Bacillus species[J].Journal of Applied Microbiology,1994,76(Suppl.23):49S-60S.
[2]管越强,周环,张磊,等.枯草芽孢杆菌对中华鳖生长性能、消化酶活性和血液生化指标的影响[J].动物营养学报,2010,22(1):235-240.
[3]LEE S H,INGALE S L,KIM J S,et al.Effects of dietary supplementation withBacillus subtilisLS 1-2 fermentation biomass on growth performance,nutrient digestibility,cecal microbiota and intestinal morphology of weanling pig[J].Animal Feed Science and Tech-nology,2014,188:102-110.
[4]SEN S,INGALE S L,KIM Y W,et al.Effect of supplementation ofBacillus subtilisLS 1-2 to broiler diets on growth performance,nutrient retention,caecal microbiology and small intestinal morphology[J].Research in Veterinary Science,2012,93(1):264-268.
[5]YANG J J,XU Y Y,QIAN K,et al.Effects of chromium-enrichedBacillus subtilisKT260179 supplementation on growth performance,caecal microbiology,tissue chromium level,insulin receptor expression and plasma biochemical profile of mice under heat stress[J].British Journal of Nutrition,2016,115(5):774-781.
[6]WANG X,FARNELL Y Z,PEEBLES E D,et al.Effects of prebiotics,probiotics,and their combination on growth performance,small intestine morphology,and residentLactobacillusof male broilers[J].Poultry Science,2016,95(6):1332-1340.
[7]HOSSAIN M M,BEGUM M,KIM I H.Effect of Bacillus subtilis,Clostridium butyricumandLactobacillus acidophilusendospores on growth performance,nutrient digestibility,meat quality,relative organ weight,microbial shedding and excreta noxious gas emission in broilers[J].Veterinarni Medicina,2015,60(2):77-86.
[8]GONG Y,LI H,LI Y.Effects ofBacillus subtilison epithelial tight junctions of mice with inflammatory bowel disease[J].Journal of Interferon& Cytokine Research,2016,36(2):75-85.
[9]ZHANG Z F,CHO J H,KIM I H.Effects ofBacillus subtilisUBT-MO2 on growth performance,relative immune organ weight,gas concentration in excreta,and intestinal microbial shedding in broiler chickens[J].Livestock Science,2013,155(2/3):343-347.
[10]LAN R X,LEE S I,KIM I H.Effects of multistrain probiotics on growth performance,nutrient digestibility,blood profiles,faecal microbial shedding,faecal score and noxious gas emission in weaning pigs[J].Journal of Animal Physiology and Animal Nutrition,2016,doi:10.1111/jpn.12501.
[11]ZHANG J L,XIE Q M,JI J,et al.Different combinations of probiotics improve the production performance,egg quality,and immune response of layer hens[J].Poultry Science,2012,91(11):2755-2760.
[12]RIBEIRO V,Jr,ALBINO L F T,ROSTAGNO H S,et al.Effects of the dietary supplementation ofBacillus subtilislevels on performance,egg quality and excreta moisture of layers[J].Animal Feed Science and Technology,2014,195:142-146.
[13]LI Y,XU Q,HUANG Z,et al.Effect ofBacillus subtilisCGMCC 1.1086 on the growth performance and intestinal microbiota of broilers[J].Journal of Applied Microbiology,2016,120(1):195-204.
[14]HU Y L,DUN Y H,LI S N,et al.Effects ofBacillus subtilisKN-42 on growth performance,diarrhea and faecal bacterial flora of weaned piglets[J].Asian-Australasian Journal of Animal Sciences,2014,27(8):1131-1140.
[15]ZOKAEIFAR H,BABAEI N,SAAD C R,et al.Administration ofBacillus subtilisstrains in the rearing water enhances the water quality,growth performance,immune response,and resistance against Vibrio harveyi infection in juvenile white shrimp,Litopenaeus vannamei[J].Fish&Shellfish Immunology,2014,36(1):68-74.
[16]DENG W,DONG X F,TONG J M,et al.The probioticBacillus licheniformisameliorates heat stress-induced impairment of egg production,gut morphology,and intestinal mucosal immunity in laying hens[J].Poultry Science,2012,91(3):575-582.
[17]MURUGESAN G R,ROMERO L F,PERSIA M E.Effects of protease,phytase and aBacillussp.directfed microbial on nutrient and energy digestibility,ileal brush border digestive enzyme activity and cecal shortchain fatty acid concentration in broiler chickens[J].PLoS One,2014,9(7):e101888.
[18]LIU H,ZHANG J,ZHANG S H,et al.Oral administration ofLactobacillus fermentumI5007 favors intestinal development and alters the intestinal microbiota in formula-fed piglets[J].Journal of Agricultural and Food Chemistry,2014,62(4):860-866.
[19]齐博,武书庚,王晶,等.枯草芽孢杆菌对肉仔鸡生长性能、肠道形态和菌群数量的影响[J].动物营养学报,2016,28(6):1748-1756.
[20]LEI X J,PIAO X S,RU Y J,et al.Effect ofBacillus amyloliquefaciens-based direct-fed microbial on performance,nutrient utilization,intestinal morphology and cecal microflora in broiler chickens[J].Asian-Australasian Journal of Animal Sciences,2014,28(2):239-246.
[21]FORTE C,MOSCATI L,ACUTI G,et al.Effects of dietaryLactobacillus acidophilusandBacillus subtilison laying performance,egg quality,blood biochemistry and immune response of organic laying hens[J].Journal of Animal Physiology and Animal Nutrition,2016,100(5):977-987.
[22]SOBCZAK A,KOZŁOWSKI K.The effect of a probiotic preparation containingBacillus subtilisATCC PTA-6737 on egg production and physiological parameters of laying hens[J].Annals of Animal Science,2015,15(3):711-723.
[23]WANG B G,XU H B,WEI H,et al.Oral administration ofBifidobacterim bifidumfor modulating microflora,acid and bile resistance,and physiological indices in mice[J].Canadian Journal of Microbiology,2014,61(2):155-163.
[24]LI W F,RAJPUT I R,XU X,et al.Effects of probiotic(Bacillus subtilis)on laying performance,blood biochemical properties and intestinal microflora of Shaoxing duck[J].International Journal of Poultry Science,2011,10(8):583-589.
[25]MA Q G,GAO X,ZHOU T,et al.Protective effect ofBacillus subtilisANSB060 on egg quality,biochemical and histopathological changes in layers exposed to aflatoxin B1[J].Poultry Science,2012,91(11):2852-2857.
[26]HATAB M H,ELSAYED M A,IBRAHIM N S.Effect of some biological supplementation on productive performance,physiological and immunological response of layer chicks[J].Journal of Radiation Research and Applied Sciences,2016,9(2):185-192.
[27]NEWAJ-FYZUL A,ADESIYUN A A,MUTANI A,et al.Bacillus subtilisAB1 controlsAeromonasinfection in rainbow trout(Oncorhynchus mykiss,Walbaum)[J].Journal of Applied Microbiology,2007,103(5):1699-1706.
[28]KHAN S H,ATIF M,MUKHTAR N,et al.Effects of supplementation of multi-enzyme and multi-species probiotic on production performance,egg quality,cholesterol level and immune system in laying hens[J].Journal of Applied Animal Research,2011,39(4):386-398.
[29]KIM C H,WOO K C,KIM G B,et al.Effects of supplementary multiple probiotics or single probiotics on the performance,intestinal microflora,immune response of laying hens and broilers[J].Korean Journal of Poultry Science,2010,37(1):51-62.
[30]PARK J H,KIM I H.The effects of the supplementation ofBacillus subtilisRX7 and B2A strains on the performance,blood profiles,intestinalSalmonellaconcentration,noxious gas emission,organ weight and breast meat quality of broiler challenged withSalmonella typhimurium[J].Journal of Animal Physiology and Animal Nutrition,2015,99(2):326-334.
[31]GHEISAR M M,HOSSEINDOUST A,KIM I H.Effects of dietaryEnterococcus faeciumon growth performance,carcass characteristics,faecal microbiota,and blood profile in broilers[J].Veterinarni Medicina,2016,61(1):28-34.
[32]STROMPFOVÁ V, MARCIÑÁKOVÁ M,SIMONOVÁ M,et al.Enterococcus faeciumEK13-an enterocin a-producing strain with probiotic character and its effect in piglets[J].Anaerobe,2006,12(5/6):242-248.
[33]BONSU F R K,DONKOH A,OSEI S A,et al.Effect of direct-fed microbial and antibiotics supplementation on the health status and growth performance of broiler chickens under hot humid environmental conditions[J].International Journal of Livestock Production,2012,3(6):66-71.
[34]ELZEY B D,TIAN J,JENSEN R J,et al.Platelet-mediated modulation of adaptive immunity:a communication link between innate and adaptive immune compartments[J].Immunity,2003,19(1):9-19.
[35]TELLI G S,RANZANI-PAIVA M J T,DE CARLA DIAS D,et al.Dietary administration ofBacillus subtilison hematology and non-specific immunity of Nile tilapiaOreochromis niloticusraised at different stocking densities[J].Fish&Shellfish Immunology,2014,39(2):305-311.
[36]CHOI Y,GOEL A,HOSSEINDOUST A,et al.Effects of dietary supplementation ofEcklonia cavawith or without probiotics on the growth performance,nutrient digestibility,immunity and intestinal health in weanling pigs[J].Italian Journal of Animal Science,2016,15(1):62-68.
[37]鲍延娥,汪攀,董晓芳,等.约氏乳杆菌对产蛋鸡生产性能、蛋品质和免疫机能的影响[J].动物营养学报,2013,25(3):595-602.
Effects of Bacillus subtilis CGMCC 1.921 on Performance,Routine Blood Parameters,Serum Biochemical Parameters and Immunoglobulin Contents of Laying Hens
GUO Junrui DONG Xiaofang∗TONG Jianming
(Institute of Animal Sciences,Chinese Academy of Agricultural Sciences,Beijing100193,China)
This study was conducted to investigate the effects ofBacillus subtilisCGMCC 1.921 on performance,routine blood parameters,serum biochemical parameters and immunoglobulin contents of laying hens.A total of 360 twenty-seven-week-old healthy Hy-Line brown laying hens were randomly allocated into 5 groups with 6 replicates per group and 12 birds per replicate.The control group(group 1)was fed a basal diet,and the experimental groups(groups 2 to 5)were fed the basal diets supplemented with 1.0×105,1.0×106,1.0× 107and 1.0×108CFU/gBacillus subtilisCGMCC 1.921,respectively.The experiment lasted for 24 weeks.The results showed that there were no significant differences in egg production,feed intake,egg weight,egg weight per hen and mortality among all groups(P>0.05).However,group 2,4,5 significantly decreased feed to egg ratio compared with the control group(P<0.05).DietaryBacillus subtilisCGMCC 1.921 supplementation significantly increased serum glucose content(weeks 2,3,12,16 and 20)(P<0.05),and significantly decreased serum urea content(weeks 2,3,8 and 12)(P<0.05).DietaryBacillus subtilisCGMCC 1.921 supplementation significantly increased blood leucocytes(weeks 1,3,4,8,12,16,20 and 24)and lymphocytes counts(weeks 2,3,4,8,12,16,20 and 24)(P<0.05),and significantly increased serum immunoglobulin G(weeks 1 and 4)and immunoglobulin M contents(weeks 2,4,8 and 16)(P<0.05).Therefore,dietaryBacillus subtilisCGMCC 1.921 supplementation can decrease the feed to egg ratio,improve serum glucose and urea contents and routine blood test parameters,and enhance immunity of laying hens to a certain extent.[Chinese Journal of Animal Nutrition,2017,29(2):465-478]
laying hens;Bacillus subtilis;performance;routine blood parameters;serum biochemical parameters;immunoglobulin
S831
A
1006-267X(2017)02-0465-14
10.3969/j.issn.1006-267x.2017.02.014
(责任编辑 武海龙)
2016-08-28
国家蛋鸡产业技术体系建设专项经费(CARS-41-K16);中国农业科学院科技创新工程(ASTIP-IAS08)
郭军蕊(1988—),女,河南新乡人,博士研究生,研究方向为动物营养与饲料科学。E-mail:gjr217@yeah.net
∗通信作者:董晓芳,副研究员,硕士生导师,E-mail:xiaofangd1124@sina.com
∗Corresponding author,associate professor,E-mail:xiaofangd1124@sina.com

