酸性环境下铁的电化学腐蚀实验的研究
陈荣静+丁伟
摘要:通过实验探究发现,在酸性环境下盐酸体积、盐酸浓度、铁炭质量比、环境温度和振荡操作五个因素对铁的电化学腐蚀实验均有影响。根据探究结果提出了实验方案,旨在为中学教师有效控制实验条件、成功进行金属的电化学腐蚀的实验教学以及帮助学生厘清析氢腐蚀和吸氧腐蚀的发生条件提供实用的信息。
关键词:酸性环境:铁的电化学腐蚀;吸氧腐蚀;析氢腐蚀;实验优化
文章編号:1005–6629(2017)1–0057–05 中图分类号:G633.8 文献标识码:B
1 研究背景
高中选修阶段,金属的电化学腐蚀的学习内容包括析氢腐蚀和吸氧腐蚀两种类型。人教版教材[1]用食盐水中的铁钉演示吸氧腐蚀,不过需要较长时间才能观察到明显现象;苏教版教材[2]则设计了铁炭混合粉分别在中性(食盐水)、酸性(稀醋酸)环境下发生腐蚀的实验。实际操作中,铁炭粉在食盐水中的倒吸现象快速而明显,而在稀醋酸的酸性环境下往往较难观察到析氢腐蚀的液注外排现象,反而出现速率较大的倒吸。显然,这样的实验现象与中学阶段“金属在较强酸性的环境下发生析氢腐蚀,在弱酸性、中性和碱性环境下发生吸氧腐蚀”的认知不符,易造成学生的困惑。这一方面是由于教材所给的实验条件不明确,同时也反映出教师对金属电化学腐蚀的认识以及实验条件控制还不够到位。
已有研究表明,两种电化学腐蚀并非对立,而是共存、竞争的关系[3],有研究者借助传感器证实,不论电解质溶液的酸碱度如何,吸氧腐蚀都可能发生[4]。酸液中的电化学腐蚀过程大致如下,起初H+浓度高而溶解氧含量低,因此析氢腐蚀占主导,吸氧腐蚀相对较弱,体系内部压强增大;而随着液膜酸度减弱和氧气渗入,吸氧腐蚀逐渐增强、析氢腐蚀减弱,吸氧腐蚀后来居上,表现为内部压强减小。酸性环境下,我们观察到的体系压强变化常常是析氢腐蚀和吸氧腐蚀的总效果,故相对复杂[5]。本研究通过探究酸性环境下不同条件对铁的电化学腐蚀的影响,进而优化实验方案,以期为中学教师的实验教学提供借鉴或参考。
2 实验部分
2.1 实验药品与器材
药品:还原铁粉(AR)、活性炭粉(200目,AR)、盐酸(AR)、蒸馏水、红墨水
器材:容量瓶、量筒、烧杯、玻璃棒、分析天平、研钵、移液管、100mL锥形瓶、胶头滴管、阀门、三孔塞、铁架台、U形管(15cm×0.8cm)、导管、橡胶管、秒表、刻度尺
部分药品与器材的使用意图见表1。

2.2 实验操作
(1)搭建实验装置,如图1所示;
(2)检验装置气密性;
(3)按实验方案要求的量准确称取还原铁粉、活性炭粉,充分研磨,然后小心倒入锥形瓶中;
(4)轻轻晃动使其铺平;
(5)用胶头滴管吸入方案要求的浓度与体积的盐酸,塞入三孔塞中,打开阀门连通大气后关闭;
(6)挤压胶头,将酸一次性加入锥形瓶中,立即观察U形管中指示液柱随时间变化情况并记录。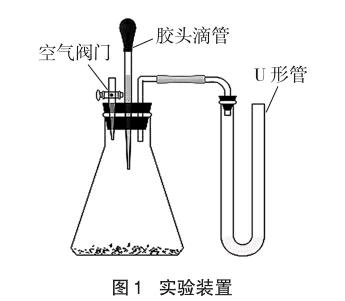
以酸液体积-酸液浓度-铁炭质量比-环境温度-振荡操作的顺序进行变量探究,在探究某一条件的影响时控制其他变量,记录时间、液注高度以及锥形瓶内的反应现象。
3 实验结果与分析
3.1 酸液体积对反应的影响
在20℃的环境温度下,取5.0g还原铁粉、0.5g活性炭粉,加入酸液后不振荡。选取0.5mol/L的盐酸溶液,设定不同体积,探究酸液体积对反应的影响。实验数据及现象如表2及图2。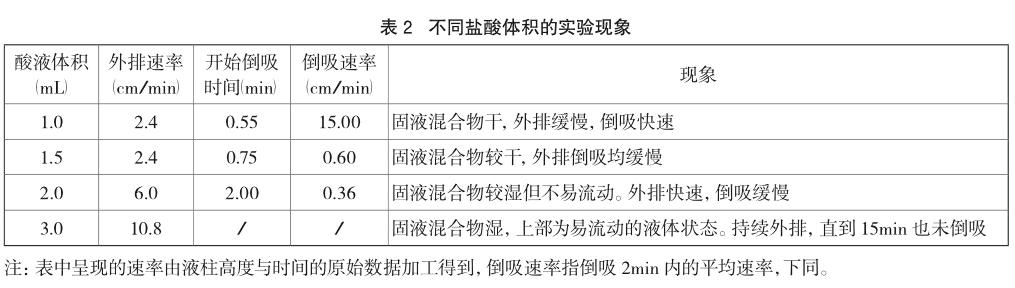
由表2、图2可以看出,随着酸量增加,指示液柱外排速率增大、时间延长、现象明显。为使加入的酸液与固体粉末充分接触但又不浸没固体而隔绝空气,2.0mL的酸量较合适。此时固体粉末呈现湿润但不浸泡的状态,体系中的固、液、气物质均能较好地接触。
3.2 酸液浓度对反应的影响
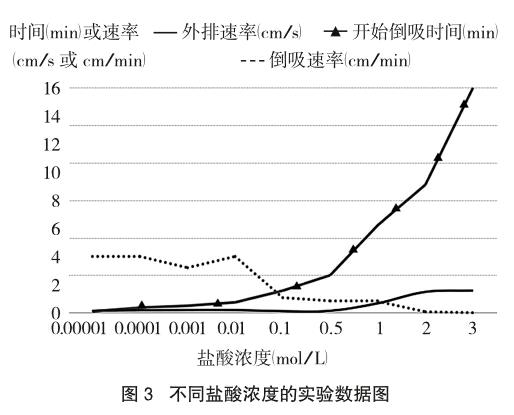
在20℃的环境温度下,取5.0g还原铁粉、0.5g活性炭粉,加入酸液后不振荡。配制不同浓度的盐酸以探究酸液浓度对反应的影响,控制盐酸体积为2.0mL。实验数据及现象如表3及图3所示。
由表3、图3可以看出,当盐酸浓度小于0.01 mol/L时,析氢腐蚀和吸氧腐蚀的现象均不明显。析氢腐蚀现象弱是因为反应物H+浓度小,盐酸溶液的酸度低也意味着离子浓度低,弱酸性条件下吸氧腐蚀现象也不明显。随着酸度的提高,指示液柱外排时间增长,析氢腐蚀现象变得明显。若盐酸浓度高于3 mol/L,则在一定时间内基本观察不到液柱倒吸现象。这是由于强酸性溶液中溶解氧浓度很小[6],吸氧腐蚀的发生受到阻碍。总的来说,盐酸浓度在0.1~2 mol/L的范围内时,析氢腐蚀和吸氧腐蚀的现象均明显。
3.3 铁炭质量比对反应的影响
在20℃的环境温度下,保证铁炭总质量为5.5g,配制不同质量比例的铁炭混合粉末。酸液为 2.0mL浓度为0.5 mol/L的盐酸,不振荡,探究铁炭质量比对反应的影响。实验数据及现象如表4、图4所示。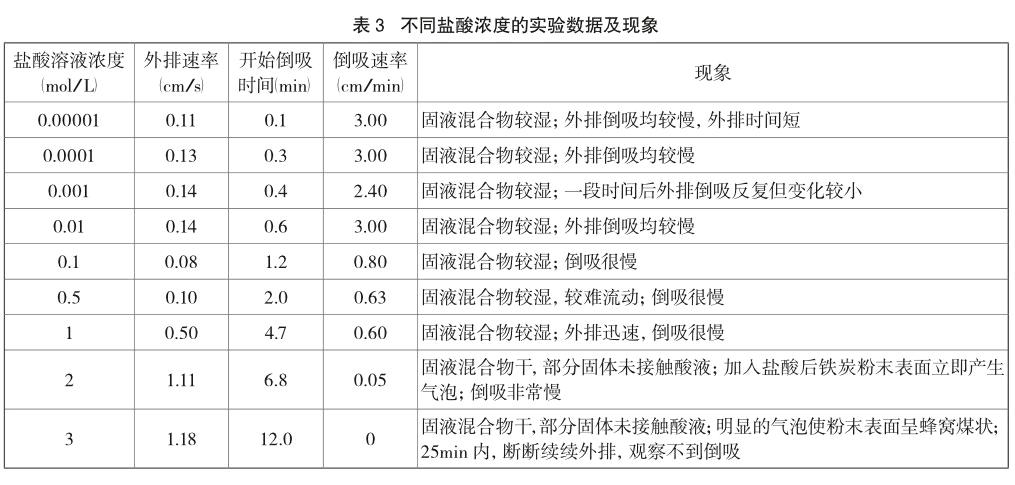
由表4、图4可以看出,等质量的铁炭混合物中炭粉比例增大时,外排速率没有明显变化,外排时间有缩短趋势但并不明显。这是因为炭粉在这里作为原电池正极,不参与电极反应。而随着炭粉比例的增大,倒吸速率显著增大,说明炭粉比例大对吸氧腐蚀有明显帮助,这主要是因为活性炭有吸附性,易吸附氧气到铁粉附近,还会吸附液体使液膜变薄,都利于铁粉接触氧气。不过若要促进固、液、气三者的接触,混合物的湿润程度须适中,因此8:1~12:1的铁炭质量比例较合适。
3.4 环境温度对反应的影响
药品为5.0g还原铁粉、0.5g活性炭粉和0.01 mol/L盐酸2.0mL,加入酸液后不振荡。设置不同的环境温度,甚至利用水浴创设60℃的环境温度,以探究不同温度下反应现象的区别。实验数据及现象如表5、图5所示。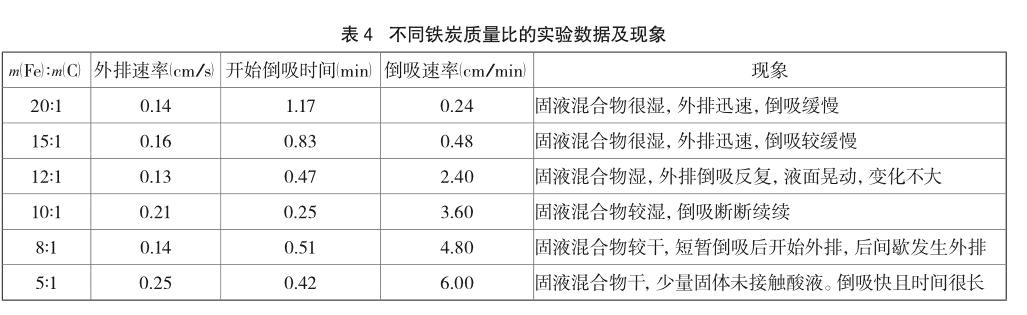
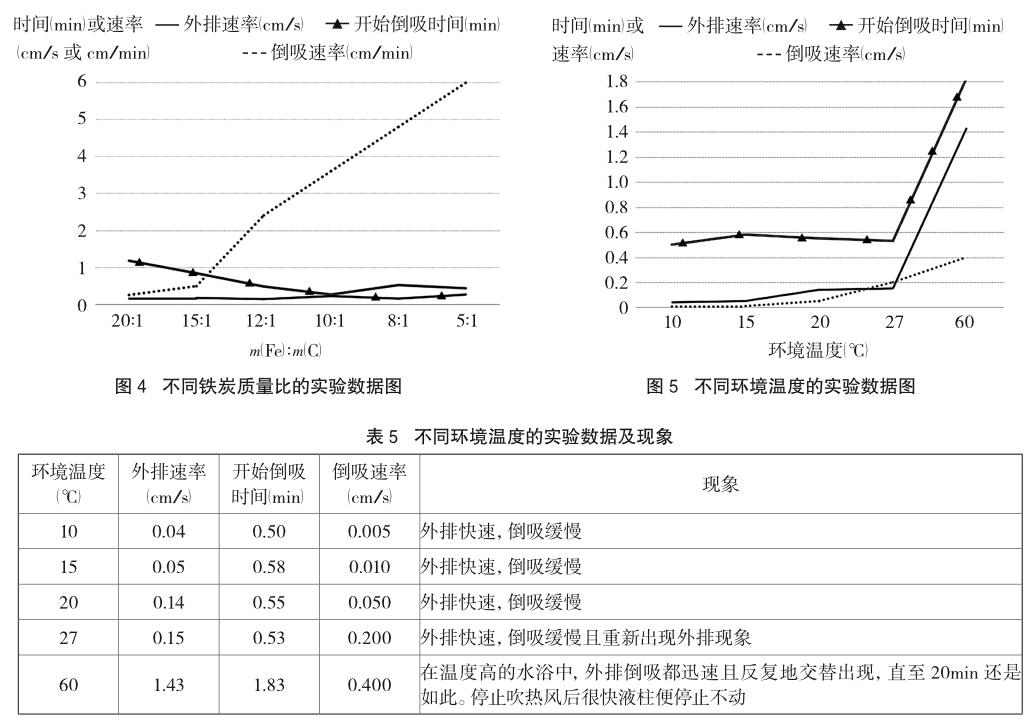
由表5、图5可以看出,随着温度升高,外排和倒吸的速率都明显加快。对析氢腐蚀和吸氧腐蚀来说,升温均加快了电极反应速度;然而酸液中溶解氧浓度却随着温度的升高而降低,会影响吸氧腐蚀发生。不过通过数据仍可发现,外排持续时间随温度升高呈增长趋势。
3.5 振荡操作对反应的影响
20℃温度下,向5.0g铁粉、0.5g活性炭的混合粉末中加入0.01 mol/L盐酸2.0mL,前后实验的不同之处只在加入酸液后振荡与否,以探究振荡操作是否影响反应现象。实验数据及现象如表6所示。
固液混合时,我们常会振荡促使混合均匀。操作中发现,振荡确实使铁炭粉与酸液接触更充分,这对析氢腐蚀、吸氧腐蚀均有促进作用。而振荡也不免向混合物中带入空气而促使吸氧腐蚀的发生,因此振荡操作会缩减指示液柱外排的时间。而若不振荡,显然酸液分布不会均匀。随着酸液的慢慢流渗,原本没反应的固体开始反应,导致轻微的现象反复,比如倒吸时出现一闪而过的外排现象。这在一定程度上影响了实验的稳定性和连续性,但换个角度恰恰说明了析氢腐蚀、吸氧腐蚀可共存。
4 总结与建议
本研究探究了酸性环境下各条件对铁的电化学腐蚀实验的影响,发现酸液体积、酸液浓度、铁炭质量比例、温度和振荡操作均会影响实验现象。不同的条件组合下,铁的电化学腐蚀反应的现象不同,因此教师可以参考本研究,根据课堂教学需要选择合适的条件。而出于演示先以析氢腐蚀为主导、后以吸氧腐蚀为主导的完整实验现象,帮助学生深刻理解电化学腐蚀发生条件的考虑,本研究推荐如表7的实验方案。
参考文献:
[1]宋心琦主编.普通高中课程标准实验教科书·化学反应原理(选修4)[M].北京:人民教育出版社,2007:84~85.
[2]王祖浩主编.普通高中课程标准实验教科书·化学反应原理(选修4)[M].南京:江苏教育出版社,2009:23~25.
[3]谈小强.关于钢铁腐蚀的理论探讨和实验分析[J].化学教学,2012,(5):47~48.
[4]孙慧玲,靳莹,霍爱新.基于手持技术的金属电化学腐蚀实验改进[J].化学教学,2014,(3):52~54.
[5]吕琳,袁梦玥,张瑜,吴星.铁的析氢腐蚀和吸氧腐蚀的实验原理探查[J].化学教学,2015,(10):46~49.
[6]徐绍龄,段维恒,刘时杰,郑雪君,佘國华.空气氧化水溶液中亚铁离子的研究——1.溶液pH对氧化速率的影响及铁的水解产物破坏水合亚铁离子“遮蔽效应”的催化机理[J].云南大学学报(自然科学版),1986,(2):191~197.

