氢离子与氢氧根离子对溶液导电性的显著影响
吴文中
摘要:电解质溶液中自由离子的浓度越高,其导电性就越强吗?不同离子对电解质溶液导电性有何差异?通过分析、解读2016年北京卷理综化学11题相关离子反应中电解质溶液导电性的变化特征,感悟电解质溶液中氢离子、氢氧根离子对溶液导电性的显著影响,理解电解质溶液的导电性规律。
关键词:电解质溶液;导电性;氢离子;氢氧根离子;离子导电能力
文章编号:1005–6629(2017)1–0093–04 中图分类号:G633.8 文献标识码:B
1 问题来源
在一些模拟题甚至高考题中,命题者往往把溶液中的导电性与溶液中自由离子的浓度大小等同起来,认为电解质溶液中自由离子浓度越高,其导电性就越强。但事实是溶液的导电性不但与离子浓度有关,还与离子种类有关,其中氢离子、氢氧根离子对溶液的导电性影响显著。
胡爱彬[1]在“基于DIS实验探究离子反应的生长课堂”一文中提到:电解质溶液的导电性,在其浓度不太大的情况下随着浓度的增大而变大。但这一结论的前提是电解质溶液中离子组成不发生变化时才成立,如0.2 mol·L-1的NaCl溶液比0.1 mol·L-1的NaCl溶液导电性强;但电解质溶液发生化学过程,离子种类改变,且离子总浓度无明显变化时,其导电能力也可能发生显著变化,如AgNO3溶液中滴加几滴浓盐酸,尽管溶液在反应过程中只是H+替换了部分Ag+,且离子总浓度基本不变,其导电性却显著增大——为什么?这就是我们将要讨论的重点。
如图1是2003年上海市化学高考卷中提供的澄清石灰水溶液导电能力随二氧化碳的体积变化示意图。该图是选择题22题中的一个选项,命题组提供的参考答案认为该图像是正确的。命题组可能与胡爱彬观点一样,认为离子浓度越大,溶液导电能力增大,离子总浓度基本不变且各离子所带电荷数不改变时,则电解质溶液的导电能力不变。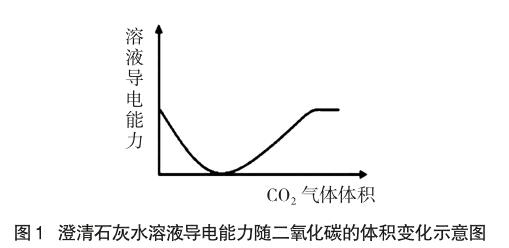
当在澄清石灰水中通入CO2时,溶液体积几乎不变,Ca2+与OH-分别转化为CaCO3沉淀和水,离子浓度显著下降,当澄清石灰水与CO2恰好完全反应时,溶液中的自由离子浓度很小(存在微量的碳酸钙溶解与水的极少部分电离),此时溶液的导电性几乎为0。
当CaCO3与CO2、H2O继续反应得到自由移动的Ca2+和HCO3-离子,离子总浓度与反应开始阶段的离子总浓度几乎一样,因此认为当不断通入CO2后,最终溶液的导电能力与反应开始时的导电能力几乎一样,所以该图像被认为是正确的。
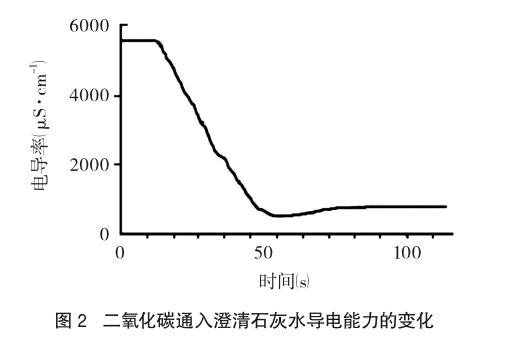
朱鹏飞、陈敏等[2]在研究二氧化碳通入澄清石灰水导电率变化的相关实验中,采用数字化实验得到如图2的实验结论:当澄清石灰水与CO2完全反应得到CaCO3沉淀后,溶液导电能力显著降低,继续通入过量CO2后,溶液的导电能力无法恢复到原有水平。
2 氢离子和氢氧根离子对溶液导电性的特殊影响
物理学上,一般用电导率来描述物体的导电性能,电导率越高,则该物体的导电性能越优异,如超导体的电导率可认为无穷大(约为1×1020 S·cm-1)。电解质溶液的电导率随电解质溶液的浓度变化而变化,也随温度改变而变化,几种不同的强弱电解质其电导率(κ)随浓度变化关系如图3[3]。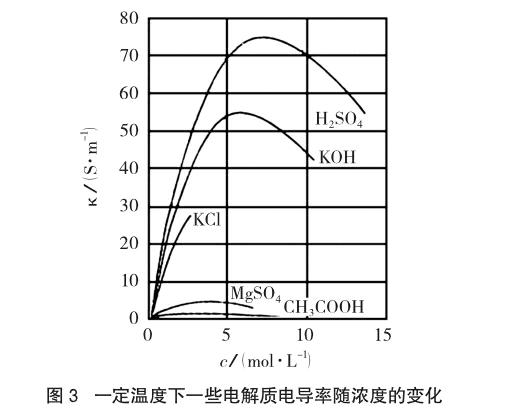
对某特定的强电解质来说,在浓度不是很大时,电导率(κ)随浓度增大而明显增大,这是因为单位体积溶液中导电离子数增多的缘故;当浓度超过某一数值后,由于离子间相互作用力增大,由此造成的导电能力的减小量大于导电离子增多而引起导电能力的增加量,反而出现了电导率(κ)随浓度增大而下降的反常现象。
从图3可得出的结论如下:
①同浓度但不同强电解质溶液,其电导率呈显著差异性;②同浓度的KCl与KOH溶液中K+离子浓度相同,Cl-与OH-浓度也一样,但其电导率有显著差异;③强酸强碱溶液比同浓度的盐溶液导电能力强,弱酸因部分电离,离子浓度低,导电能力弱得多;④H3O+和OH-对导电的贡献比其他离子大得多。
当Ca(OH)2溶液转化为同浓度的Ca(HCO3)2溶液时,由于OH-比HCO3-对溶液的电流贡献大得多,因此就很容易明白过量CO2通入澄清石灰水后,其导电能力显著降低的原因。
那为什么H3O+与OH-的电迁移速率特别快,对电流的贡献特别大?
这是由于H3O+或OH-在电场作用下迁移的特殊性造成的,H3O+和OH-表现出很高的离子淌度(如表1),离子淌度又称离子迁移率,是指某种离子在一定的溶剂中,电位梯度为每米1伏特时的迁移速率,反映的是离子电迁移快慢程度的物理量。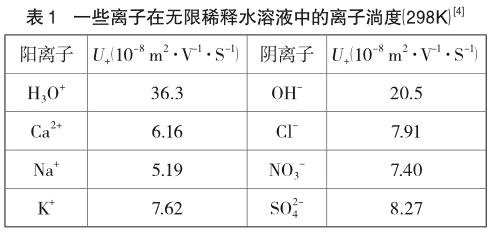
H3O+和OH-表現出的特殊迁移速率,是由于在通常的溶剂中的离子移动之外附加了跳跃机理,来自水合质子的H+可以跳跃到临近的水分子,是一个与水合氢离子在溶液中运动有相同效果的过程(如图4)。其传导过程可以看作在水溶液中单个的溶剂质子化传导,是通过一种质子传递机理(Grotthuss机理),而不是质子本身从溶液的一端迁向另一端。质子是从一个水分子传递给另一个水分子,电流就很快沿着氢键传导,分子的排列形式从(a)到(b),以(b)排列方式的分子必须翻转,回复到(a)的排列状态而接受(或释放)质子。
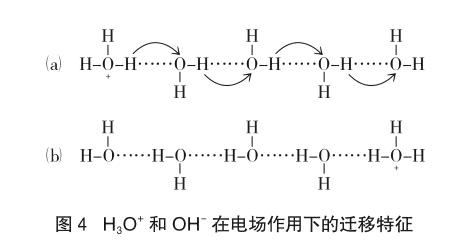
从离子淌度上看,H3O+和OH-的电迁移速率特别大,所以对电流的贡献也特别大;有意思的是正由于K+与Cl-、NO3-离子的离子淌度接近,因此KCl或KNO3常制作盐桥的电解质,以免造成因离子迁移速率差异过大而造成液接过电位。
3 解读2016年北京卷理综化学11题
[2016年北京卷理综化学11题]在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图5所示。下列分析不正确的是( )

作为高中学生,知道曲线①导电能力变化分为两段,而曲线②分为三段的事实就可轻易判断曲线①表示的是Ba(OH)2溶液与H2SO4溶液的反应,从而判断C选项不正确。
该高考题很好地说明了溶液导电性与不同离子、溶液的浓度等密切相关的好题,值得分析、品味,但其本意还是考查离子反应。依据上述實验中各种离子的电导率与摩尔电导率、浓度的关系及相关数据,利用Wolfram Mathematica 8数学软件作滴入溶液体积与混合溶液的电导率变化曲线,如图6所示。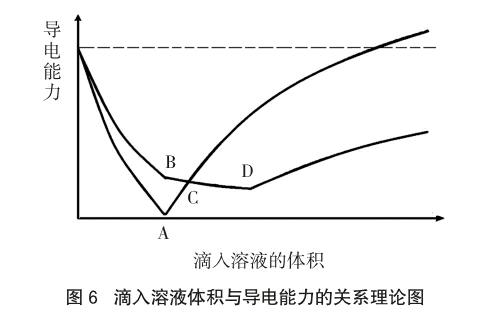
令人欣喜的是,该理论图像与2016年北京卷理综化学11题的有关图像有着惊人的相似,只是原题图像可能是先分别测定滴入不同体积溶液时的电导率,完成实验后通过描点法作出的曲线。
H3O+与OH-对溶液的电导率贡献显然是最大的,依据这一特征,可利用酸碱滴定过程中电导率的转折来确定滴定终点的方法来完成。如盐酸滴定氢氧化钠溶液过程中,开始时OH-离子浓度不断减少,混合溶液的电导率不断下降,当达到反应终点后,混合溶液中的H3O+浓度显著增大,电导率增大,V-κ曲线由减函数曲线转化为增函数曲线,利用电导率在滴定过程中转折特征即可判断中和滴定的终点。李新义 等学者在这一方面曾做了相关研究,不再赘述。
综上,对于同一强电解质溶液,离子种类不变,在一般浓度下,其浓度越大,电解质的导电性越强,但并不是线性关系。当某电解质溶液的浓度达到一定数值后,由于离子之间的相互作用,其导电性反而下降;对于电解质溶液因化学过程而发生离子种类变化的情况来说,电解质的导电性随离子种类或浓度变化而变化,其变化程度不一样,其中H3O+与OH-对电解质溶液产生电流的贡献最大。
4 高中化学教材中离子导电性实验的不足之处
高中化学教材中,涉及到溶液导电性实验并不多,其中为了引入强、弱电解质概念而进行的导电性实验最为典型:在5只相同的小烧杯中分别加入50mL物质的量浓度均为0.1 mol·L-1的HCl、CH3COOH、NaOH、NaCl和氨水等溶液,按图7所示装置进行实验,接通电源,观察实验现象并分析原因。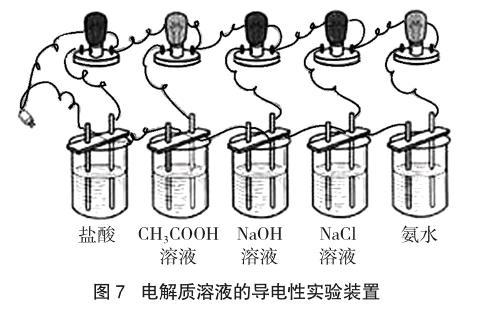
该实验的理论基础为“溶液中自由离子浓度越大,则其溶液的导电性越强”这一论述。实验时利用小灯泡发光的明亮程度来说明单位体积内溶液中自由离子的多少,继而引出强、弱电解质等概念。当其他实验条件(如直流电源电压、小灯泡的额定功率、石墨电极之间的距离等有关实验要素)相同时,进行上述灯泡的发光实验,由于同浓度的盐酸、NaOH和NaCl等溶液的实际导电性上并不相同,小灯泡的明亮程度有差异。若测定小灯泡电压,则电压表的读数在盐酸和NaOH溶液实验中数值更大,由此以此为依据得出“HCl、NaOH和NaCl等在水溶液中完全电离”是值得商榷的。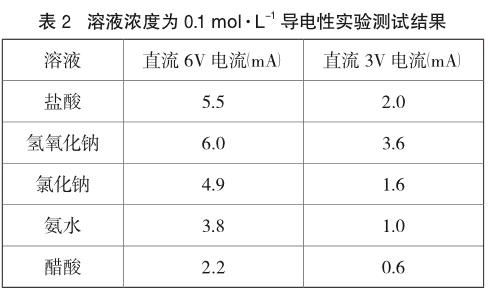
沈琳[5]在“电解质溶液导电性实验的探讨”一文中,测定了浓度为0.1 mol·L-1上述溶液在不同电压下电路中的电流强度如表2(石墨为阳极,铁为阴极)。
从表2可以看出,同为强电解质同浓度的盐酸、NaOH、NaCl溶液的导电性不一样。所幸的是人眼不能区分通过白炽灯泡的电流强度的较小差别而引起的发光亮度的差异,使得实验得以“近乎完美”,同时教师相关语言(如是不是醋酸溶液这组实验的小灯泡暗一些?NaOH溶液的亮一些?)的暗示下,从而“达到”实验目的。正是由于上述实验存在一定的纰漏,造成了许多学生甚至教师得出了上述所提到的有关电解质溶液导电性的片面性结论。
高中教材中虽未能提供影响电解质溶液导电性因素的相关阐述(许是难度太高,不适合高中学生的学习),但作为高中教师或高考命题者,对电解质溶液导电性规律的充分认识是需要的。当我们对某一化学专业知识准备不够充分时,更需要不断学习与探讨,以严谨和务实的科学态度组织教学或命制试题。
参考文献:
[1]胡爱彬.基于DIS实验探究离子反应的生长课堂[J].化学教育,2015,(9):30~33.
[2]朱鹏飞,陈敏.基于数字化实验的化学选修课教学实践——以二氧化碳通入澄清石灰水电导率变化的研究为例[J].教学仪器与实验,2015,(11):52~54.
[3][4]傅献彩,沈文霞,姚天扬.物理化学[M].北京:高等教育出版社,1990.
[5]沈琳.电解质溶液导电性实验的探讨[J].教学仪器与实验,2012,(12):10~11.

