HDL对3T3-L1细胞葡萄糖转运的影响及其机制研究
付 虹,戎有和
HDL对3T3-L1细胞葡萄糖转运的影响及其机制研究
付 虹1,戎有和2*
目的 探讨HDL对3T3-L1细胞葡萄糖转运的影响及其机制。方法 通过对3T3-L1成纤维细胞的分化,培养符合实验要求的3T3-L1脂肪细胞。通过葡萄糖消耗实验和3H标记的2-脱氧葡萄糖的摄取实验,研究HDL对葡萄糖转运的影响,应用RT-PCR和Western blot探讨其机制。结果 HDL可以促进3T3-L1脂肪细胞对葡萄糖的转运和摄取。3T3-L1脂肪细胞对葡萄糖的转运和摄取过程中,蛋白在RNA转录水平上没有增加,而是发生了AKT、AMPK蛋白的磷酸化。结论 HDL促进3T3-L1脂肪细胞对葡萄糖的摄取是通过AKT和AMPK两种途径来实现的。
高密度脂蛋白;3T3-L1细胞;葡萄糖转运;胰岛素抵抗
0 引言
胰岛素抵抗是一个慢性非特异性炎症持续过程[1-2],是糖尿病、血脂异常和肥胖症等代谢性疾病共同的生理病理基础,主要表现为外周组织尤其是肌肉、脂肪组织对葡萄糖的利用障碍[3-4]。高密度脂蛋白(High density lipoprotein,HDL)降低是很多代谢性疾病的共同特征,有研究证实,在脂肪组织和细胞中,HDL通过调节胆固醇的转运来发挥其抗炎作用[5]。1984年,有学者提出,升高HDL能够使低HDL的患者受益。之后的相关研究表明,直接给予HDL的效果最明显。本文采用3T3-L1细胞作为工具细胞,研究外源性给予HDL后对糖代谢的影响并探讨其机制。
1 材料与方法
1.1 材料 3T3-L1小鼠成纤维细胞购自上海中科院研究所细胞库。
1.2 试剂和药品 HDL购自美国Calbiochem公司;3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松、胰岛素购自Sigma公司;葡萄糖测定试剂盒购自上海荣盛生物技术有限公司;Triton-X100购自上海翔升生物科技有限公司;DMEM高糖培养基购自GIBCO公司;胎牛血清(Fetal bovine serum,FBS)购自美国Clark公司;IR-β抗体、IRS-1抗体、磷酸化IRS-1抗体、AKT抗体、磷酸化AKT抗体、AMPK抗体、磷酸化AMPK抗体、β-actin抗体购自美国 Cell Signaling Technology公司;磷酸化IR-β抗体购自英国Abcam公司;多克隆GLUT4抗体购自美国Chemicon公司。辣根过氧化物酶标记二抗由Bioward公司提供;PCR引物由上海Invitrigen公司合成,Trizol、M-MLV反转录酶购自美国Invitrigen公司,其余PT-PCR所需试剂购自美国Promega公司;PCR Marker由广东东盛生物科技有限公司提供;琼脂糖由Bioscience chemie公司提供;其他常用试剂均为国产分析纯。
1.3 主要仪器 Mastercycler gradient 5331 PCR仪、生物分光光度计,德国Eppendorf公司产品;水平电泳仪、电泳槽、垂直电泳仪、电泳槽,美国Bio-Rad公司产品;JS-380C全自动数码凝胶成像分析仪,上海培清科技有限公司产品;Biofuge fresco低温离心机,德国Heraeus公司产品;WH-2微型旋涡混合仪,上海沪西分析仪器厂产品;EC-5型恒温水浴仪,德国Julabo公司产品。
2 实验方法
2.1 3T3-L1细胞的培养和分化 3T3-L1成纤维细胞为梭形,胞浆内无脂滴,培养基为高糖DMEM (10%胎牛血清,1%链霉素-青霉素的双抗)置37 ℃、5% CO2培养箱培养。每2天更换培养基1次,至细胞单层融合达80%以上时,可进行传代培养。用胰蛋白酶1 mL消化细胞1 min,待细胞变圆并从瓶壁上脱落,立即加入含10%胎牛血清的高糖DMEM培养基终止消化。调节细胞浓度为2×105个/mL,接种于24孔板或6孔板中培养。待细胞长满融合后2 d,加入含1 mg/L胰岛素、0.5 mmol/L IBMX、0.25 mmol/L地塞米松的高糖DMEM (含10%胎牛血清)进行分化。2 d后,给予含10 mg/L胰岛素的高糖DMEM (含10%胎牛血清)继续培养2 d。此后给予高糖DMEM(含10%胎牛血清)继续培养。至第8天,95%以上3T3-L1细胞形态变成近圆形,胞浆内充满脂滴,分化成为成熟的脂肪细胞。整个分化过程需要8~12 d。
2.2 分化后3T3-L1细胞的形态和鉴别 分化后的3T3-L1细胞在光镜下可见圆形脂滴,油红O染色可以确定分化后的3T3-L1细胞是脂肪细胞。
采用油红O染色法进行脂肪细胞的鉴定,具体方法如下:①将爬有已分化好的脂肪细胞玻片从培养板中取出,用PBS充分洗涤;②10%福尔马林固定10 min;③PBS漂洗3次;④油红O染液中浸20 min;⑤PBS漂洗4次;⑥60%乙醇漂洗;三蒸水漂洗后,晾干,置于光镜下观察,脂肪细胞中的脂滴呈亮红色。
2.3 实验分组 采用传代10代以内的分化后的3T3-L1脂肪细胞。分为4组:①正常组(Normal);②高密度脂蛋白组(HDL组);③胰岛素组(Insulin组);④胰岛素+高密度脂蛋白组(Insulin+HDL组)。HDL给药剂量通过做浓度梯度后确定。给药时间参照文献。
2.4 给药 实验采用分化后较好的3T3-L1脂肪细胞。细胞给药前,加入无血清的低糖DMEM培养基,于37 ℃、5% CO2培养箱中孵育24 h,使细胞生长同步进入休止期。然后按照分组要求给药。
京东物流作为无界物流的引领者和实践者,以其优异的购物体验广为人们赞誉。从2017年京东物流宣布独立运营,再到不久前京东自主研发的无人大飞机首飞成功,以及无人仓、配送机器人送货的尝试,无一不见证着京东物流的智慧与实力。那么,京东物流目前进行了哪些布局,未来会有哪些举措?在“2018全球智能物流峰会”上京东物流CEO王振辉向记者做了解答。
2.5 葡萄糖消耗量 饥饿24 h后,四组细胞分别给予不同浓度的HDL (0、1、10、100 μg/mL)孵育1 h,取细胞培养液上清,测定其吸光度值;1%Triton-X100裂解细胞,用Bradford法测定蛋白浓度。由此确定HDL的最佳浓度是100 μg/mL。同时,结果显示,HDL可以增加分化后3T3-L1细胞对葡萄糖的消耗,且差异有统计学意义。
2.63H标记的2-脱氧葡萄糖的摄取实验 将分化后的3T3-L1脂肪细胞分组给药,在含0.1% BSA的低糖DMEM中培养24 h,取上清待测。用含0.1% BSA的KRH缓冲液继续培养1 h后,分别加入HDL和胰岛素作用30 min,然后加入3H标记的2-脱氧葡萄糖0.5 μCi/mL培养30 min,处理后的细胞用KRH洗涤2次,取上清液用液体闪烁仪记录放射强度(Counts per minute,CPM)。
2.7 RT-PCR给药处理后的细胞 PBS洗涤3次后,加入1 mL Trizol (Invitrogen),反复吹打,将其转移至EP管中。按照RNA提取说明书提取总RNA。逆转录过程:采用Invitrogen公司M-MLV逆转录酶,并按照试剂盒说明书进行总cDNA的合成。PCR反应采用Taq DNA聚合酶(Promega)。
在Genbank中查找到小鼠的葡萄糖转运体1 (GLUT1)的mRNA序列[基因收录号(NM_011400)],该基因全长2 573 bp;小鼠的葡萄糖转运体4 (GLUT4)的mRNA序列[基因收录号(NM_009204)],该基因全长2 822 bp;小鼠的胰岛素受体(IR)的mRNA序列[基因收录号(NM_010568)],该基因全长9 357 bp;小鼠胰岛素受体底物-1(IRS-1)在Genbank中的mRNA序列[基因收录号(NM_010570)],该基因全长9 163 bp。交于公司合成引物供实验使用。引物序列如下:

GLUT1ForwardATGGAACCACCGCTACReverseTAAGGATGCCAACGACGLUT4ForwardCCGAAAGAGTCTAAAGCGReverseGAGCCACGGTCATCAAGIRForwardTCCGCCGCTCCTATReverseCAGAGTTTCGGGTTGTAATIRSForwardGGATCGTCAATAGCGTAAReverseGCTTGGCACAATGTAGAA
按图1筛选结果。以上引物的最佳退火温度分别为55.7、56.6、52.5、51.5 ℃。
RT-PCR反应产物半定量分析:配制2%的琼脂糖凝胶,用溴化乙锭染色,然后取5 μL PCR产物上样,100 V恒压电泳,凝胶成像系统拍照观察,计算目的条带和内参GAPDH的灰度比值。
2.8 Western blot 给药后各组分别用胰酶消化细胞,收集,用RIPA裂解细胞,提取细胞的总蛋白并用Bradford法测定其各组浓度。之后按以下步骤检测p-IR-β蛋白、p-IRS-1蛋白、p-AKT蛋白和p-AMPK蛋白的表达。①灌胶、上样:其中分离胶10%,浓缩胶5%;②SDS-PAGE电泳:先恒压85 V、20 min,待样品全部进入分离胶后改为恒压110 V、2 h;③转膜:PVDF 膜,转膜条件为4 ℃,恒压110 V,2 h;④封闭:用5%脱脂奶粉封闭液,室温封闭2 h,封闭液用TBST (50 mM Tris-HCl,pH 7.5,150 mM NaCl,0.05% Tween 20)配制;⑤一抗结合:TBST 稀释一抗(p-IR-β抗体滴度为1∶1 000,p-IRS-1抗体滴度1∶1 000,p-AKT抗体滴度为1∶1 000,p-AMPK抗体滴度为1∶1 000,β-actin 抗体滴度为1∶200),4 ℃过夜;⑥洗膜:TBST 漂洗3次,5 min/次;⑦二抗结合:TBST 稀释二抗,室温孵育2 h;⑧洗膜:TBST 漂洗4次,10 min/次;⑨显色:使用化学发光显色试剂进行显色,用成像系统仪器观察拍照。
3 实验结果
3.1 已分化3T3-L1细胞图像 按照实验方法中的步骤对3T3-L1成纤维细胞进行分化,8~12 d后,在倒置显微镜下放大100倍,观察已分化好的3T3-L1脂肪细胞,结果见图2。倒置显微镜下观察可见,3T3-L1前脂肪细胞已经完全分化为成熟的脂肪细胞,细胞形态变成圆形或类圆形,体积变大,胞浆中可见大量透亮的、大小不等的脂滴。多数小脂滴融合成大脂滴,并将胞核推向一侧,形成典型的“戒环”样结构。

图2 已分化3T3-L1细胞图像(100×)
3.2 油红O染色的分化后3T3-L1细胞图像 按照实验方法中的步骤,对已分化的3T3-L1脂肪细胞进行油红O染色,确定细胞内含有大量的脂滴是符合实验要求的脂肪细胞。由图3可见,油红O染色法对成熟的3T3-L1脂肪细胞进行特异性染色,胞浆中可见大量的染成橙红色的脂肪颗粒。

图3 油红O染色的分化后3T3-L1细胞图像(100×)
3.3 葡萄糖试剂盒测定葡萄糖消耗 给予不同浓度HDL (100、10、1 μg/mL),用葡萄糖试剂盒测定葡萄糖消耗量,提示100 μg/mL HDL才能明显促进脂肪细胞对葡萄糖的消耗,其浓度过小时,与Normal组比较差异无统计学意义(P>0.05)。因此,在后续的实验中,HDL的剂量均为100 μg/mL。结果见图4。
由图5可见,HDL (100 μg/mL)组和Insulin (100 nmol/L)促进葡萄糖消耗的能力相当,而 HDL (100 μg/mL)+Insulin (100 nmol/L)组促进葡萄糖消耗的能力强于HDL组或Insulin组。提示HDL和Insulin可能存在协同作用。
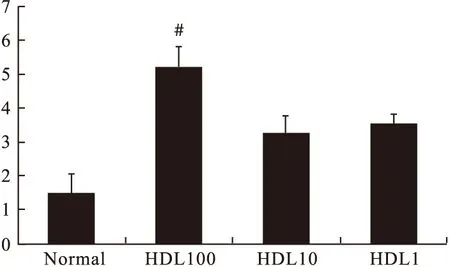
图4 各组葡萄糖消耗量比较(n>3)

图5 各组葡萄糖消耗量比较(n>3)
3.43H标记的2-脱氧葡萄糖显示的葡萄糖摄取 HDL (100 μg/mL)能够促进3T3-L1脂肪细胞对放射性标记的2-脱氧葡萄糖的摄取,与阳性对照组Insulin (100 nmol/L)摄取能力相当,同时,HDL (100 μg/mL)+Insulin (100 nmol/L)组可能通过协同作用促进葡萄糖的摄取。见图6。

图6 各组细胞葡萄糖摄取量比较(n>3)
3.5 PT-PCR检测和葡萄糖转运相关的2个蛋白(GLUT1、GLUT4)及IR-β、IRS-1在RNA水平上的表达 实验均采用5~10代分化状态良好的3T3-L1细胞,饥饿24 h后,分为空白组和给药组HDL (100 μg/mL),孵育4 h,收集细胞,提取RNA。通过RT-PCR法测定给予HDL 4 h后GLUT1、GLUT4、IR-β、IRS-1各蛋白的转录水平。结果显示,HDL组和Normal组比较,脂肪细胞内与葡萄糖转运相关的转运体和蛋白在RNA水平上没有增加。见图7。

图7 两组GLUT1、GLUT4、IR-β、IRS-1蛋白mRNA含量比较(n>3)
3.6 Western blot法检测胰岛素信号途径中蛋白(IR-β、IRS-1)及其下游AKT蛋白的磷酸化情况 给药后10 min收集各实验组细胞。各转运体和蛋白在RNA转录水平没有增加,说明蛋白水平不会增加。因此,笔者检测与葡萄糖转运相关蛋白的磷酸化情况。结果显示,HDL组、Insulin组和HDL+Insulin组各蛋白的磷酸化程度均明显超过Normal组。见图8~图10。
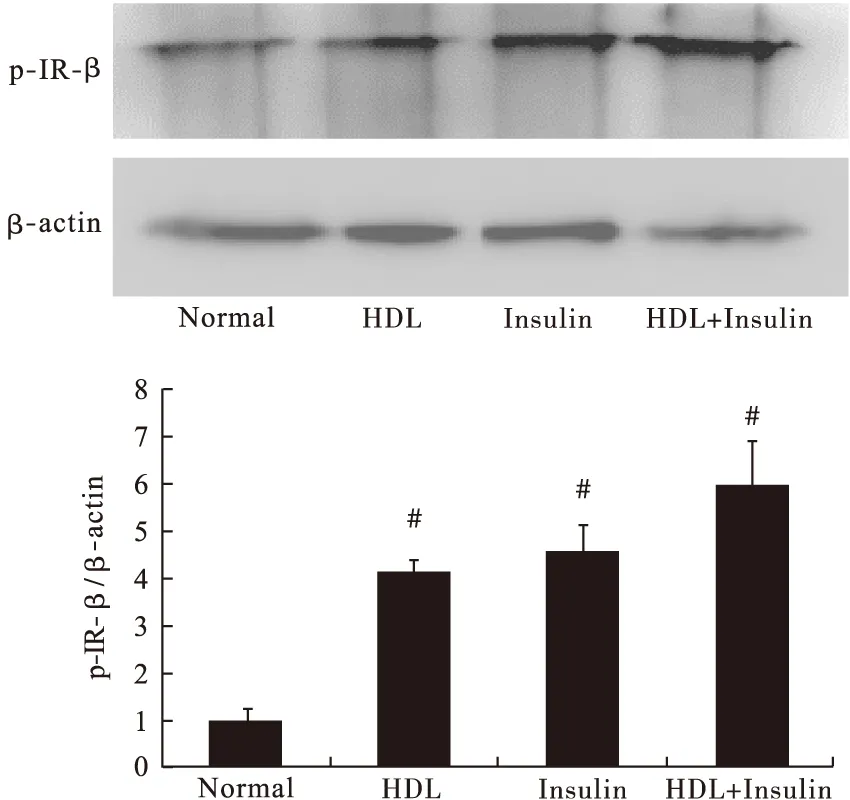
图8 各组IR-β蛋白磷酸化变化(n>3)
3.7 Western blot法检测AMPK蛋白磷酸化情况 HDL组、Insulin组和HDL+Insulin组均出现了AMPK的磷酸化过程,与Normal组比较差异有统计学意义。见图11。

图9 各组IRS-1蛋白磷酸化变化(n>3)
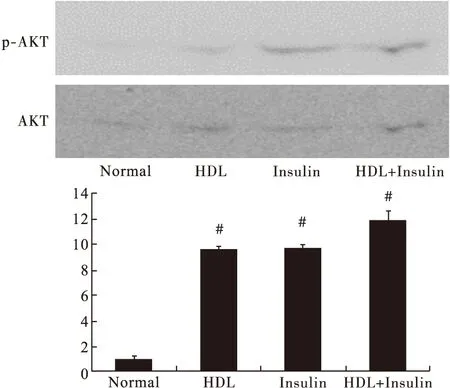
图10 各组AKT蛋白磷酸化变化(n>3)
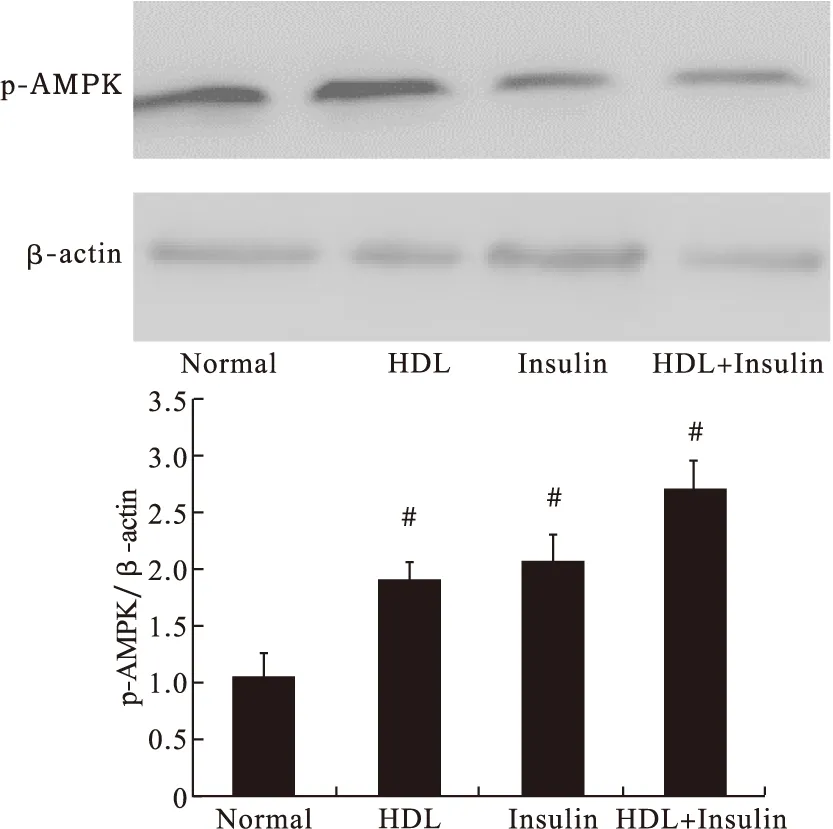
图11 各组AMPK蛋白磷酸化变化(n>3)
4 讨论
胰岛素可以促进葡萄糖摄取,因此,本研究采用胰岛素作为阳性对照组。结果显示,HDL可以浓度依赖性地促进葡萄糖摄取,且HDL浓度为100 μg/mL时对葡萄糖的消耗最大,与10 μg/mL和1 μg/mL比较,差异有统计学意义。因此,后续实验中HDL的给药浓度为100 μg/mL。分组实验显示,HDL组、Insulin组、HDL+Insulin组对葡萄糖的消耗量均明显高于空白组。随后,3H-2-脱氧葡萄糖摄取实验也得到相同的结论。同时,HDL+Insulin组对葡萄糖的消耗和摄取都明显高于HDL组或Insulin组,说明HDL与Insulin可能存在协同作用,与文献报道[6]一致。
RT-PCR研究显示,给予HDL后,转运葡萄糖的2个主要转运体(GLUT1、GLUT4)和经典的胰岛素信号途径中IR-β、IRS-1的RNA转录并没有增加,说明HDL促进葡萄糖消耗和摄取并不是因为转运蛋白生成的增加所致,推测其原因可能是蛋白磷酸化。Western blot结果显示,在HDL促进葡萄糖转运的过程中,IR-β、IRS-1、AKT、AMPK蛋白均发生磷酸化,与对照组相比有显著性差异,表明HDL通过引起蛋白磷酸化通路,而实现葡萄糖的转运过程。
胰岛素信号途径是目前公认的胰岛素促进葡萄糖摄取的信号途径。胰岛素与IR-а结合,激活β亚基的酪氨酸活性。IR-β亚基酪氨酸激酶磷酸化IRS-1蛋白,介导PI3K的P85亚基、生长因子受体结合蛋白-2(Grb-2)、Syp、SHC、Crk、Nck等一系列蛋白[7-9]。而IRS-1通过PI3K途径来调节AKT蛋白[6,8]。AKT作为胰岛素信号途径中的下游分子,参与调节葡萄糖稳态、蛋白合成、细胞存活等生物过程。另外,AKT还影响了一系列的生物学过程,包括代谢、细胞周期的调节和凋亡[10-11]。胰岛素激活的AKT可以刺激脂肪细胞中葡萄糖的摄取[12-14]。此外,普遍的观点认为,胰岛素可通过胰岛素信号途径、AMPK信号途径促进葡萄糖的摄取。有报道,在外周脂肪组织或C2C12肌细胞中,胰岛素刺激可以激活PI3K/AKT和AMPK途径[12,15],促进葡萄糖的转运。本研究中,HDL组、Insulin组、HDL+Insulin组IR-β酪氨酸1146位点、IRS-1丝氨酸307位点、AKT的丝氨酸473位点均出现明显磷酸化,与Normal组相比有显著差异。因此,我们认为,胰岛素信号途径参与了HDL对葡萄糖转运的促进过程。
AMPK广泛存在于哺乳动物的骨骼肌、肝脏、胰腺和脂肪组织中,一直被认为是调控葡萄糖和脂质代谢的能量感受器[16-17]。AMPK是一个由α、β、γ 3个亚基构成的异三聚体,α亚基起催化作用,β、γ亚基在维持三聚体稳定性和作用底物特异性方面起重要作用[18-19]。AMPK-α亚基的苏氨酸172位点磷酸化是其激活的必要条件。有研究表明,AMPK在骨骼肌的能量代谢调节中起重要作用[20]。有报道,机械刺激和电刺激均可以增加肌肉细胞内的AMPK的活性,增加葡萄糖的摄取[21-25]。AMPK可能通过胰岛素信号途径来增加肌肉组织和小鼠的C2C12肌细胞葡萄糖的摄取[26-27]。在3T3-L1细胞中,激活AMPK也可以促进葡萄糖的转运[28]。在内皮细胞,给予外源性HDL诱导的NOS和NO合成也是通过激活AMPK途径来实现的[29-30]。近年来,AMPK作为潜在的缓解组织胰岛素抵抗的靶点,引起了人们的重视。有报道,AMPK激活在诱导脂肪因子分泌中起重要的调节作用[31-32]。本研究显示,在3T3-L1细胞中,给予HDL后,AMPK明显磷酸化而被激活。结果表明,HDL通过胰岛素信号途径和AMPK信号途径促进葡萄糖的转运。
本实验在文献支持的基础上进行研究,通过3T3-L1细胞证实HDL促进葡萄糖转运和摄取,既阐明了现象,又探索了部分机制。同时,我们还有进行进一步研究的空间和需求,有待于在不同的细胞中证实此结论,并探索更多的作用机制来阐明这一现象。
[1]Pickup JC.Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J].Diabetes Care,2004,27(3):813-823.
[2]Schmidt AM.Insulin resistance and metabolic syndrome:mechanisms and consequences[J].Arterioscler Thromb Vasc Biol,2012,32(8):1753.
[3]Rashid S,Genest J.Effect of obesity on high-density lipoprotein metabolism[J].Obesity,2007,15(12):2875-2888.
[4]Hardy OT,Czech MP,Corvera S.What causes the insulin resistance underlying obesity[J].Curr Opin Endocrinol Diabetes Obes,2012,19(2):81-87.
[5]Umemoto T,Han CY,Mitra P.Apolipoprotein AI and high-density lipoprotein have anti-inflammatory effects on adipocytes via cholesterol transporters:ATP-binding cassette A-1,ATP-binding cassette G-1,and scavenger receptor B-1[J].Circ Res,2013,112(10):1345-1354.
[6]Zhang Q,Zhang Y,Feng H.High density lipoprotein (HDL) promotes glucose uptake in adipocytes and glycogen synthesis in muscle cells[J].PLoS One,2011,6(8):e23556.
[7]Varma S,Khandelwal RL.Overexpression of Akt1 upregulates glycogen synthase activity and phosphorylation of mTOR in IRS-1 knockdown HepG2 cells[J].J Cell Biochem,2008,103(5):1424-1437.
[8]Neilsen PM,Pishas KI,Callen DF,et al.Targeting the p53 pathway in Ewing sarcoma[J].Sarcoma,2011,2011:746939.
[9]Pereira BC,Da Rocha AL,Pinto AP,et al.Excessive training impairs the insulin signal transduction in mice skeletal muscles[J].J Endocrinol,2016,230(1):93-104.
[10]Dave S,Kaur NJ,Nanduri R,et al.Inhibition of adipogenesis and induction of apoptosis and lipolysis by stem bromelain in 3T3-L1 adipocytes[J].PLoS One,2012,7(1):e30831.
[11]Yang JY,Della-Fera MA,Rayalam S,et al.Enhanced inhibition of adipogenesis and induction of apoptosis in 3T3-L1 adipocytes with combinations of resveratrol and quercetin[J].Life Sci,2008,82(19-20):1032-1039.
[12]Brendan D,Manning I,Lewis C.Cantley2 AKT/PKB signaling:navigating downstream[J].Cell,2007,129(7):1261-1274.
[13]Calera MR,Martinez C,Liu H,et al.Insulin increases the association of Akt-2 with Glut4-containing vesicles[J].J Biol Chem,1998,273(13):7201-7204.
[14]Kadowaki T,Tamemoto H,Tobe K,et al.Insulin resistance and growth retardation in mice lacking insulin receptor substrate-1 and identification of insulin receptor substrate-2[J].Diabet Med,1996,13(9 Suppl 6):S103-S108.
[15]Yun H,Lee JH,Park CE,et al.Insulin increases glucose transport in C2C12 myotubes and HepG2 cells via activation of AMP-activated protein kinase and phosphatidylinositol 3-kinase pathways[J].J Med Food,2009,12 (5):1023-1028.
[16]Ahn J,Lee H,Kim S,et al.The anti-obesity effect of quercetin is mediated by the AMPK and MAPK signaling pathways[J].Biochem Biophys Res Commun,2008,373(4):545-549.
[17]Drew BG,Fidge NH,Gallon-Beaumier G,et al.High-density lipoprotein and apolipoprotein AI increase endothelial NO synthase activity by protein association and multisite phosphorylation[J].Proc Natl Acad Sci USA,2004,101(18):6999-7004.
[18]Hayashi T,Hirshman MF,Kurth EJ,et al.Evidence for 5′ AMP-activated protein kinase mediation of the effect of muscle contraction on glucose transport[J].Diabetes,1998,47(8):1369-1373.
[19]Vavvas D,Apazidis A,Saha AK,et al.Contraction induced changes in acetyl-CoA carboxylase and 5′-AMP-activated kinase in skeletal muscle[J].J Biol Chem,1997,272(20):13255-13261.
[20]Andreozzi F,Raciti GA,Nigro C,et al.The GLP-1 receptor agonists exenatide and liraglutide activate glucose transport by an AMPK-dependent mechanism[J].J Transl Med,2016,14(1):229.
[21]Mu J,Brozinick JT,Jr Valladares O,et al.A role for AMP-activated protein kinase in contraction- and hypoxia-regulated glucose transport in skeletal muscle[J].Mol Cell,2001,7(5):1085-1094.
[22]Hardie DG,Ross FA,Hawley SA.AMPK:a nutrient and energy sensor that maintains energy homeostasis[J].Nat Rev Mol Cell Biol,2012,13:251-262.
[23]Bijland S,Mancini SJ,Salt IP.Role of AMP-activated protein kinase in adipose tissue metabolism and inflammation[J].Clin Sci (Lond),2013,124:491-507.
[24]Musi N,Goodyear LJ.AMP-activated protein kinase and muscle glucose uptake[J].Acta Physiol Scand,2003,178(4):337-345.
[25]Andrews KL,Moore XL,Chin-Dusting JP.Anti-atherogenic effects of high density lipoprotein on nitric oxide synthesis in the endothelium[J].Clin Exp Pharmacol Physiol,2010,37(7):736-742.
[26]Zachariah Tom R,Garcia-Roves PM,Sjögren RJ,et al.Effects of AMPK activation on insulin sensitivity and metabolism in leptin-deficient ob/ob mice[J].Diabetes,2014,63:1560-1567.
[27]Jensen TE,Schjerling P,Viollet B,et al.AMPK alpha1 activation is required for stimulation of glucose uptake by twitch contraction,but not by H2O2,in mouse skeletal muscle[J].PLoS One,2008,3:e2102.
[28]Yamaguchi S,Katahira H,Ozawa S,et al.Activators of AMP-activated protein kinase enhance GLUT4 translocation and its glucose transport activity in 3T3-L1 adipocytes[J].Am J Physiol Endocrinol Metab,2005,289(4):E643-E649.
[29]Kimura T,Tomura H,Sato K,et al.Mechanism and role of high density lipoprotein-induced activation of AMP-activated protein kinase in endothelial cells[J].J Biol Chem,2010,285(7):4387-4397.
[30]Han L,Yu Y,Sun X,et al.Exendin-4 directly improves endothelial dysfunction in isolated aortas from obese rats through the cAMP or AMPK-eNOS pathways[J].Diabetes Res Clin Pract,2012,97:453-460
[31]Jakobsen SN,Hardie DG,Morrice N,et al.5′-AMP-activated protein kinase phosphorylates IRS-1 on Ser-789 in mouse C2C12 myotubes in response to 5-aminoimidazole-4-carboxamide riboside[J].Biol Chem,2001,276(50):46912-46916.
[32]Yamazaki S,Satoh H,Watanabe T.Liraglutide enhances insulin sensitivity by activating AMP-activated protein kinase in male Wistar rats[J].Endocrinology,2014,155(9):3288-3301.
Effect and mechanism of HDL on glucose transport in 3T3-L1 cells
FU Hong1,RONG You-he2*
(1.Affiliated Hospital of Nanjing University of Traditional Chinese Medicine,Nanjing 210029,China;2.Nanjing University of Traditional Chinese Medicine,Nanjing 210029,China)
Objective To investigate the effect and mechanism of HDL on glucose transport in 3T3-L1 cells.Methods 3T3-L1 cells were cultured and induced to differentiation and maturation.The effect of HDL on glucose transport was studied by glucose consumption test and [3H]-2-deoxyglucose glucose uptake experiment.The mechanism of the effect was explored by Western blot and RT-PCR experiment.Results HDL can promote glucose transport and uptake in 3T3-L1 cells.In this process,the protein did not increase at the RNA transcriptional level,but the phosphorylation of AKT and AMPK proteins appeared.Conclusion HDL stimulates glucose uptake in 3T3-L1 cells,involving PI3K/AKT and AMPK signaling pathways.
HDL;3T3-L1 cell;Glucose transport;Insulin resistance
2016-07-26
1.南京中医药大学附属医院,南京 210029;2.南京中医药大学,南京 210029
*通信作者
10.14053/j.cnki.ppcr.201702002

