吴茱萸致肝毒性后大鼠体内样品的稳定性研究
陈 晨,孙向明,刘 悦,高佳雪,李文兰
(1.哈尔滨商业大学 药学院,哈尔滨 150076;2哈尔滨商业大学 生命科学与环境科学研究中心,哈尔滨 150076)
吴茱萸致肝毒性后大鼠体内样品的稳定性研究
陈 晨1,孙向明2,刘 悦1,高佳雪2,李文兰1
(1.哈尔滨商业大学 药学院,哈尔滨 150076;2哈尔滨商业大学 生命科学与环境科学研究中心,哈尔滨 150076)
为了研究吴茱萸致肝毒性后大鼠血清样品的稳定性,采用HPLC-DAD技术,分别对-20 ℃冰箱中冷冻保存0、3、5、10、15 d未经前处理和经除蛋白处理后的含药血清样品进行色谱分析.通过比较各样品中共有峰相对峰面积的RSD值考察含药血清样品的稳定性.结果表明,经过除蛋白处理后的血清样品的共有峰相对峰面积的RSD值均小于20%;部分未经前处理的血清样品共有色谱峰相对峰面积的RSD值大于30%.含药血清样品经除蛋白和氮气吹干处理后,在-20 ℃至少可以稳定保存15 d;未经前处理的含药血清样品在-20 ℃存放存在不稳定问题.
血清;稳定性;吴茱萸;大鼠
随着中药在东西方国家中日益广泛的应用,有关中药诱发药源性肝损伤(DILI)的报道也逐渐增多[1-4].吴茱萸是一味临床常用的传统中药,历代本草中记载吴茱萸“有毒”或“小毒”,2006年曾有因大剂量服用吴茱萸出现胸闷、头痛、视物不清、剧烈腹痛等症状的个案报道[5].也有学者指出,肝脏是吴茱萸的毒性靶器官之一[6].近年来,关于吴茱萸的化学成分及药理作用的研究已深入到具体的单体成分[7-14],但对其肝毒性部位体内作用过程及机制的研究却鲜有报道.为了揭示吴茱萸在体内的吸收、代谢等过程,常常要采集给药后的大鼠的血液样品,样品的稳定性有待考察;此外,在大规模代谢组学研究中通常伴随批量制样,有些样品可能会被存储一段时间后再进行下一步处理.大批量样品是否必须在采集当天测定,其存储条件对实验结果有何影响,尚无人考察.为此,本文对吴茱萸致肝毒性后大鼠血清样品存储的稳定性进行了初步考察,为吴茱萸在大鼠体内的相关代谢研究提供可靠的参考依据.
1 实验材料
1.1 仪器
Waters-600型液相色谱仪(工作系统包括四元梯度泵、自动进样器、真空脱气机、柱温箱、DAD检测器、Empower化学工作站);台式低温离心机(Avanti30美国BECKMAN);涡旋混合器XW-80A(上海宇工机械有限公司);分析天平(ALC-110.4上海人和科学仪器有限公司)AR1140 Electronic Analytical Balance(Ohaus International Ltd., USA);超声震荡仪(H66MC美国奥豪斯科技有限公司);电热恒温水浴锅(DK-80上海一恒科技有限公司).
1.2 试剂
吴茱萸药材(购自三棵树药材市场天然药材经销部);甲醇(色谱纯,山东禹王);乙腈(色谱纯,山东禹王);甲酸(色谱纯,上海科锐);纯净水(娃哈哈).
1.3 动物
雄性Wistar 大鼠,体重(300±20) g(由哈尔滨医科大学动物中心购入:批号SCXK-(黑)2006-2010).
2 方法与结果
2.1 灌胃溶液的制备
吴茱萸药材粗粉,50%乙醇回流提取,溶剂用量以及提取时间为8倍量120 min(1次)、7倍量90 min(1次),合并2次提取液,减压浓缩,得到浸膏,保存于冰箱备用.给药前,用蒸馏水溶解成约1.4 g生药材/mL的灌胃药液备用.
2.2 含药血清样品的采集
选取Wistar雄性大鼠,将大鼠放于代谢笼中适应性喂养2 d.灌胃给药前称重,按35 g·kg/d(按生药计)的剂量给予大鼠灌胃药液(25 mL/kg),每天1次,连续灌胃给药14 d,灌胃后放回代谢笼中.末次给药60 min后,以2 mL/kg水合氯醛(10%)腹腔注射麻醉,经肝门静脉取血,放置,充分凝血后,以3 000 r/min转速离心15 min,上清液即为含药血清.
2.3 含药血清样品的处理
取含药血清3.0 mL,加入4倍量甲醇,于离心管中充分涡旋混匀1 min,再以4 ℃、14 000 r/min转速离心10 min,小心吸取上清液,氮气吹干,冰箱-20 ℃.用微量移液器精密加入1 mL色谱甲醇充分溶解残留物.经0.22 μm微孔滤膜过滤后,取20 μL进行HPLC色谱分析.
2.4 色谱条件
色谱柱:DIKMA Diamonsil C18(5 μm, 250×4.6 mm);
保护柱:Nova-PakC18Guard-PakTM;
柱温:25 ℃;
进样量:血清20 μL,
流动相:乙腈-0.2%甲酸水溶液;
检测波长:血清300 nm;
梯度洗脱条件:见表1.
表1 流动相梯度变化程序
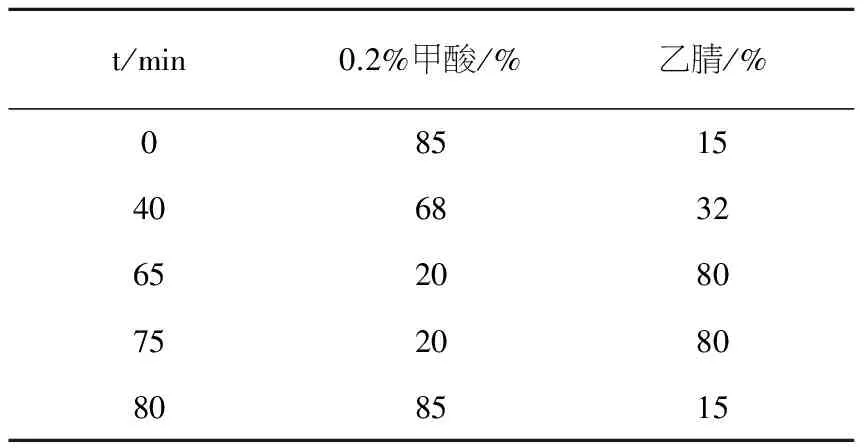
t/min0.2%甲酸/%乙腈/%08515406832652080752080808515
2.5 精密度实验
含药血清样品按“2.3”项下方法处理后,连续进样5次,记录色谱峰,见图1.
图1 精密度实验色谱图
含药血清样品分别以4号峰为参照物峰,计算10个共有色谱峰相对峰面积的RSD值,均小于5%,表明仪器精密度良好.
2.6 重复性实验
取5份含药血清,每份3.0 mL,按“2.3”项下方法处理.5个平行含药血清样品的HPLC色谱图见图2.
图2 重复性实验色谱图
分别计算含药血清平行样品中10个共有色谱峰相对峰面积的RSD值,均小于10%.从以上的结果来看,样品制备方法的重复性良好,样品前处理的方法是可靠的.
2.7 稳定性的考察
2.7.1 样品经前处理后冻存的稳定性考察
该组实验考察样品氮气吹干后的存储时间对样品稳定性的影响.样品前处理步骤如“2.3”项下所示,在氮气吹干溶剂后,将样品存放于-20 ℃下,在各时间点(0、3、5、10、15 d)取出,于25 ℃解冻,继续后面的处理步骤,样品共有峰相对峰面积的RSD值见表2.
表2 除蛋白后冻存的血清样品稳定性实验(相对峰面积)
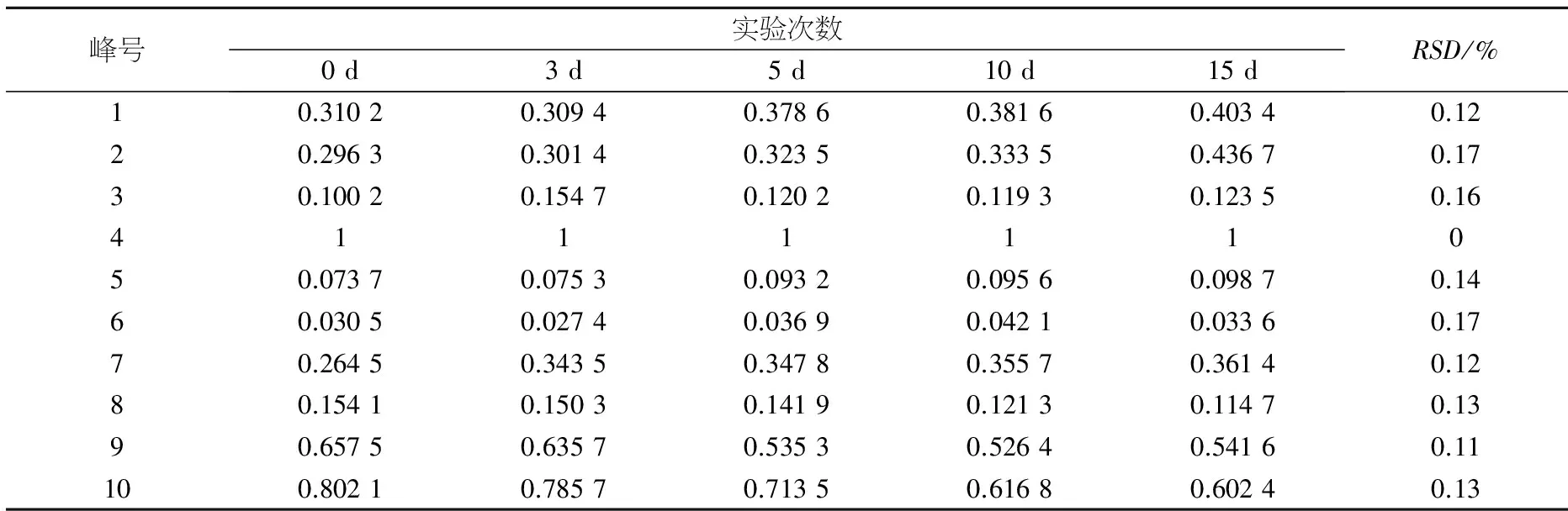
峰号实验次数0d3d5d10d15dRSD/%10.31020.30940.37860.38160.40340.1220.29630.30140.32350.33350.43670.1730.10020.15470.12020.11930.12350.16411111050.07370.07530.09320.09560.09870.1460.03050.02740.03690.04210.03360.1770.26450.34350.34780.35570.36140.1280.15410.15030.14190.12130.11470.1390.65750.63570.53530.52640.54160.11100.80210.78570.71350.61680.60240.13
结果显示,经过处理的含药血清样品氮气吹干后存放于-20 ℃15 d,各时间点样本的10个共有峰相对峰面积的RSD值均小于20%,表明该方法处理的样本15 d内稳定性良好[15-16].
2.7.2 样品未经处理冻存的稳定性考察
该组实验考察样品未经处理冻存的存储时间对样品稳定性的影响.样品于采集当天存放于-20 ℃下,采集方法如“2.2”项下所示,在各时间点(0、3、5、10、15 d)取出,于25 ℃解冻后,按 “2.3”项下方法处理,血清样品共有峰相对峰面积的RSD值见表3.
表3 未经处理冻存的含药血清样品稳定性实验(相对峰面积)
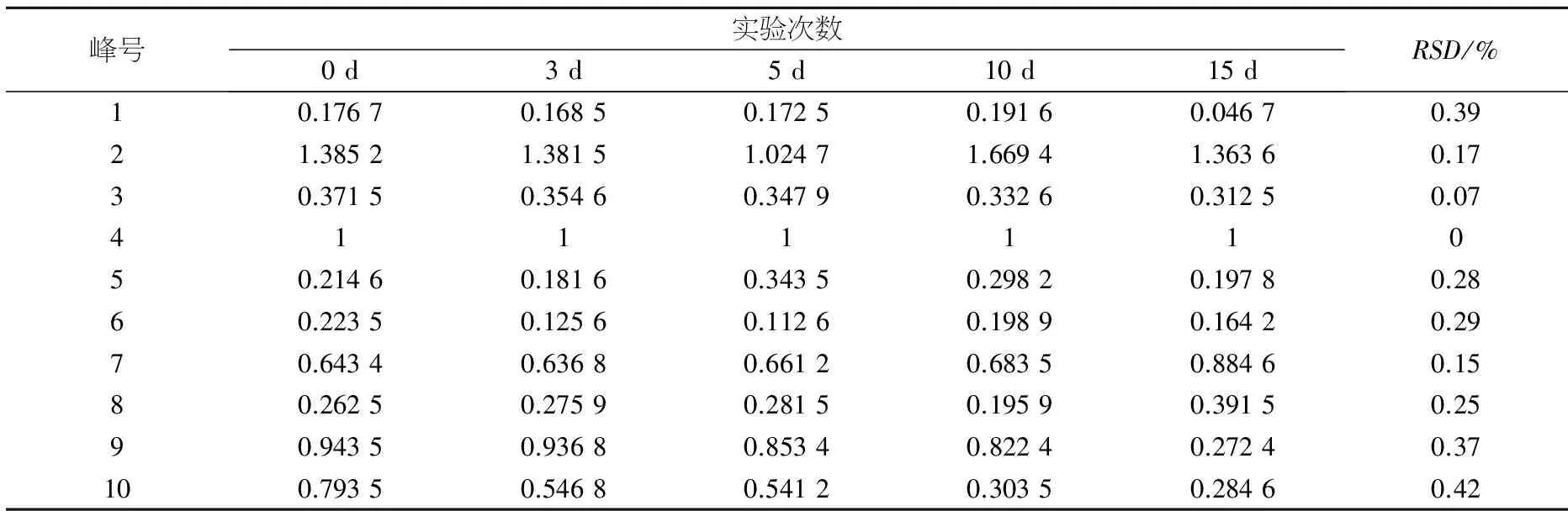
峰号实验次数0d3d5d10d15dRSD/%10.17670.16850.17250.19160.04670.3921.38521.38151.02471.66941.36360.1730.37150.35460.34790.33260.31250.07411111050.21460.18160.34350.29820.19780.2860.22350.12560.11260.19890.16420.2970.64340.63680.66120.68350.88460.1580.26250.27590.28150.19590.39150.2590.94350.93680.85340.82240.27240.37100.79350.54680.54120.30350.28460.42
由表3可见,未经前处理冻存的含药血清10个共有色谱峰中,1、9、10号峰的RSD值均大于30%,表明1、9、10号峰所代表的成分含量具有显著性差异;5、6、8号峰的RSD值分别为28%、29%、25%,表明该三个峰所代表的成分含量有差异;其余共有色谱峰的RSD值均小于20%,表明其余峰所代表的成分含量相对稳定.结果表明,将采集的血清样本不经前处理直接冻存15 d,对部分成分的稳定性会造成比较明显的影响.
3 讨 论
中药成分的代谢规律不明确、代谢产物制备困难等因素都在很大程度上制约了中药在体内的药效物质基础研究.代谢产物的研究在中药体内药效物质方面必不可少,有些中药的代谢产物可能是其发挥药效的重要来源.在大规模代谢组学实验中通常伴随大量样品的采集和检测,有些样品可能会被放置一段时间后再进行下一步处理[16-17].然而,所有影响样品稳定性的因素均有可能对药效物质基础的研究结果产生负面影响.
目前对吴茱萸的化学成分及药理作用研究比较广泛,而关于吴茱萸的肝毒性物质基础尚未见详实研究报道.本实验在前期实验已明确吴茱萸致肝毒性的剂量下,连续给药14 d后对采集到的大鼠血清样本进行稳定性考察.结果表明:除蛋白后的含药血清样品在-20 ℃至少可以稳定保存15 d;未经前处理,将样品冻存在-20 ℃会对含药血清样品产生显著影响.鉴于未经前处理冻存血清样品1、9、10号共有色谱峰相对峰面积的RSD值均大于30%,说明其具有显著性差异,9、10号共有色谱峰的峰面积随时间增长而明显减小,说明其色谱峰所代表的成分含量随冻存时间的增加而减小;5、6、8号峰的RSD值均大于20%,表明该三个峰所代表的成分含量有差异,结果表明血清样品未经前处理冻存的稳定性不好.因此,为了更好的反应数据的真实性,在-20 ℃存储样品时,建议将血清样品除蛋白氮气吹干后进行冷冻储存,最好将大批量实验分成小组进行[18].
[1] TESXHKE R,WOLFF A,FRENZEL C,etal. Herbal hepatotoxicity: a tabular compilation of reported cases [J]. Liver Int, 2012, 32(10): 1543-1556.
[2] WANG J,JI L,LIU H,etal. Study of the hepatotoxicity induced by Dioscorea bulbifera L. rhizome in mice [J]. Biosci Trends, 2010, 4(2): 79-85.
[3] MEIER Y,CAVALLARO M,ROOS M,etal. Incidence of drug induced liver injury in medical inpatients [J]. Eur J Clin Pharmacol, 2005, 61: 135-143.
[4] LARREY D. Epidemiology and individual susceptibility to adverse drug reactions affecting the liver [J]. Seminars in liver Disease, 2002, 22(2): 145-155.
[5] CAI X Y, MENG N, YANG B. Analysis of one case of poisoning caused by taking excessive Evodia rutaecarpa [J]. Beijing Journal of TCM, 2006, 25(3): 171-172.
[6] ZHOU Q, ZHANG Q, JIN R M. Time-effect and Dose-effect of Evodia rutaecarpa on Hepatotoxicity in Mice [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(9): 232-235.
[7] YAN R,WANG Y,SHEN W,etal. Relative determination of dehydroevodiamine in rat plasma by LC-MS and study on its pharmacokinetics [J]. J Chromatogr Sci, 2012, 50(7): 582-585.
[8] XIAO B Y, MAO S J, LI X D. Variations in the composition of Fructus Evodiae after processing with Radix Glycyrrhizae extract [J]. Chin J Integr Med, 2012, 18(10): 782-787.
[9] XU H Y, ZHANG T J, XIAO X F,etal. Simultaneous analysis of thirteen bioactive components in Evodia rutaecarpa and its varieties by HPLC-DAD-MS [J]. Chinese Herbal Medicines, 2010, 2(2): 112-117.
[10] HUANG X, LI W, YANG X W. New cytotoxic quinolone alkaloids from fruits of Evodia rutaecarpa [J]. Fitoterapia, 2012, 83(4): 709-714.
[11] BAO T D ,LI Y J ,WENG X G ,etal. Studies on pharmacokinetics of evodiamine and rutaecarpine in rats plasma after oral administration extracts of evodiae fructus [J]. Journal of Chinese Materia Medica, 2011, 36(24): 3519-3522.
[12] CHEN F,LI S,LI D,etal. Transdermal behaviors comparisons among Evodia rutaecarpa extracts with different purity of evodiamine and rutaecarpine and the effect of topical formulation in vivo [J]. Fitoterapia, 2012, 83(5): 954-960.
[13] HUANG X, ZHANG Y B, YANG X W. Indoloquinazoline alkaloids from Euodia rutaecarpa and their cytotoxic activities [J]. J Asian Nat Prod Res, 2011, 13(11): 977-983.
[14] NOH K,SEO Y M,LEE S K,etal. Effects of rutaecarpine on the metabolism and urinary excretion of caffeine in rats [J]. Arch Pharm Res, 2011, 34(1): 119-125.
[15] BEGLEY P,FRANCIS-MCINTYRE S,DUNN WB,etal. Development and Performance of a gas chromatography-time-of-flight mass spectrometry analysis for large-scale nontargeted metabolomic studies of human serum [J]. Analytical Chemistry, 2009, 81(16): 7038-7046.
[16] DINN W B,BROADHURST D,BEGLEY P,etal.Human Serum Metabolome (HUSERMET) Consortium. Procedures for large-scale metabolic profiling of serum and plasma using gas chromatography and liquid chromatography coupled to mass spectrometry [J]. Nature Protocols, 2011, 6(7): 1060-1083.
[17] DUNN W B,BROADHURST D,ELLIS D I,etal. A GC-TOF-MS study of the stability of serum and urine metabolomes during the UK Biobank sample collection and preparation protocols [J]. International Journal of Epidemiology, 2008, 37(Supplement 1): i23-i30.
[18] HSIEH S Y,CHEN R K,PAN Y H,etal. Systematical evaluation of the effects of sample collection procedures on low-molecular-weight serum/plasma proteome profiling [J]. Proteomics, 2006, 10(6): 3189-3198.
Research on stability of serum sample in hepatic injury rats caused by Evodia Rutaecarpa
CHEN Chen1, SUN Xiang-ming2, LIU Yue1, GAO Jia-xue2, LI Wen-lan1
(1.School of Pharmacy, Harbin University of Commerce, Harbin 150076, China; 2.Research Center on Life Sciences and Environmental Sciences, Harbin University of Commerce, Harbin 150076, China)
To investigate the stability of serum sample in rats with hepatic injury caused by Evodia rutaecarpa, the drug-containing serum samples without pretreatment and that treated with deproteinization method were stored at -20 °C for different time (0 d, 3 d, 5 d, 10 d and 15 d), and then detected by HPLC-DAD, respectively. The stability of the serum sample was evaluated by comparing theRSDvalues of relative peak area of common peaks in each sample. Results indicated that all of theRSDvalues of common peak areas of preprocessed serum samples were less than 20%, and that of untreated samples were partly more than 30%. The serum samples treated with deproteinization method could be stored steadily at -20 °C for 15 d. However, the untreated serum samples are not stable at -20 °C within 15 d.
serum; stability; Evodia rutaecarpa; rat
2015-04-20.
哈尔滨市科技局科技创新人才项目(2015RQXXJ011)
陈 晨(1992-),女,硕士,研究方向:中药药效物质基础
李文兰(1967-),女,硕士,研究方向:中药药效物质基础
R285
A
1672-0946(2017)01-0004-04

