长牡蛎转化生长因子受体基因多态性与生长性状和糖原含量的相关性分析*
陈 钰, 李 琪, 于 红, 孔令锋
(中国海洋大学海水殖教育部重点实验室,山东 青岛 266003)
长牡蛎转化生长因子受体基因多态性与生长性状和糖原含量的相关性分析*
陈 钰, 李 琪**, 于 红, 孔令锋
(中国海洋大学海水殖教育部重点实验室,山东 青岛 266003)
本研究采用PCR-SSCP技术,对长牡蛎(Grassostreagigas)转化生长因子受体基因(Cg-TGF-βRI)编码区单核苷酸多态性(SNP)与来自5个家系316个长牡蛎个体的生长性状(壳高、壳长、壳宽、总体量和软体部量)和糖原含量进行了关联分析。研究表明,在Cg-TGF-βRI基因编码区扩增出的671bp基因片段中检测到4个SNP,其中3个SNP位点(T726C,A741G,A786G)与经济性状相关;A741G和A786G与生长性状和糖原含量均存在显著相关性(P<0.05),T726C仅与壳长和软体部重有显著相关性(P<0.05);3个SNP位点构建得到5个单倍型,H1(TAG)和H4(CAG)单倍型的个体在总体重和软体部重上均显著高于其它3种单倍型的个体。研究结果表明,Cg-TGF-βR I基因多态性影响长牡蛎的生长性状和糖原含量,可用于以后的长牡蛎的分子标记辅助育种和遗传性状的改良。
长牡蛎;转化生长因子受体基因(Cg-TGF-βRI);生长性状;糖原;SNPs
转化生长因子β(Transforming growth factor β,TGF-β)超家族是一组在细胞增殖和分化、细胞黏连、骨质再生、胚胎发生、肿瘤发生等过程中具有重要作用的多功能细胞因子[1]。TGF-β超家族成员通过与细胞表面的特异性受体即转化生长因子受体(Transforming growth factor-βreceptor,TGF-βR)结合而发挥作用[2]。其中TGF-βR I作为一个中介物介导信号在细胞外基质中的传导,从而引起细胞核内基因表达的变化[3]。在哺乳动物的研究中,发现TGF-β可通过诱导糖原合成酶激酶的磷酸化作用,进一步参与该基因的负调控,进而影响糖原的含量[4-5],但在水产动物尚未有TGF-β与糖原含量的相关性报道。目前,在水产动物中已克隆出栉孔扇贝的TGF-βR I基因,并通过表达量分析发现该基因可能参与了肌肉的生长调控[6]。在长牡蛎中也已克隆出转化生长因子受体基因(Cg-TGF-βRI)全序列,并证实编码Cg-TGF-βR I受体蛋白可能在早期胚胎发育过程中发挥重要作用[7]。
长牡蛎(Crassostreagigas)又称太平洋牡蛎,隶属于软体动物门(Mollusca)瓣鳃纲(Bivalvia)牡蛎科(Ostridae)巨蛎属(Crassostrea),是世界上养殖范围最广、产量最高的经济贝类,同时具有怀卵量大、繁殖周期短、生长速度快等生物学特性[8]。在人工选育过程中,可通过与长牡蛎基因效应相关的分子标记辅助育种技术来提高长牡蛎生长率,进而增加牡蛎的产量[9]。同时,长牡蛎作为遗传多样性较高的物种,也为基因多态性分析提供了便利[10]。因此,可通过分析候选基因的单核苷酸多态性(Single nucleotide polymorphisms, SNPs) 及这些多态位点所构建的单倍型,来建立表型性状与候选等位基因多态性之间的关联[11],从而选育出对长牡蛎生长最有利的基因型个体。目前,在长牡蛎中已经分析了包括淀粉酶基因[12]、胰岛素相关多肽基因[13]、胰岛素受体相关基因[14]、糖原磷酸化酶基因[15]在内的多种基因多态性与长牡蛎经济性状的相关性,为分子标记辅助育种方法在改良长牡蛎生长及肉质性状的应用奠定了良好的基础。
本研究以长牡蛎转化生长因子受体基因作为候选基因,利用单链构象多态性技术(Single strand conformation polymorphism,SSCP)结合测序方法进行长牡蛎SNPs的分型和筛选,分析了Cg-TGF-βRI基因单核苷酸多态性与长牡蛎生长和糖原含量性状之间的相关性,旨在为长牡蛎的遗传改良提供理论依据。
1 材料与方法
1.1 实验材料与DNA提取
2009年6月从威海长牡蛎养殖群体中选取性腺发育成熟的个体作为亲贝,采用平衡巢式设计构建36个全同胞家系。稚贝附着后,将各家系装至扇贝笼中,并挂至乳山海区养成。各组悬挂水层及区域一致,并按长牡蛎养成规范进行管理,尽量减小环境误差,以保证所构建的全同胞家系均饲养于相同条件下。2011年选取5个全同胞家系(027、028、029、032和034),取样个数分别为66、66、61、58和65,共计316个2龄长牡蛎[15],测定各个体生长数据(壳高(71.50±10.54)mm;壳长(45.07±7.50)mm;壳宽(23.86±4.50)mm;总质量(36.83±14.48)g;软体部重(4.95±2.08)g)和糖原含量(见表1)。糖原含量的测定采用蒽酮比色法[16],取经过冷冻干燥处理后的长牡蛎性腺组织30mg,加入3mL 30%的氢氧化钾溶液,混匀后放于100℃沸水浴30min,迅速放于冰上冷却;取5μL冷却液稀释至0.5mL,加入5mL冷却的0.2%蒽酮-硫酸溶液,混匀后进行沸水浴,10min后取出迅速冷却;在可见分光光度计620nm波长下进行比色,测其吸光度值;以100μg/mL的葡萄糖溶液作为标准,制作标准曲线,并根据测得的吸光度值对应换算出样品的糖原含量。
采集闭壳肌组织放于无水乙醇中,-20℃保存。用苯酚-氯仿法[17]提取长牡蛎闭壳肌组织DNA,在1%琼脂糖凝胶电泳中检测DNA质量和浓度,溶于TE中-20℃保存。
1.2 引物设计与PCR扩增
参考长牡蛎Cg-TGF-βRI基因cDNA序列(GenBank登录号AJ427419),在长牡蛎基因组范围内设计能扩增出671bp的4对特异性引物(TGF1-TGF4)(见表2)。PCR反应程序:94℃变性5min;94℃变性1min,退火温度52~64℃1min,72℃延伸1min,35个循环;72℃延伸10min,循环结束后4℃保存。整个反应用10μL体系:DNA模版100ng,引物1μmol/L,1×PCR buffer,2mmol/L MgCl2,0.2mmol/L dNTP和0.25UTaqDNA聚合酶(TaKaRa)。PCR产物用1.5%琼脂糖凝胶电泳检测,并用0.5ng/μL的溴化乙锭染色。
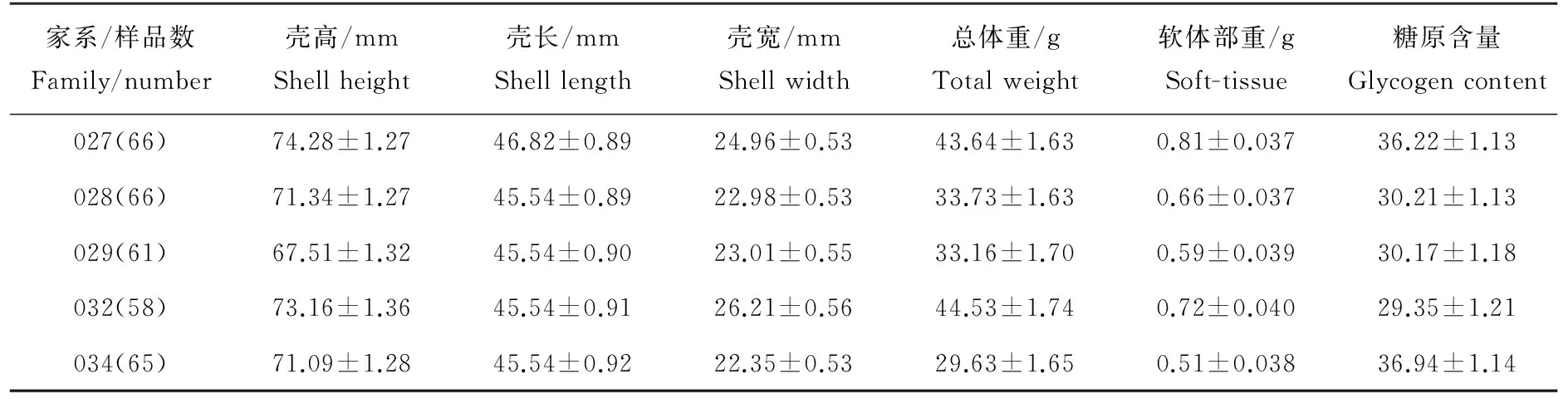
表1 5个长牡蛎家系生长数据和糖原含量Table 1 The growth trait and glycogen content of five Crassostrea gigas families

表2 引物序列Table 2 Sequences of primers
1.3 SSCP电泳及测序
向扩增片段与目的片段大小一致且特异性好的PCR产物中加入等量变性剂(98%去离子甲酰胺,0.25%二甲苯菁,0.25%溴酚蓝,10mmol/L EDTA),98℃变性10min后立即冷却,直至上样时取出,以防止复性。电泳采用丙烯酰胺/N,N′-甲叉双丙烯酰胺(29∶1)的非变性聚丙烯酰胺凝胶(10%~12%),置于4℃,以100V电泳16~18h后银染。结合SSCP条带分型,随机选择3个以上具有相同电泳条带的个体进行纯化测序,从而确定各个体的基因型。
1.4 数据分析
采用SAS9.1统计分析软件GLM模块进行统计,并采用Bonferroni多重比较分析各个SNPs及其单倍型与生长性状的关联性。对于多位点SNP单倍型与性状的关联分析,首先利用PHASE 2.1软件将与性状相关联的SNPs构建成单倍型,再通过构建一般线性模型:Y=μ+G,H+e(Y是性状观察值,μ是群体表型均值,G是个体基因型效应,H是单倍型效应,e是随机误差)分析各基因型及其单倍型的差异显著性(差异显著P<0.05,极显著P<0.01)。
2 结果与分析
2.1 基因型鉴定
本研究成功设计了4对特异性引物,扩增出覆盖Cg-TGF-βRI基因cDNA全长的671 bp的基因组DNA片段,共检测到的4个SNP位点(A471C、T726C、A741G、A786G)均位于编码区,且都为无义突变,其中在TGF-2中检测到3个SNP,在TGF-1中只检测到1个SNP,其余片段均未发现SNP。TGF-1和TGF-2两对引物PCR扩增产物的SSCP电泳带谱如图1所示。
2.2 长牡蛎Cg-TGF-βRI基因多态性与经济性状的关联分析
通过显性遗传效应模型分析,发现长牡蛎Cg-TGF-βR I基因中有3个SNP与长牡蛎生长性状和糖原含量相关(见图2)。3个SNP位点在5个家系中各等位基因的频率如表3所示。因为家系间的差异,导致有的家系只有一个等位基因,同时在3个家系检测到哈迪-温伯格平衡的偏离,可能与不同基因型的个体存活率存在差异有关。表4显示了Cg-TGF-βRI基因3个SNP与生长性状和糖原含量关联分析的结果。在位点T726C,CT基因型个体的壳长和软体部重均显著高于基因型为TT的个体(P<0.05)。在位点A741G,AG基因型个体的生长性状指标和糖原含量均显著高于GG基因型的个体(P<0.05),其中AG基因型个体的壳宽、总重量和软体部重极显著高于GG基因型(P<0.01)。在位点A786G,AG基因型个体的糖原含量显著高于GG基因型的个体,而壳高显著高于AA基因型的个体(P<0.05);GG基因型的个体在壳长、壳宽、总体质量和软体重方面均显著高于AA基因型的个体(P<0.01)。T726C和A741G位点仅存在2种基因型,可能是由于基因与环境的互作效应导致相关的基因型在自然选择过程中被逐步淘汰。
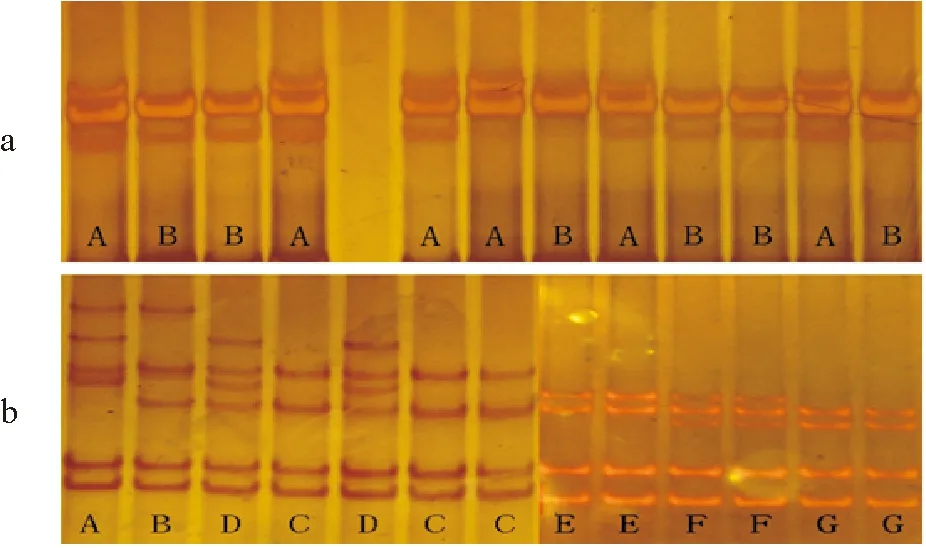
(a:引物TGF-1的扩增片段SSCP带谱,其中条带B代表与GenBank accession no.AJ427419序列相同的纯合子,条带A代表杂合子;b:引物TGF-2的扩增片段SSCP带谱,条带C代表与GenBank accession no.AJ427419序列相同的纯合子,其余条带代表不同组合的杂合子。a: SSCP pattern of primer TGF-1, band B indicates the homozygote, consistent sequence of GenBank accession no. AJ427419, band A indicates the heterozygote; b: SSCP pattern of primer TGF-2, band C indicates the homozygote, consistent sequence of GenBank accession no. AJ427419, the other bands indicate heterozygotes.)
图1Cg-TGF-βRI基因引物扩增片段的SSCP电泳带谱
Fig.1 SSCP band patterns for two primers ofCg-TGF-βRIgene
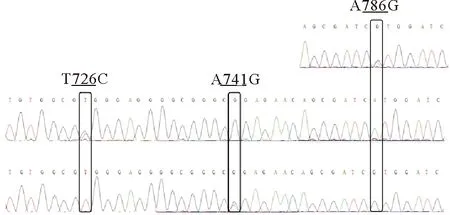
图2 与表型性状相关联的不同基因型的测序结果Fig.2 Sequencing result of different genotypes associated with the phenotypic traits
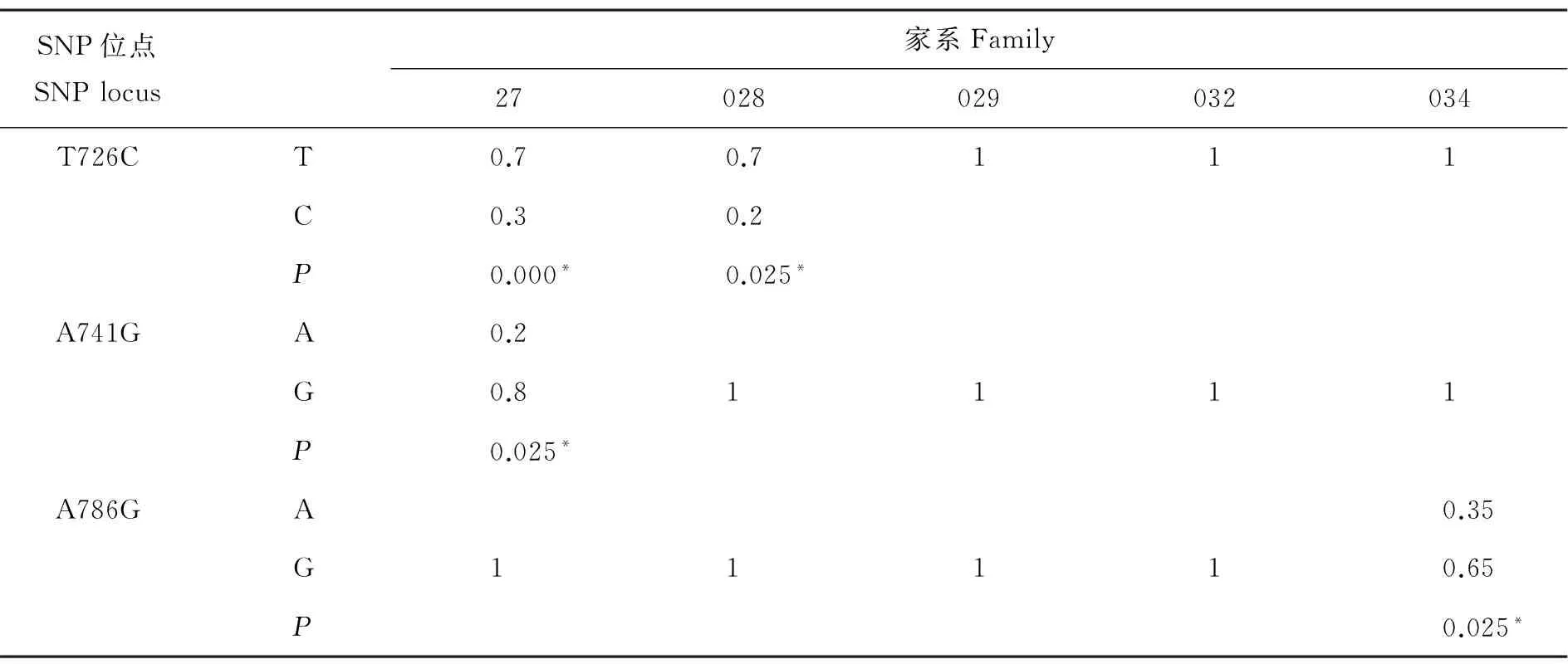
SNP位点SNPlocus家系Family27028029032034T726CT0.70.7111C0.30.2P0.000*0.025*A741GA0.2G0.81111P0.025*A786GA0.35G11110.65P0.025*
注:哈迪-温伯格平衡偏离水平,*P<0.05。
Note:Significance of Hardy-Weinberg departure, *P< 0.05.
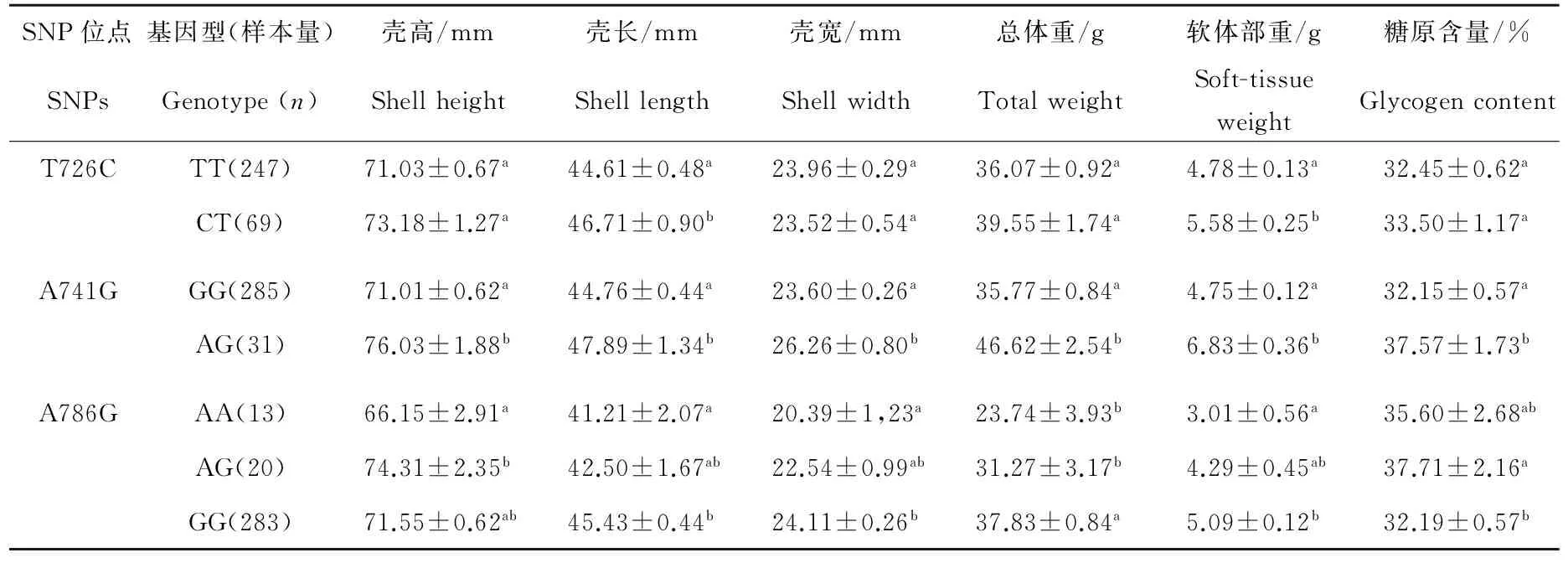
表4 长牡蛎中Cg-TGF-βR I基因3个SNPs与生长性状以及糖原含量的关联分析Table 4 Association analysis of the three SNP genotypes with growth performance and glycogen content at C. gigas Cg-TGF-βR I gene
注:同一列标不同字母表示差异显著(P<0.05)。
Note: Means of different superscript letters within the same column indicates significant difference at 5% level.
2.3 长牡蛎Cg-TGF-βRI基因SNPs单倍型与经济性状的关联分析
利用PHASE2.1软件预测的Cg-TGF-βRI基因SNP单倍型共有5种,频率大于1%的5种单倍型与长牡蛎生长性状进行关联分析(见表5)。最小二乘法线性拟合结果表明,所构建的单倍型与糖原含量、壳宽、总重和软体部重存在极显著关联(P<0.01)。单倍型为H3(TGA)的个体在壳长、壳宽、总体重和软体部重方面均显著低于其他单倍型的个体;而H1(TAG)和H4(CAG)单倍型的个体在总体重和软体部重上均显著高于H2(TGG)、H3(TAG)和H5(CGG)单倍型的个体(P<0.05)。其中,在糖原含量上,单倍型H1(TAG)、H3(TGA)和H2(TGG)两两之间有极显著差异(P<0.01),H1(TAG)和H5(CGG)之间有显著差异(P<0.05)。在壳高方面,H2(TGG)和H4(CAG)之间,H3(TAG)和H4(CAG)之间均表现出显著差异性(P<0.05)。在壳长方面,H3(TAG)单倍型的个体均显著低于其它单倍型的个体,其中除了与H1(TAG)有显著差异外(P<0.05),其他均为极显著差异(P<0.01)。在壳宽方面,H1(TAG)单倍型的个体均显著大于H2(TGG)、H3(TAG)、H5(CGG)单倍型的个体(P<0.05),并且H3(TGA)单倍型的个体在壳宽上极显著低于H1(TAG)、H2(TGG)和H4(CAG)单倍型的个体(P<0.01)。在总体重和软体部重性状方面,H3(TGA)单倍型的个体均显著低于其他5种单倍型的个体,而且H1(TAG)和H4(CAG)单倍型的个体显著高于H2(TGG)、H3(TAG)和H5(CGG)这3类单倍型的个体(P<0.05),其中在软体部质量方面,仅H4(CAG)和H5(CGG)2种单倍型的个体间存在显著差异(P<0.05),其余均为极显著差异(P<0.01)。
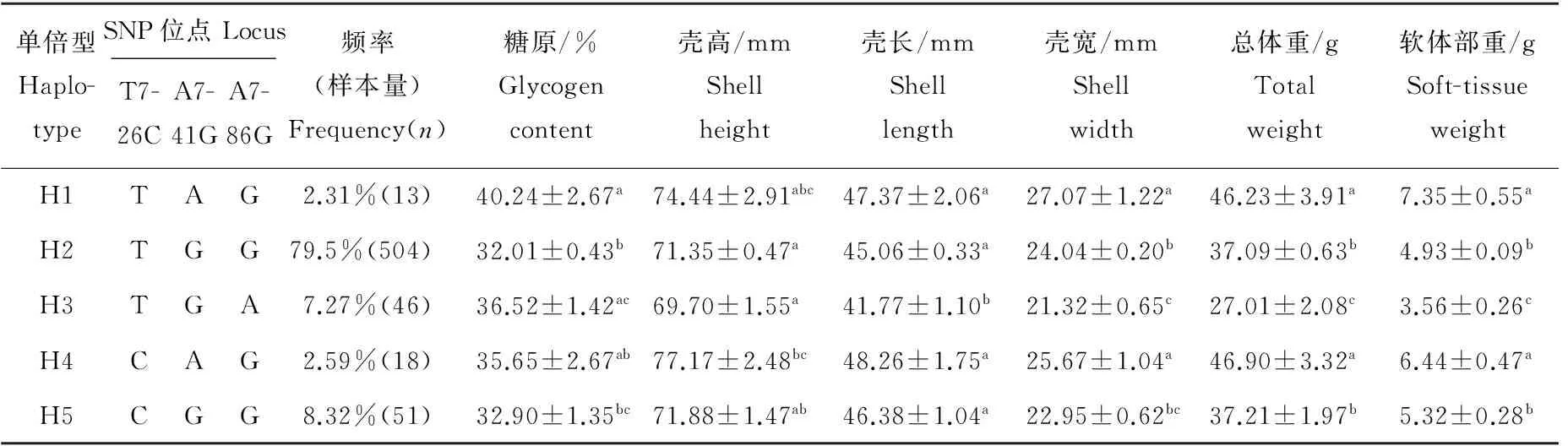
表5 Cg-TGF-βR I基因单倍型与长牡蛎生长性状与糖原的关联分析Table 5 Association between haplotypes of Cg-TGF-βR I gene and growth trait and glycogen content of C. gigas
注:同一列不同上标字母表示SNP单倍型各性状的差异显著性(P<0.05)。
Note: Values with different superscript letters within a column of every SNP haplotype are significantly different at 0.05 level.
3 讨论
遗传变异是水产动物进行长期遗传改良的基础,因此保护和有效利用遗传资源对水产养殖业的可持续发展有重要意义[18]。一般而言,对于长牡蛎这类具有群居习性且繁殖力强的有效群体来说极有可能有丰富的遗传多态性。刘思玮等[15]在糖原磷酸化酶基因的研究中检测到的SNP平均密度为1/25,Cong等[13,14]在长牡蛎胰岛素受体相关受体基因(IRR)的多态性研究中发现上述基因的SNP平均密度为1/80,在长牡蛎胰岛素相关多肽基因(OIRP)中SNP平均密度为1/40。本研究在共671bp的长牡蛎生长转化因子受体基因中共检测到4个SNP位点,SNP平均密度为1/167bp,明显低于之前的研究结果。而且在栉孔扇贝TGF-βRI受体基因的非编码区中也仅筛查到1个SNP[6]。导致TGF-βRI受体基因单核苷酸多态性如此低的原因可能是由于自然选择对于基因的选择作用,也可能是由于该基因在进化上相对保守使得变异度降低。因此,针对不同的基因而言,SNP的频率不尽相同,需要综合考虑各方面的因素。本研究中SNP频率较低可能是由于候选基因本身存在差异性,并且也应考虑基因和环境的互作效应。检测到的SNP位点在部分家系中由于缺乏多态性,无法检测到与表型的相关性。这可能是因为从各家系中选取的2龄长牡蛎,由于不同基因型个体生存能力不同,从而导致部分家系中等位基因多态性的缺失以及哈迪-温伯格平衡的偏离。长牡蛎较高的遗传负荷,在以往的研究中已有报道。Launey和Hedgecock[19]发现偏分离比例在长牡蛎早期幼虫阶段最低,随着生长发育而逐渐增加,指出高遗传负荷是导致偏分离增加的原因,并且支持某些等位基因由于和致死基因连锁而受到选择的理论。由于家系间基因型存在显著的差异,利用单个家系难以检测到基因型与表型的相关,因而本研究中将各家系合并成混合群体进行SNP及其单倍型与生长性状的关联性分析。然而,采用遗传背景差异较大的家系组成的混合群体,可能会产生群体分层现象,一定程度上干扰关联分析的准确性。
相关研究表明,TGF-β信号通路可以诱导特定类型细胞生长的停滞[20-21]。特别是在肌细胞中通过抑制肌细胞特异基因的表达,进而抑制肌肉形成。目前,在长牡蛎Cg-TGF-β基因研究中,发现该基因在各个发育时期都有表达,其中唇瓣和鳃中的表达量相对较高[22]。在相关TGF-βRI基因研究中,发现栉孔扇贝和长牡蛎中可能存在与哺乳动物类似的TGF-β信号通路,而且分析出TGF-βR I表达量和横纹肌量的负相关性[6,7]。以上研究都表明了TGF-βRI基因不仅在在动物体的各个发育时期都具有功效,而且对于肌肉生长调控发挥重要作用。因此,查找Cg-TGF-βRI基因编码区SNP可以全面分析基因多态性在影响蛋白修饰过程中的作用,进而将会更有效地研究该基因与生长性状的相关性,有利于从分子生物学方面对长牡蛎早期苗种进行选择,进而发挥分子标记在辅助育种技术中的作用。
本研究通过对长牡蛎5个家系共316个个体的生长性状和糖原含量与Cg-TGF-βRI基因内筛查到的SNP位点相关性进行分析,获得3个与表型性状相关联的SNP位点(T726C,A741G和A786G)。所检测到的SNP位点均并未引起氨基酸的改变。此类同义多态性可能通过影响mRNA的拼接、稳定性、结构和蛋白质折叠,从而间接影响蛋白质的功能[23]。也会通过控制转录来影响基因的表达水平。这3个SNP位点构建成的5个SNP单倍型中,H1(TAG)和H4(CAG)单倍型个体的总体量和软体部重(分别为46.23、46.90和7.35、6.44)均显著高于其它3种单倍型H2(TGG)、H3(TAG)和H5(CGG)的个体(P<0.05),表明H1(TAG)和H4(CAG)单倍型是对长牡蛎的生长最为有利的单倍型,证实了在长牡蛎的转化生长因子受体基因对于长牡蛎生长发育具有极为重要的作用。在糖原含量方面,H1(TAG)单倍型的个体显著高于H2和H5单倍型的个体,表明该基因可能参与糖原含量的调控,为确认这种关系的可靠性,需要进一步分析该基因在调节糖原代谢中的生理作用。
4 结论
本实验研究了长牡蛎Cg-TGF-βR I基因多态性,获得了3个与生长性状相关的SNP位点,并首次证实了单核苷酸多态性影响长牡蛎生长性状和糖原含量。在获得的5个单倍型中,发现H1(TAG)单倍型相对有利于长牡蛎的生长,为今后分子标记辅助育种技术的应用提供了有力的工具。同时,证实了编码区的基因突变会导致生长性状的改变,从而表明Cg-TGF-βRI基因可作为候选基因来应用于今后长牡蛎的遗传改良。
[1] 李翠玲. 转化生长因子β分子生物学研究进展[J]. 国外医学免疫学分册, 1995, 18(3): 124-127. Li C L. Transforming growth factor beta research progress of molecular biology[J]. Foreign Medical Sciences Section of Immunology, 1995, 18(3): 124-127.
[2] Hu P P, Datto M B, Wang X F. Molecular mechanisms of transforming growth factor-β signaling[J]. Endocrine Reviews, 1998, 19(3): 349-363.
[3] 李京红. 转化生长因子β受体研究进展[J]. 国外医学生理、病理科学与临床分册, 1998, 18(1): 28-30. Li J H. Transforming growth factor beta research progress. foreign medical sciences[J]. Pathophysiology and Clinical Medicine, 1998, 18(1): 28-30.
[4] Fang H, Zhou J L, Liu J W, et al. Glycogen synthase kinase-3β negatively regulates TGF-β1 and Angiotensin II-mediated cellular activity through interaction with Smad3[J]. Molecular and Cellular Pharmacology, 2010, 644(1-3): 17-23.
[5] Dai C S, Wen X Y, He W C, et al. Inhibition of proinflammatory RANTES expression by TGF-β1 is mediated by glycogen synthase kinase-3β-dependent β-catenin signaling[J]. Journal of Biological Chemistry, 2011, 268(9): 7052-7059.
[6] Guo H H, Bao Z M, Li J Q, et al. Molecular characterization of TGF-β type I receptor gene (Tgfbr1) inChlamysfarreri, and the association of allelic variants with growth traits[J]. Plos One, 2012, 7(11): 51005.
[7] Herpin A, Lelong C, Becker T, et al. Structural and functional evidences for a type 1 TGF-βsensustrictoreceptor in the lophotrochozoanCrassostreagigassuggest conserved molecular mechanisms controlling mesodermal patterning across bilateria[J]. Mechanisms of Development, 2005, 122(5): 695-705.
[8] 肖述, 喻子牛. 养殖牡蛎的选择育种研究与实践[J]. 水产学报, 2008, 32(2): 287-295. Xiao S, Yu Z N. Review of selective breeding research and practice in oyster cultivation[J]. Journal of Fisheries of China, 2008, 32(2): 287-295.
[9] Swan A A, Thompson P A, Ward R D. Genotype × environment interactions for weight in Pacific oysters (Crassostreagigas) on five Australian farms[J]. Aquaculture, 2007, 265(1-4): 91-101.
[10] Morris R W, Kaplan N L. On the advantage of haplotype analysis in the presence of multiple disease susceptibility alleles[J]. Genetic Epidemiology, 2002, 23(3): 221-233.
[11] Vignal A, Milan D, SanCristobal, M. et al. A review on SNP and other types of molecular markers and their use in animal genetics[J]. Genetics Selection Evolution, 2002, 34: 275-306.
[12] Prudence M, Moal J, Boudry P, et al. Anamylasegene polymorphism is associated with growth differences in the Pacific cupped oysterCrassostreagigas[J]. Animal Genetics, 2006, 37(4): 348-351.
[13] Cong R H, Li Q, Kong L F. Polymorphism in the insulin-related peptide gene and its association with growth traits in the Pacific oysterCrassostreagigas[J]. Biochemical Systematics and Ecology, 2013, 46: 36-43.
[14] Cong R H, Kong L F, Yu H, et al. Association between polymorphism in the insulin receptor-related receptor gene and growth traits in the Pacific oysterCrassostreagigas[J]. Biochemical Systematics and Ecology, 2014, 54: 144-149.
[15] 刘思玮, 李琪, 于红, 等. 长牡蛎糖原磷酸化酶基因 SNPs 与生长性状和糖原含量的相关性分析[J]. 中国水产科学, 2013, 20(3): 481-489. Liu S W, Li Q, Yu H, et al. Single nucleotide polymorphisms in glycogen phosphorylase gene and their association with growth performance and glycogen content in Pacific oysterCrassostreagigas[J]. Journal of Fishery Sciences of China, 2013, 20(3): 481-489.
[16] Horikoshi H. Glycogen[J]. Chem Field, 1958, 34: 36-39.
[17] Li Q, Yu H, Yu R H. Genetic variability assessed by microsatellites in cultured populations of the Pacific oyster (Crassostreagigas) in China[J]. Aquaculture, 2006, 259(1): 95-102.
[18] Guo X M. Use and exchange of genetic resources in molluscan aquaculture[J]. Reviews in Aquaculture, 2009, 1(3-4): 251-259.
[19] Launey S, Hedgecock D. High genetic load in the Pacific oysterCrassostreagigas[J]. Genetics, 2001, 159: 255-265.
[20] Feng X H, Derynck R. Specificity and versatility in TGF-β signaling through Smads[J]. Cell and Developmental Biology, 2005, 21: 659-693.
[21] Massagué J, Seoane J, Wotton D. Smad transcription factors[J]. Genes & Development, 2005, 19: 2783-2810.
[22] Lelong C, Badariotti F, Quéré H L, et al. Cg-TGF-β, a TGF-β/activin homologue in the Pacific oysterCrassostreagigas, is involved in immunity against Gram-negative microbial infection[J]. Developmental and Comparative Immunology, 2007, 31: 30-38.
[23] Hunt R, Sauna Z E, Ambudkar S V, et al. Silent (synonymous) SNPs: should we care about them ?[J]. Methods in Molecular Biology, 2009, 5: 23-39.
责任编辑 朱宝象
Polymorphism of Transforming Growth Factor β ReceptorⅠGene and Its Association with Growth Traits and Glycogen Content in Pacific Oyster Crassostrea gigas
CHEN Yu, LI Qi, YU Hong, KONG Ling-Feng
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
We evaluated the effect of the polymorphism of Pacific oyster (Crassostreagigas) transforming growth factor β receptor I gene (Cg-TGF-βRI) on the growth traits and glycogen content through PCR-SSCP analysis. Polymorphism ofCg-TGF-βRIwas examined for its association with the growth performance (shell height, shell length, shell width, total weight and soft-tissue weight) of 316 oyster individuals from five full-sib families. Four single nucleotide polymorphisms (SNPs) were revealed in 671 bp ofCg-TGF-βRIgene. Of them, two SNPs (A741G and A786G) were significantly associated with the growth traits and glycogen content (P<0.05), while another one (T726C) significantly associated with shell length and soft-tissue weight. Furthermore, among the five SNP haplotypes constructed using these three SNPs, the total weight and the soft-tissue weight of the individuals with the haplotype H1(TAG) and H4(CAG) ofCg-TGF-βRIwas significantly higher than those with the other three (P<0.05), suggesting that the two haplotypes may be the most advantageous in terms of weight gain inC.gigas, and may serve as genetic markers for fast growth in oyster breeding.
Crassostreagigas; transforming growth factor β receptor I gene; growth performance; glycogen; SNPs
国家公益性行业科研专项(201305005);国家自然科学基金项目(31372524);山东省农业良种工程项目资助 Supported by National Marine Public Welfare Research Program(201305005);National Natural Science Foundation of China(31372524); Agriculture for Project Funding of Shandong Province
2015-11-01;
2016-04-20
陈 钰(1989-),女,硕士生,从事水产动物遗传育种学研究。E-mail:chenyuxielei@126.com
** 通讯作者:E-mail:qili66@ouc.edu.cn
S968.3
A
1672-5174(2017)03-027-07
10.16441/j.cnki.hdxb.20150375
陈钰, 李琪, 于红, 等. 长牡蛎转化生长因子受体基因多态性与生长性状和糖原含量的相关性分析[J]. 中国海洋大学学报(自然科学版), 2017, 47(3): 27-33.
CHEN Yu, LI Qi, YU Hong, et al. Polymorphism of transforming growth factor β receptorⅠgene and its association with growth traits and glycogen content in pacific oysterCrassostreagigas[J]. Periodical of Ocean University of China, 2017, 47(3): 27-33.

