乳化剂Span 80对乳液静电纺PCL纤维担载盐酸四环素能力的影响
彭 晓, 丁 辛, b, 林 刚, 胡吉永, b, 杨旭东, b
(东华大学 a. 纺织面料技术教育部重点实验室;b. 纺织学院,上海 201620)
乳化剂Span 80对乳液静电纺PCL纤维担载盐酸四环素能力的影响
彭 晓a, 丁 辛a, b, 林 刚a, 胡吉永a, b, 杨旭东a, b
(东华大学 a. 纺织面料技术教育部重点实验室;b. 纺织学院,上海 201620)
以高聚物聚己内酯(PCL)溶解在三氯甲烷中作为油相,水溶性盐酸四环素(Tet)溶解在蒸馏水中作为水相,加入不同质量的失水山梨糖醇单油酸酯(Span 80)作为乳化剂,利用乳液静电纺丝制备皮芯结构的PCL/Tet载药纤维.观察纤维形貌、纤维内部Tet的分布情况和皮芯结构形成,计算纤维载药量和包封率,研究Span 80对纤维担载Tet能力的影响.研究结果表明:不加Span 80的乳液制备的PCL/Tet载药纤维膜具有很低的载药量和包封率,Span 80质量分数在0.5%~2.0%内,纤维具有完整的皮芯结构,药物被包裹在纤维芯层;随着Span 80质量分数的增加,纤维的皮层厚度有增加的倾向,芯层的药物减少,纤维的载药量和包封率则下降.
聚己内酯; 盐酸四环素; 乳液静电纺丝; 载药纤维; 载药量; 包封率
乳液静电纺纤维载药支架,作为一种新型的载药手段被广泛关注.采用油包水(W/O)[1]或水包油(O/W)[2]的乳液,通过静电纺能够得到皮芯结构的纳米纤维,同时保证包埋在芯层药物的结构稳定性和生物活性.目前应用乳液静电纺已经成功包埋了蛋白质、抗生素、核酸和抗癌类等药物[3-8].
提高纤维的药物担载能力是乳液静电纺载药的主要挑战之一,衡量纤维担载药物能力的指标是载药量和包封率.纤维对药物的担载能力取决于药物与高聚物纤维的亲和性、药物在纤维中的分布以及纤维结构完整性等因素.纤维担载药物效果与聚合物、药物、纺丝工艺等相关.利用乳液静电纺制备聚己内酯(PCL)/盐酸四环素(Tet)药物支架,文献[9]讨论了水油相体积比和水相药物浓度两个参数对于乳液静电纺PCL纤维担载Tet能力的影响,结果表明,随着水油相体积比的增加,载药量增加,但包封率有所下降,而增加水相药物浓度,也导致载药量增加和包封率的下降.文献[10]以溶菌酶为模型药物,改变高聚物种类、辅料添加剂类型以及调节水油相比例等参数,利用乳液静电纺制备不同皮芯结构纤维,结果表明,选用合适的高聚物、加入辅料以及合适的水油相比例可以提高包封率.乳化剂是形成乳液必不可少的添加剂,目前主要研究乳化剂对高聚物溶液性能(黏度、导电率、表面张力等)以及纤维形貌性能的影响[11],而关于乳化剂对乳液静电纺纤维担载药物能力的影响研究较少.本文将以PCL溶解在三氯甲烷中作为油相,Tet溶解在蒸馏水中作为水相,以失水山梨糖醇单油酸酯(Span 80)作为乳化剂,利用乳液静电纺丝技术制备PCL/Tet载药纤维,讨论乳化剂Span 80质量分数对纤维担载药物能力的影响.
1 试 验
1.1 材料和药品
PCL(相对分子质量为80 000,美国Sigma-Aldrich公司),Tet(USP级别,上海生工生物公司),Span 80(新加坡Sigma公司),三氯甲烷(上海凌峰化学试剂有限公司),人工唾液参照文献[12]配制,利用质量分数为1%的HCl调节pH值至6.8±1.
1.2 纺丝乳液的准备
取400 mg的 PCL加入到5 mL的三氯甲烷中作为油相,恒温磁力搅拌2 h.将Tet溶解在蒸馏水中作为水相,质量浓度为10 g/L,取0.25 mL逐滴加入到高聚物溶液中,使V(水相)∶V(油相)=1∶20.随后向混合溶液中加入不同质量的Span 80作为乳化剂,配置不同质量分数的Span 80溶液.将混合溶液放置在冰浴中,利用超声探针在20%的振幅下超声震荡5 min后,得到稳定均匀的乳液.
1.3 纺丝工艺参数
使用2.5 mL的注射器和18 G平口不锈钢针头,纺丝电压为16 kV,纺丝速度为1.0 mL/h,接收距离为12 cm.环境温度为25~27 ℃,相对湿度为45%~50%.
1.4 载药量和包封率测量
借用药典中对载药量和包封率的定义,但本文反映的是纤维芯层中包埋的药物含量,为了准确计算包埋在纤维芯部的药物比例,测试前应去除纤维表面的药物.取一定质量纤维膜,利用人工唾液缓冲液冲洗纤维表面药物,然后将纤维膜真空隔夜烘燥.取烘干后的纤维膜20.0 mg,充分溶解在2 mL的三氯甲烷有机溶剂中,加入5 mL人工唾液缓冲液,超声振荡至药物全部溶解,离心(10 000 r/min)30 min后将上层清液吸出,用紫外-可见光分光光度计(TU-1901型)测定清液中的Tet,得到药物的绝对含量,再换算成载药量和包封率.每个试样进行3次试验,计算平均值和标准差.
2 结果与讨论
2.1 Span 80的质量分数对纤维形貌影响
Span 80质量分数对纤维形貌的影响如图1所示.从图1可以看出,当Span 80质量分数由0%增加至0.5%时,纤维表面的珠粒减小,逐渐得到光滑均匀的纤维.因为乳化剂的加入降低了溶液的表面张力[13],有利于连续均匀纤维的形成.因此,改变乳化剂的质量分数能够调节乳液静电纺纤维的形貌.
由图1可知,在所选择的Span 80质量分数范围内,0.5%为可得到光滑纤维的最低Span 80质量分数,因此,在后续讨论中将不包括Span 80质量分数低于0.5%的试样.

(a) 0%

(b) 0.2%

(c) 0.3%

(d) 0.4%

(e) 0.5%
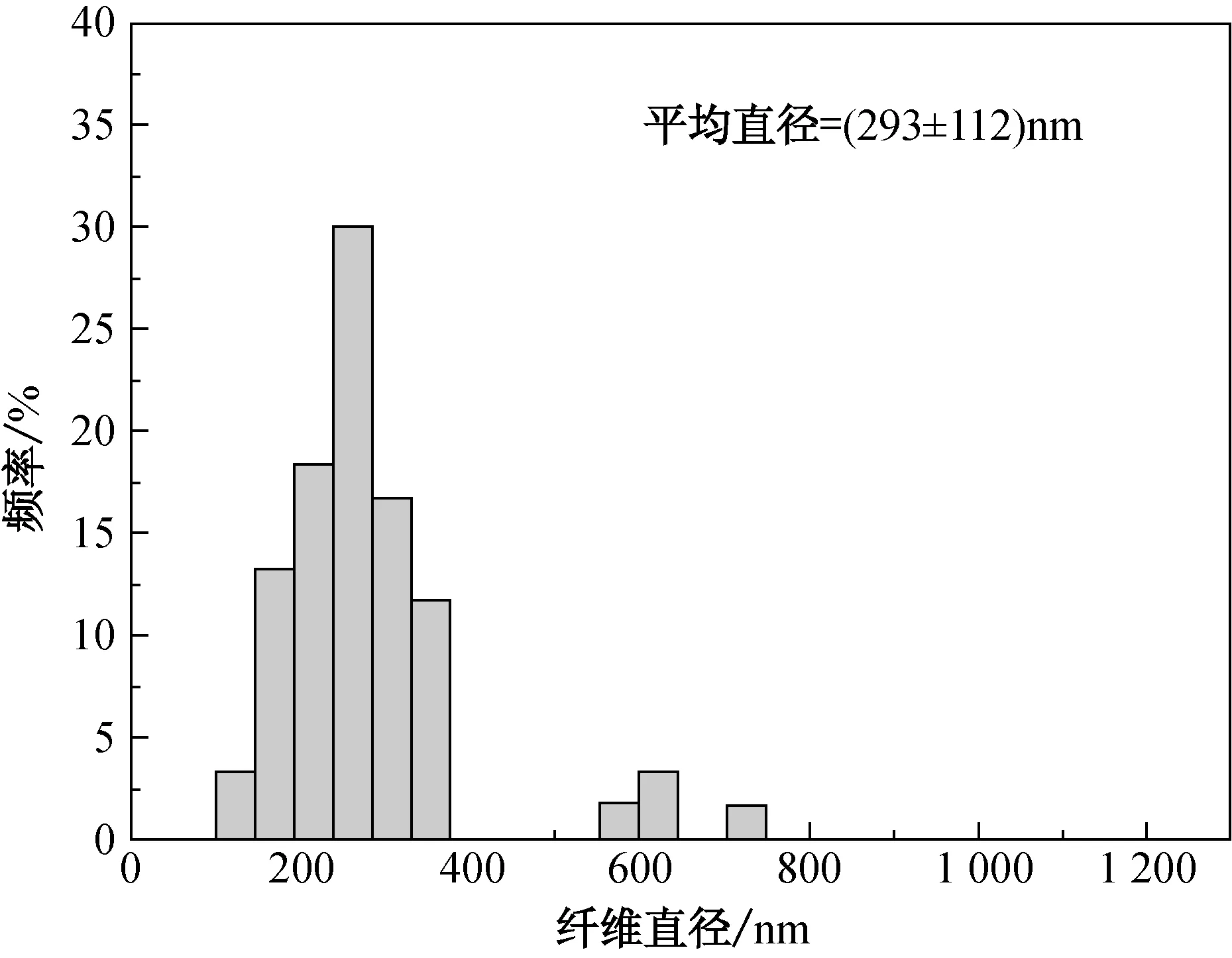
当Span 80质量分数为0.5%, 1.0%, 2.0%和4.0%时,乳液静电纺纤维的电镜图和直径分布图如图2所示.由图2(a)和2(b)可以看到,所纺纤维的表面均匀光滑,其平均直径分别为(293±112)和(276±91)nm.由图2(c)可知,当Span 80质量分数为2.0%时,纤维间出现粘连现象,纤维表面产生少许珠粒,其平均直径为(311±170)nm.由图2(d)可知,当Span 80质量分数增至4.0%,纤维平均直径为(537±226)nm,且因粘连现象严重,使得纤维直径和不匀率变大.根据单因素方差分析结果,按置信水平α=0.05的标准,概率P值<0.05,说明纤维直径在不同乳化剂质量分数下存在显著性差异.

(a) 0.5%


(b) 1.0%


(c) 2.0%


(d) 4.0%
不同Span 80质量分数的纺丝乳液的表面张力和黏度如表1所示.

表1 不同Span 80质量分数的纺丝乳液表面张力和溶液黏度
由表1可知,当Span 80质量分数从0.5%增加到1.0%时,纺丝乳液表面张力降低,在电场力作用下,射流拉伸更充分,所以乳化剂质量分数增加导致了纤维直径的下降[11, 13].当Span 80质量分数由1.0%增加至2.0%时,乳液表面张力略微下降,继续增加至4.0%时,纺丝乳液表面张力几乎不再下降[14],此时,溶液的黏度随着Span 80质量分数的增加而略微增加[15].随着Span 80质量分数的增加,一方面,Span 80分子的疏水端部分与PCL分子间的相互作用增强,PCL分子链段局部缠结增加,使纤维直径增加;另一方面,Span 80分子中的3个羟基以及羰基能够与溶剂三氯甲烷分子发生氢键作用,导致溶剂挥发速率下降[16-18],纺丝过程中溶剂挥发不完全,造成纤维拉伸不均匀和粘连,使得纤维直径增加和不匀率增大[19-20].因此,在其他条件相同的情况下,Span 80质量分数应该控制在0.5%~2.0%内,以保证良好形貌纤维的形成.
2.2 纤维皮芯结构及对药物的担载
药物在纤维中的分布对于药物的担载至关重要.在得到良好形貌的纤维后,需要进一步研究纤维的内部结构以及药物的分布情况.在波长为440 nm光的激发下, Tet将发出绿色的荧光.乳液静电纺PCL/Tet载药纤维的激光共聚焦显微镜图像如图3所示.由图3可以看出药物分布在纤维的芯层.


(a) 荧光图像 (b) 明场图像

(c) 合成图像
在保证乳液稳定能够满足纺丝要求以及纤维形貌良好的前提下,选用了Span 80质量分数为0.5%, 1.0%和2.0%的纤维试样,其透射电镜图如图4所示.当Span 80质量分数为0.5%, 1.0%和2.0%时,从图4中测量得到纤维芯层的厚度分别为142, 115和171 nm,相应的纤维直径为185, 183和305 nm,可以算出纤维芯层直径占整根纤维直径的比率分别为76.8%, 62.8%和56.1%,皮层的厚度分别为43, 68和134 nm.由此可知,随着Span 80质量分数的增加,纤维的皮层厚度呈增加趋势.


(a) 0.5% (b) 1.0%

(c) 2.0%
Fig.4 Transmission electron microscope images of PCL/Tet drug-loaded fibers with different mass fractions of Span 80
由于随着Span 80质量分数的增加,油/水相界面张力减弱,乳液中分散相液滴抗变形能力变弱,使得在相同电场强度下液滴极化变形程度增大.由于氯仿溶剂的挥发产生两相的黏度梯度,促使液滴合并、破乳[21-22],液滴向芯层聚集,另外,拉伸过程中溶剂的挥发速度减小,药物水相能够进一步与高聚物油相作用,所以纤维的皮层更厚.大量含有Tet的水相小液滴在纤维拉伸的过程中,迁移至纤维表面而损失,导致芯层药物的减少.
2.3 纤维的载药量和包封率
称取恒重的Tet适量,用人工唾液稀释定容,制成质量浓度为0.1 g/L的贮备液,再以人工唾液缓冲液稀释,分别制成质量浓度为0.004~0.024 g/L(间隔0.002 g/L)的一系列Tet标准溶液,用紫外-可见光分光光度计进行光谱扫描,波长200~400 nm内在269和373 nm处出现吸收峰,根据药典要求,选择波长为269 nm处(吸收峰波动较小)的吸收峰.将标准Tet溶液的质量浓度与其紫外吸收峰值的对应关系经过线性拟合后,可得到Tet 标准溶液的紫外吸收拟合直线如图5所示.

图5 波长为269 nm处Tet标准溶液的紫外吸收拟合曲线Fig.5 Fitting straight line of Tet standard solution at wavelength of 269 nm
线性拟合方程为:A=34.7C+0.001,R2=0.999 4,其中,C为Tet质量浓度(g/L),A为吸光度.
载药量是指纤维膜中所包埋的药物占纤维膜总质量的百分比,而包封率是指纤维膜中所包埋的药物占药物投入量的百分比,二者的区别在于前者体现了纤维膜对药物的担载能力,而后者反映了制备过程对药物的利用率.相应的计算式分别为
(1)
(2)
式中:m1为测得的Tet质量;m为纤维膜总质量;m0为Tet投入总质量.
为了讨论乳化剂质量分数对载药量和包封率的影响,选用不同质量分数的Span 80制备的PCL/Tet载药纤维膜,各取20.0 mg纤维膜进行测试,得到药物的吸光度,然后根据标准曲线方程,得到相应的药物质量浓度和药物的绝对含量,换算成相应的载药量和包封率,结果如表2所示.

表2 不同Span 80质量分数制备的PCL/Tet载药纤维 膜载药量和包封率
注:经单因素方差分析,在置信水平α=0.05下,所测得的纤维膜载药量和包封率之间存在显著性差异(P<0.05).
由表2可知,不加Span 80的乳液制备的PCL/Tet载药纤维膜具有很低的载药量和包封率,几乎没有应用价值,在这里仅作为参照.由于Span 80作为两亲性分子,疏水端与高聚物PCL分子作用,亲水端则与Tet分子作用,所以加入Span 80后,能够加强Tet和PCL之间的作用,使得纤维具有担载药物的能力.然而随着Span 80质量分数的增加,纤维皮层的厚度增加,芯层药物将减少,使得纤维膜的载药量和包封率均降低.
3 结 语
本文通过加入不同质量的乳化剂Span 80,利用乳液静电纺丝技术制备了形貌良好的PCL/Tet载药纤维,分别对该纤维的形貌、担载药物的能力进行观察和表征,得出以下结论:
(1) 随着Span 80质量分数从0增加至0.5%, PCL/Tet载药纤维表面的珠粒减小,逐渐得到光滑均匀的纤维,0.5%是得到光滑纤维的最低Span 80质量分数.Span 80质量分数在0.5%~1.0%内,纤维表面均匀光滑,纤维直径随着Span 80质量分数的增加而减小.Span 80质量分数为2.0%时,纤维间出现粘连现象,其表面产生少许珠粒.当Span 80质量分数增至4.0%,粘连现象严重,使得纤维直径和不匀率变大.
(2) 当Span 80质量分数为0.5%, 1.0%和2.0%时,PCL/Tet载药纤维具有完整的皮芯结构,且药物分布在纤维的芯层.随着Span 80质量分数的增加,纤维的皮层厚度有增加的倾向,芯层药物相应减少.
(3) 相比加入Span 80的纤维膜,不加Span 80的乳液制备的PCL/Tet载药纤维膜具有很低的载药量和包封率.当Span 80质量分数为0.5%~2.0%时,随着Span 80质量分数的增加,纤维的载药量和包封率呈下降趋势.
[1] LI X, SU Y, ZHOU X, et al. Distribution of sorbitan monooleate in poly(l-lactide-co-ε-caprolactone) nanofibers from emulsion electrospinning[J]. Colloids and Surfaces B: Biointerfaces, 2009, 69(2): 221-224.
[2] ANGELES M, CHENG H L, VELANKAR S S. Emulsion electrospinning: Composite fibers from drop breakup during electrospinning[J]. Polymers for Advanced Technologies, 2008, 19(7): 728-733.
[3] DAI Y, NIU J, LIU J, et al. In situ encapsulation of laccase in microfibers by emulsion electrospinning: Preparation, characterization, and application[J]. Bioresource Technology, 2010, 101(23): 8942-8947.
[4] LI X, ZHANG H, LI H, et al. Encapsulation of proteinase K in PELA ultrafine fibers by emulsion electrospinning: Preparation and in vitro evaluation[J]. Colloid and Polymer Science, 2010, 288(10/11): 1113-1119.
[5] LI X, ZHANG H, LI H, et al. Self-accelerated biodegradation of electrospun poly(ethylene glycol)-poly(l-lactide) membranes by loading proteinase K[J]. Polymer Degradation and Stability, 2008, 93(3): 618-626.
[6] SMOLEN J A. Emulsion electrospinning for producing dome-shaped structures within l-tyrosine polyurethane scaffolds for gene delivery[D]. Akron, University of Akron, 2010.
[7] YARIN A L. Coaxial electrospinning and emulsion electrospinning of core-shell fibers[J]. Polymers for Advanced Technologies, 2011, 22(3): 310-317.
[8] ZHANG H, ZHAO C G, ZHAO Y H, et al. Electrospinning of ultrafine core/shell fibers for biomedical applications[J]. Science China Chemistry, 2010, 53(6): 1246-1254.
[9] LIN G, HU J, DING X, et al. Effects of volume ratios of water phase to oily phase on morphology and releasing performance of emulsion electrospun fibers[J]. Journal of Donghua University(English Edition), 2014, 31(5):577-581.
[10] YANG Y, LI X, HE S, et al. Biodegradable ultrafine fibers with core-sheath structures for protein delivery and its optimization[J]. Polymers for Advanced Technologies, 2011, 22(12): 1842-1850.
[11] HU J, PRABHAKARAN M P, DING X, et al. Emulsion electrospinning of polycaprolactone: Influence of surfactant type towards the scaffold properties[J]. Journal of Biomaterials Science(Polymer Edition), 2015, 26(1): 57-75.
[12] Determination of the colour fastness of articles for common use part 1: Test with artificial saliva: DIN 53160-1:2010[S].
[13] WANG S Q, HE J H, XU L. Non-ionic surfactants for enhancing electrospinability and for the preparation of electrospun nanofibers[J]. Polymer International, 2008, 57(9): 1079-1082.
[14] 董国君,樊明红,陈雨.表面活性剂与聚合物相互作用的研究[J].化学工程师,2004,102(3):64-65.
[15] SENG W P, TAM K C, JENKINS R D. Rheological properties of model alkali-soluble associative(HASE) polymer in ionic and non-ionic surfactant solutions[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 1999, 154(3):365-382.
[16] 王永攀,熊杰,谢军军,等.非离子表面活性剂对壳聚糖静电纺丝的影响[J].纺织学报,2009,30(7):10-14.
[17] CHINAGLIA D L, GREGORIO R, STEFANELLO J C, et al. Influence of the solvent evaporation rate on the crystalline phases of solution-cast poly(vinylidene fluoride) films[J]. Journal of Applied Polymer Science, 2010, 116(2): 785-791.
[18] ZIANI K, HENRIST C, JÉRME C, et al. Effect of nonionic surfactant and acidity on chitosan nanofibers with different molecular weights[J]. Carbohydrate Polymers, 2011, 83(2):470-476.
[19] YAZGAN G, POPA A M, ROSSI R M, et al. Tunable release of hydrophilic compounds from hydrophobic nanostructured fibers prepared by emulsion electrospinning[J]. Polymer, 2015, 66:268-276.
[20] 李珍,王军.静电纺丝可纺性影响因素的研究成果[J].合成纤维,2008,37(9):6-11.
[21] 冯永训,张建,郭长会,等.电场破乳分散相液滴行为研究[J].实验流体力学,2010,24(2):28-33.
[22] BHARDWAJ A, HARTLAND S. Kinetics of coalescence of water droplets in water-in-crude oil emulsions[J]. Journal of Dispersion Science and Technology, 1994, 15(2): 133-146.
(责任编辑: 徐惠华)
Influence of Span 80 on Drug Loading Capability of Emulsion Electrospun PCL Fibers Loaded with Tetracycline Hydrochloride
PENGXiaoa,DINGXina, b,LINGanga,HUJiyonga, b,YANGXudonga, b
(a. Key Laboratory of Textile Science & Technology, Ministry of Education;b. College of Textiles, Donghua University, Shanghai 201620, China)
Polycaprolactone(PCL) fibers containing water-soluble drug tetracycline hydrochloride(Tet) were fabricated by emulsion electrospinning, in which PCL was dissolved in the chloroform as the oil phase and water soluble tetracycline hydrochloride was dissolved in distilled water as the water phase. Sorbitan monooleate(Span 80) as an emulsifier was added in the solution with different mass fractions.Fiber morphology, distribution of Tet in the fibers and formation of core-sheath structure were observed. Drug loading and encapsulation efficiency were calculated to study the influence of Span 80 mass fraction on drug loading capability of fibers. The results indicate that fibers without Span 80 have quite low drug loading and encapsulation efficiency. With the mass fraction of Span 80 ranged from 0.5% to 2.0%, fibers with integral core-sheath structure are obtained, and Tet is well encapsulated into the core region of the fibers. With the increase of Span 80 mass fraction, the thickness of fiber sheath increases and drug loaded in the core region of fibers decreases. Therefore, fibers’ drug loading and encapsulation efficiency decrease.
polycaprolactone; tetracycline hydrochloride; emulsion electrospinning; drug loaded fibers; drug loading; encapsulation efficiency
2015-12-01
彭 晓(1991—),女,江西萍乡人,硕士研究生,研究方向为纺织生物材料.Email: pengxiao9187@163.com 丁 辛(联系人),男,教授,xding@dhu.edu.cn
1671-0444(2017)01-0009-06
TS 101.4
A

