铝胁迫诱导八仙花根系分泌有机酸的研究
陈海霞+胡春梅+彭尽晖+范适

摘 要:为揭示八仙花的耐铝机制,对铝胁迫下根系分泌的有机酸进行研究。以八仙花扦插苗为试材,研究其在铝胁迫条件下根系有机酸分泌种类、耐铝能力以及影响有机酸分泌的影响因子。结果表明,在铝胁迫下八仙花根系分泌草酸,当以50 μmol·L-1AlCl3处理八仙花时,根尖的铬天青染色明显,根尖伸长生长受阻显著,草酸分泌量也显著增加。铝处理后的最初4 h,草酸分泌量随铝胁迫时间的延长而增加,但在4~24 h内草酸分泌量并未增加。在铝溶液中加入阴离子通道抑制剂PG(10 μmol·L-1和20 μmol·L-1)和蛋白合成抑制剂CHM(25 μmol·L-1和50 μmol·L-1)后显著抑制根尖分泌草酸。说明八仙花根系分泌草酸是八仙花抵御铝毒的主要机制,而阴离子通道可能介导根系分泌有机酸。
关键词:铝;八仙花;分泌;草酸
中图分类号:S685.99 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2017.02.001
Abstract: In order to reveal the mechanism responsible for Al-resistance in Hydrangea macrophylla, Al-induced secretion of oxalate from roots was investigated. In this reports, Hydrangea macrophylla cutting seeding used as experimental material, the types of organic acids, the Al-resistance and the effect of Al on the secretion of organic acid from roots in Hydrangea macrophylla were studied. The results showed that the root apices were strongly stained by cyanine R and root elongation was inhibited significantly after exposure of roots to 50 μmol·L-1AlCl3; oxalate was secreted from roots of Hydrangea macrophylla, oxalate secretion activated when the concentration of AlCl3 reached to 50 μmol·L-1 for 4 h, the amount of oxalate secretion in Hydrangea macrophylla have noting with Al concentration and duration of Al treatment. On the other hand, anion channel inhibitors PG (10 μmol·L-1 and 20 μmol·L-1) and protein synthesis inhibitor CHM (10 μmol·L-1 and 20 μmol·L-1) blocked the secretion in Hydrangea macrophylla significantly. These results suggest that the Al-induced secretion of oxalate from Hydrangea macrophylla roots may be a mechanism responsible for Al-resistance,the anion channels involve in the secretion in Hydrangea macrophylla.
Key words: aluminum; Hydrangea macrophylla; secretion; oxalate
鋁毒是世界性的限制酸性土壤上作物产量和导致森林退化的主要因子。我国酸性土壤分布区约占全国耕地面积的21%[1],农业上常用撒生石灰来缓解铝毒害,该方法不仅成本高,而且严重污染环境。八仙花是高富集铝离子的植物,被广泛应用于庭院、街道和广场的园林绿化。对八仙花耐铝毒害机制的研究,可为抗铝毒植物育种和酸性土壤特殊资源的利用奠定基础。
在酸性土壤中,铝离子从硅酸盐或氧化物中释放出来,溶解到土壤中对植物产生毒害作用,植物表现为根系的伸长生长受抑制、细胞壁和细胞膜受损、体内酶活性受影响等[2-5]。植物为了在有铝毒害的环境下生长,进化出一系列的耐铝毒机制,其中根系分泌有机酸被认为是植物耐铝毒最重要的机制之一。在铝胁迫下,根系分泌多种有机酸到根际周围,与铝形成稳定的复合体从而解除铝毒,不同植物分泌的有机酸种类不同,如大豆[6]、柱花草[7]、玉米[8]、决明[9]等分泌柠檬酸;小麦[10]、拟南芥[11]、油菜[12]等分泌苹果酸;荞麦[13]和番茄[14]分泌草酸。八仙花是一种富集铝的植物,仅用几个月的时间叶片中铝的积累量就可达5 mg·g-1干质量,叶片细胞中每千克鲜质量含铝量为15.7 mmol·L-1,这些铝与柠檬酸以1∶1的摩尔比构成无毒的柠檬酸—铝复合物[15]。在蓝色八仙花的花萼中Al3+的含量达(14.8±8.6) mmol·L-1,是红色花萼的40倍[16]。然而,目前在铝胁迫下诱导八仙花根系分泌有机酸尚未见报道,因此关于八仙花耐铝毒及富集铝的机理尚不清楚。本研究旨在阐明八仙花在铝胁迫下根系分泌有机酸的特点,为其耐铝毒机制的研究奠定基础。
1 材料和方法
1.1 试验材料
供试的八仙花品种为Hydrangea macrophylla var.Coerulea。以当年生未木质化且生长势一致的枝条作插穗,以珍珠巖为基质。保持插床空气相对湿度在80%~90%之间,温度约为20~35 ℃,20 d左右开始生根,然后转移至营养液中培养一周,供试验用。
1.2 耐铝能力的测定
选取根系长势较为一致的扦插苗,用小孔泡沫浮板固定,漂浮培养于含0,10,20,30, 40,50,100,200,400,600 μmol·L-1 AlCl3的溶液中处理24 h,处理液均含有0.5 mmol·L-1CaCl2(pH 值4.5,下同),每处理为10株扦插苗。在处理前后采用游标卡尺测量根的长度,计算根的伸长量和相对伸长率。
相对伸长率=铝胁迫后的根伸长量/对照的根伸长量×100%
将供试的扦插苗放入去离子水浸洗20 min,洗去根尖表面残留的铝离子,然后放入0.1%铬天青R溶液中染色20 min,将染色后的根尖放入去离子水中浸洗10 min,立即在体视显微镜下观察根尖的染色情况。拍照,比较根尖染色程度。
1.3 根系分泌有机酸的收集
为研究铝胁迫下八仙花根系分泌有机酸种类及含量,按1.2的处理方法,处理24 h后,分别收集根系分泌的有机酸。
为研究铝胁迫下八仙花分泌有机酸的模式,首先用0.5 mmol·L-1CaCl2溶液(pH值 4.5)洗根后,采用CaCl2溶液培养过夜,24 h后放入0和50 μmol·L-1 AlCl3溶液中分别处理0.5,2,4,8, 12,24 h后收集其根系分泌的有机酸。
为了研究阴离子通道抑制剂和蛋白抑制剂对根伸长和铝诱导有机酸分泌的影响,采用苯甲酰甲醛(PG) 为阴离子通道抑制剂,将供试株洗根,并进行以下处理,处理时间为12 h。(1)对照;(2)50 μmol·L-1 AlCl3;(3)10 μmol·L-1PG;(4)20 μmol·L-1PG;(5)50 μmol·L-1 AlCl3+10 μmol·L-1PG;(6)50 μmol·L-1 AlCl3+20 μmol·L-1PG。处理前后分别测量根系长度,计算根系相对伸长率,收集根系分泌物,蛋白抑制剂为环己酞亚胺(CHM)。将供试株洗根后,分别进行以下试验。(1)不同浓度蛋白抑制剂的处理:在50 μmol·L-1 AlCl3溶液中加入浓度为0,25,50 μmol·L-1 蛋白抑制剂CHM,处理12 h后,收集根系分泌物。(2)蛋白抑制剂预处理:将25 μmol·L-1 蛋白抑制剂预处理3 h后的植株进行铝胁迫处理,分别在铝处理后的3,6,9,12 h时收集根系分泌物。(3)铝溶液预处理:将50 μmol·L-1 AlCl3溶液预处理6 h后的植株放入25 μmol·L-1 蛋白抑制剂中处理,分别在蛋白抑制剂处理后的3,6,9,12 h时收集根系分泌物。
1.4 有机酸的分离测定
收集的有机酸用高效液相色谱仪(LC-8A,日本岛津公司)分离和测定,测定条件为:色谱柱为岛津SCR-102H离子排斥色谱柱,检测波长425 nm,流动相为超纯水,流速0.6 mm·min-1;柱温为4 ℃,进样量1 μL。
1.5 数据处理及统计方法
试验数据均采用Excel软件进行差异性分析。
2 结果与分析
2.1 八仙花抗铝毒的能力
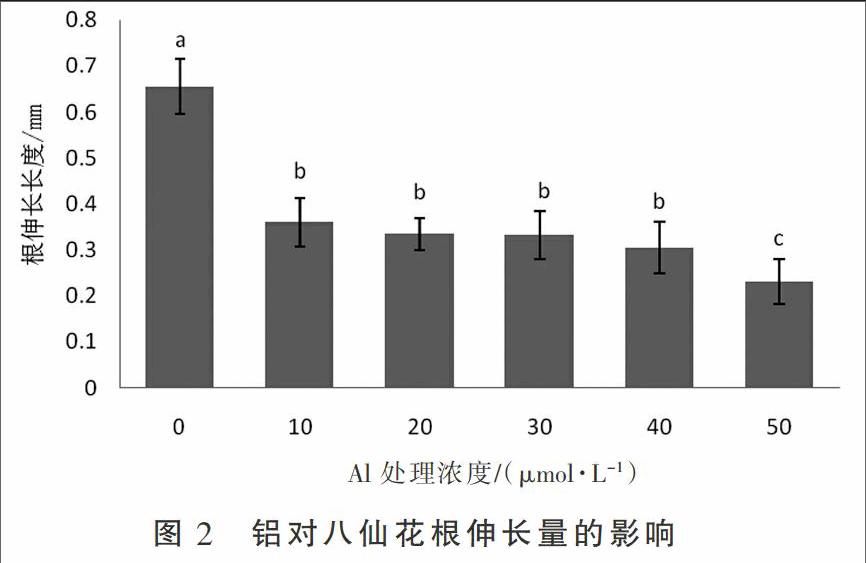
铝毒害最直观的反应是抑制根的伸长,根尖染色程度和根的伸长量是根系受毒害程度的主要依据。由图1可见,铝胁迫24 h后,对照处理的植株根系未被染色,当AlCl3处理浓度高至20 μmol·L-1时,根尖开始被染色,经40 μmol·L-1处理后根尖呈明显的紫黑色,且根尖染色程度和受伤害的体积与AlCl3浓度呈正比。在0,10,20,30,40,50 μmol·L-1 AlCl3溶液处理24 h后,八仙花根的平均伸长量分别为0.655,0.360,0.335,0.331,0.304,0.231 mm(图2),相对伸长率分别为54.96%,51.14%,50.53%,46.41%和35.26%,当AlCl3溶液浓度大于50 μmol·L-1后,根端变黑,根尖停止生长。以上结果说明,当铝胁迫浓度小于50 μmol·L-1时,八仙花根系对铝毒害有一定的耐受能力。
误差线代表±标准误,小写字母表示差异显著,P<0.05,下同。
2.2 铝诱导八仙花根系分泌草酸
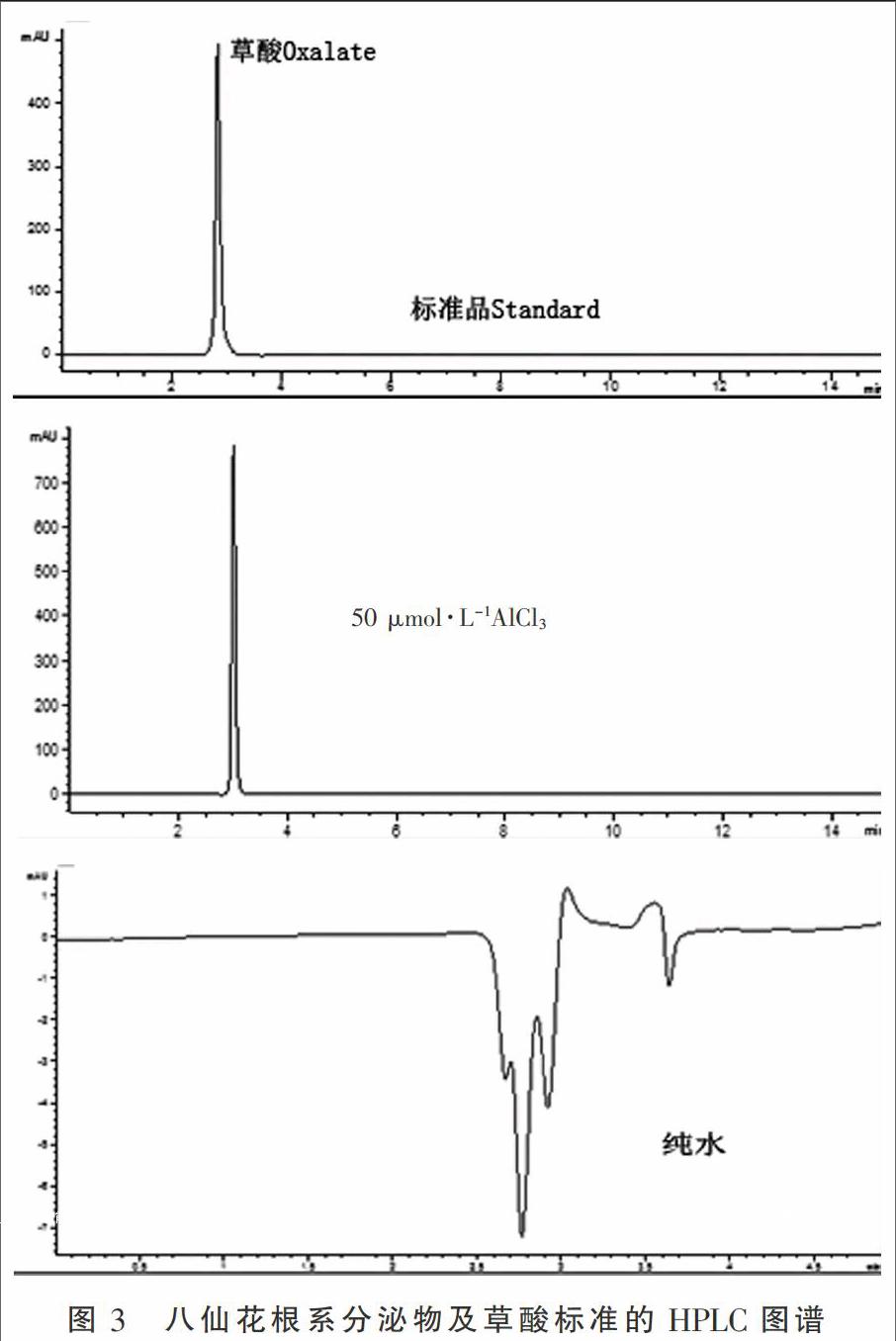
收集AlCl3溶液处理后的根系分泌物,采用高效液相色谱法分析根系分泌的有机酸种类,Al处理后八仙花根系分泌物色谱图中有一明显的吸收峰,保留时间为3 min,与草酸标准保留时间一致(图3)。经检测,纯水中无草酸保留峰,可见,铝胁迫下八仙花根系分泌的有机酸种类为草酸。
经AlCl3溶液处理后,根尖分泌草酸的量与铝处理浓度有关(图4)。当AlCl3处理浓度为0,10,20,30和40 μmol·L-1时,草酸分泌量为10 000 μg·mL-1左右;当AlCl3浓度升至50 μmol·L-1时,八仙花根尖草酸的分泌量迅猛增加,为对照的2.27倍;然而,当铝处理浓度高于50 μmol·L-1,八仙花根尖分泌的草酸量并不进一步增加,而是稳定在20 000 μg·mL-1左右,与50 μmol·L-1 AlCl3处理下的根尖草酸分泌量无显著性差异。
2.3 八仙花分泌有机酸的模式
不同的铝处理时间,八仙花根尖草酸分泌量有明显差异(图5)。分别在30,50 μmol·L-1 AlCl3溶液中处理0.5,2,4,8,12,24 h后,根系分泌草酸量呈现先上升后趋于平稳的趋势。在处理后的最初4 h内,根尖草酸分泌量随着铝胁迫时间的延长而增加,处理4 h时草酸分泌量分别是0.5 h时分泌量的1.68和1.69倍。但在铝处理后的4~24 h期间,草酸的分泌量一直保持相对稳定。这说明,铝诱导八仙花根系分泌草酸可能属于延迟释放模式。
2.4 阴离子通道抑制剂对草酸分泌和根伸长的影响
在培养液中添加阴离子通道抑制剂PG后,八仙花根系分泌草酸受到显著抑制(圖6)。仅添加浓度为10,20 μmol·L-1的PG处理后,草酸的分泌量为对照的42.19%和33.17%,呈显著性差异。八仙花根系在分别添加10,20 μmol·L-1的PG抑制剂的50 μmol·L-1 AlCl3溶液中处理24 h后,其草酸分泌也受到抑制,分泌量分别为对照的32.63%和32.14%,有显著性差异。
阴离子通道抑制剂PG也能显著抑制根系的伸长生长(图7)。在培养液中添加含10,20 μmol·L-1的PG时,八仙花根系相对伸长率仅为64.49%和61.08%,与对照相比有显著性差异。在分别添加10,20 μmol·L-1的PG抑制剂的50 μmol·L-1 AlCl3溶液中,其根系伸长生长受到抑制,根系相对伸长率分别为44.32%和41.76%,与对照有显著性差异。这说明阴离子通道是八仙花根尖分泌有机酸的有效途径。
2.5 蛋白合成抑制剂CHM对草酸分泌的影响
CHM为广谱性蛋白质合成抑制剂,通过干扰蛋白质合成过程中的易位步骤,抑制肽链延长,从而导致细胞生长停止或细胞死亡。在50 μmol·L-1 AlCl3溶液中加入蛋白合成抑制剂CHM后,八仙花根尖草酸分泌量显著减少(图8)。25 μmol·L-1 CHM处理12 h后,八仙花根系草酸分泌的抑制率高达64.4%,且随着CHM浓度的增大,抑制草酸分泌的效果增强。这说明,新蛋白质的合成可能是铝胁迫下根系分泌草酸的必要过程,当新蛋白质合成受阻时,草酸分泌也显著减少。
25 μmol·L-1CHM预处理对铝诱导八仙花根系分泌草酸的影响如图9所示。经CHM预处理后,根系草酸分泌量显著减少,胁迫处理3 h后,根系分泌草酸的平均量为3 825 μg·mL-1,在随后处理的取样中,草酸分泌量保持在4 000 μg·mL-1左右。未经CHM预处理的样品,铝胁迫处理3 h后,根系分泌草酸平均量为15 985 μg·mL-1,是预处理样品的4.18倍,随着处理时间的延长,草酸分泌量一直保持在16 000 μg·mL-1左右。这可能是因为CHM有强烈的毒性,CHM预处理使细胞DNA受损,新蛋白质的合成也受影响。
25 μmol·L-1CHM的后处理对根系草酸分泌的影响如图10所示。50 μmol·L-1AlCl3溶液预处理6 h后,根系能明显分泌草酸,随着处理时间的延长,根系分泌草酸均量一直维持在16 300~17 700 μg·mL-1之间。但是,6 h铝诱导结束后,在处理液中加入25 μmol·L-1CHM显著抑制了根系分泌草酸,CHM处理后的3,6,9,12 h时草酸分泌均量分别4 288,4 175,3 935,3 327 μg·mL-1,与未经CHM处理的相比,平均分泌量有显著性差异。该试验结果表明,虽然铝预处理已经启动八仙花根系分泌草酸,但是蛋白合成抑制剂通过抑制新蛋白质的合成影响了根系草酸的分泌。
3 结论与讨论
铝胁迫下八仙花扦插苗根系分泌有机酸的特性表明:AlCl3浓度升至50 μmol·L-1时,根系草酸分泌量显著增加,根尖明显受害;铝胁迫初期草酸分泌量逐步增加,处理时间达4 h时草酸分泌量进入平稳期;阴离子通道抑制剂PG和蛋白合成抑制剂CHM能显著抑制根尖分泌草酸。
植物在非生物逆境胁迫条件下,根系最先受到伤害,通过测定根尖受铬天青染色情况和根系生长速率即能反映不同植物种类受铝毒害的程度[17-18]。本试验中,当AlCl3浓度提高至20 μmol·L-1时,根系才开始被铬天青染色,根相对生长率为51.14%;随着AlCl3浓度的升高,根尖染色程度加剧,受害程度加深,当AlCl3浓度为50 μmol·L-1时根尖受到明显的铝毒害,被染成深紫红色,根相对生长率为35.26%,继续增大AlCl3浓度时,根尖变黑呈坏死状。据报道,对铝毒抗性很强的柱花草在AlCl3浓度达20~30 μmol·L-1时,根尖被染成紫红色[7]。由此可见,八仙花也是对铝毒抗性很强的植物。大量的研究表明,铝毒害对根尖的伤害包括抑制细胞分裂、细胞伸长和营养运输等,可导致根系变粗短、分枝减少、根尖膨大、呈褐色和表皮细胞坏死脱落等,从而使根伸长受抑制[19]。在铝胁迫下,铝离子结合在细胞壁上,从而阻止铝离子进入细胞内,细胞壁上果胶含量的增加及甲基酯化程度调节着细胞对铝的敏感程度[20]。对不同植物的研究发现,植物细胞壁果胶、半纤维素等多糖和木质素在铝胁迫下含量明显增加[21-22]。通过对小麦的研究发现,铝敏感品种根系细胞壁上大量积累铝离子[23],影响了细胞壁的粘性和延展性,这可能是根伸长受抑制的重要原因。
通过铝胁迫诱导有机酸分泌是一个重要的植物抗铝机制,铝诱导分泌的有机酸主要有苹果酸、柠檬酸和草酸等。1991年,Miyasaka等[24-29]就发现菜豆根系分泌柠檬酸是其耐铝的主要机理。2005年,第一个耐铝基因小麦苹果酸转运蛋白基因(ALMT1)成功克隆,该基因的表达与苹果酸分泌量的增加和耐铝性增强正相关。近年来,先后有研究报道了一些植物种类或者品种在铝胁迫下有效诱导根系有机酸的分泌,植物根系分泌的有机酸在根际与铝离子结合,将游离态的铝变成螯合态的铝,从而减少进入细胞质的铝离子数量,缓解和降低铝毒害。Ryan等[2]比较了37 个不同小麦基因型的耐铝性,结果表明铝诱导的苹果酸分泌量与品种抗铝性呈显著正相关。在黑麦、大豆、玉米等植物上的研究也表明,抗铝性与铝诱导根系分泌有机酸呈正相关[23-24]。在本研究中,铝胁迫下八仙花根系分泌草酸,在铝胁迫浓度低于50 μmol·L-1时,草酸分泌量保持较低水平;当胁迫浓度达到50 μmol·L-1时,草酸分泌量剧增,但是继续增加铝胁迫浓度时,草酸分泌量与50 μmol·L-1铝胁迫下的分泌量无显著性差异。该特性与小麦、决明和荞麦等植物分泌柠檬酸,黑麦分泌苹果酸的特性不一样[9-11,13],但是与黑麦分泌柠檬酸的特性一致[30]。以上结果说明,铝诱导根系分泌草酸可能是八仙花抗铝毒的机制。
根据有机酸分泌与铝胁迫的响应时间长短关系,将有机酸分泌分为两类模式:一类是以小麦和荞麦为代表的立即释放模式,是由于铝诱导激活阴离子通道迅速开启,并释放有机酸,无基因的诱导参与[10]。另一类是以大豆、玉米和烟草等为代表的延缓释放模式,铝胁迫下有机酸分泌需要一定的诱导期[6,8]。因此认为模式Ⅱ植物中有基因诱导参与有机酸的分泌,诱导的基因可能与细胞膜上离子通道的开闭、有机酸代谢、线粒体膜上有机酸运输等过程有关联。本试验发现铝胁迫4 h后,八仙花根系才大量分泌草酸,呈明显的滞后现象,因此八仙花为模式Ⅱ植物。
铝诱导根系分泌有机酸的调控因素:一是有机酸的代谢,二是有机酸的运输。有机酸的生物合成和降解反应主要发生在三羧酸循环反应过程中,铝胁迫处理下有机酸分泌与根尖细胞中三羧酸循环关键酶活性的变化有一定的联系,但在模式Ⅰ植物中,铝处理后根尖有机酸分泌与根系内相关酶活性的变化没有直接关系[24-25];相反,模式Ⅱ植物根系有机酸的分泌与根内相关酶活性变化相关,在有机酸分泌过程中也可能诱导新蛋白的合成,此种诱导蛋白可能与有机酸代谢或阴离子转运有关[26-28]。本研究结果表明,阴离子通道抑制剂PG显著抑制八仙花根的伸长生长和根尖分泌草酸,这与小麦、黑麦、荞麦、柱花草等植物中的报道相一致。在铝胁迫下根尖分泌草酸的特性与阴离子通道的转运有相关性。
研究表明,在模式Ⅰ植物小麦中发现铝离子直接与阴离子通道蛋白结合而激活阴离子通道分泌有机酸,这种蛋白不需要重新合成,因此,在响应铝胁迫的时间上没有滞缓期[25]。模式Ⅱ植物在铝胁迫下需重新合成离子通道蛋白参与有机酸的分泌,因此,蛋白抑制剂能抑制铝诱导模式Ⅱ植物决明根系分泌柠檬酸[9]。本研究结果发现:蛋白合成抑制剂CHM显著抑制八仙花根系分泌草酸;CHM预处理3 h后,铝诱导八仙花根系分泌草酸的量显著减少,甚至在6 h铝胁迫预处理启动了根尖草酸分泌后,CHM还对胁迫后期草酸分泌有显著的抑制作用。Pi■eros等[31]证实在玉米原生质上铝激活了阴离子通道,八仙花根系也在铝胁迫下通过激活阴离子通道分泌草酸,阴离子通道可能并非在铝胁迫前已经存在,草酸的分泌需要重新合成诱导蛋白才能正常进行。
到目前为止,已经分离出与铝诱导下植物苹果酸和柠檬酸的分泌相关的苹果酸通道蛋白(ALMT)和多药及毒性复合物的排出转运蛋白(MATE),但尚未有编码草酸转运蛋白基因的报道。本研究观察到,八仙花根系在铝胁迫前就有草酸分泌,处理后草酸分泌量增加以抵抗铝毒,这与植株体内调控草酸分泌的酶和基因相关,因此,有关铝诱导八仙花根系草酸分泌的阴离子通道蛋白和抗铝毒分子机理还值得进一步研究。
参考文献:
[1]KOCHAIN L V. Cellular mechanisms of aluminum toxicity and resistance in plants[J]. Annual review of plant physiology and plant molecular biology, 1995, 46: 237-260.
[2]肖祥希,楊宗武,郑蓉,等.铝胁迫对龙眼叶和根细胞超微结构的影响[J].林业科学,2003,39(1):58-61.
[3]杨梅,黄晓露,谭玲,等.4个桉树优良无性系的耐铝性评价指标分析[J].中南林业科技大学学报,2011,31(9):28-33.
[4]刘强,郑绍建,林咸永.植物适应铝毒胁迫的生理及分子生物学机理[J].应用生态学报,2004,15(9):1641-1649.
[5]谢安强,洪伟,吴承祯,等.桉树内生真菌对铝毒害胁迫下尾巨桉幼苗抗性特征的影响[J].中南林业科技大学学报,2013,33(3):16-20.
[6]YANG Z M, NIAN H, SIVAGURU M, et al. Characterization of aluminum-induced citrate secretion in aluminum tolerant soybean (Glycine max) plants [J]. Physiologia plantarum, 2001,113:64-71.
[7]左方华,凌桂芝,唐新莲,等.铝胁迫诱导柱花草根系分泌柠檬酸[J].中国农业科学,2010,43(1):59-64.
[8]PELLET D M,GRUNES D L,KOCHIAN L V.Organic acid exudation as an aluminum-tolerance mechanism in maize (Zea mays L.)[J].Planta,1995,196(4):788-795.
[9]FENG L X,FENG M J, MATSUMOTO H.Aluminum-induced secretion of both citrate and malate in rye[J].Plant and soil,2002,242(2):235-243.
[10]DELHAIZE E,CRAIG S,BEATON C,et al.Aluminum tolerance in wheat (Triticum aestivum L.) (I. uptake and distribution of Aluminum in root apices)[J].Plant Physiology,1993,103(3):685-693.
[11]HOEKENGA Q A,MARON L G,PINEROS M A,et al.AtALMT1,which encodes a malate transporter,is identified as one of several genes critical for Aluminum tolerance in Arabidopsis[J].Proc jpn acad ser B,2006,103(25):9378-9743.
[12]TAKITA E, KOYAMA H, HARA T. Organic acid metabolism in aluminum-phosphate utilizing cells of carrot (Daucus carota L.)[J].Plant and cell physiology,1999,40(5):489-495.
[13]MA J F,HIRADATE S,MATSUMOTO H.High Aluminum resistance in buckwheat. Ii. Oxalic acid detoxifies Aluminum internally[J].Plant Physiology,1998,117(3):753-759.
[14]OLESKI N,MAHDAVI P,BENNETT A.Transport properties of the tomato fruit tonoplast : II. citrate transport[J].Plant physiology,1987,84(4):997-1000.
[15]MA J F, HIRADATE S, NOMOTO K, et al. Internal detoxification mechanism of Al in Hydrangea [J]. Plant physiol, 1997,113:1033-1039.
[16]ITO D,SHINKAI Y,KATO Y,et al.Chemical studies on different color development in blue- and red-colored sepal cells of Hydrangea macrophylla[J].Bioscience biotechnology and biochemistry,2009,73(5):1054-1059.
[17]RYAN P R, DITOMASO J M, KOCHIAN L V. Aluminum toxicity in roots: an investigation of spatial sensitivity and the role of the root cap[J]. Journal of experimental botany,1993,44:437-446.
[18]MA J F,ZHENG S J,LI X F,et al.A rapid hydroponic screening for aluminium tolerance in barley[J].Plant and soil,1997,191(1):133-137.
[19]BENNET R J, BREEN C M. The aluminum signal: new dimensions to mechanisms of aluminum tolerance [J]. Plant soil,1991,134:153-166.
[20]WILLIAM G T,MCCAFUNEY L,MACKIE W,et al.Pectin:cell biology and prospects for functional analysis[J].Plant molecular biology,2001,47(1/2):9-27.
[21]ETICHA D,STASS A,HORST W J.Cell-wall pectin and its degree of methylation in the maize root-apex: significance for genotypic differences in aluminium resistance[J].Plant cell and environment,2005,28(11):1410-1420.
[22]YANG J,LI Y,ZHANG Y,et al.Cell wall polysaccharides are specifically involved in the exclusion of Aluminum from the rice root apex[J].Plant physiology,2008,146(2):602-611.
[23]MA J,FURUKAWA J.Recent progress in the research of external Al detoxification in higher plants: a minireview[J].Journal of inorganic biochemistry,2003,97(1):46-51.
[24]LI X,MA J,MATSUMOTO H.Pattern of aluminum-induced secretion of organic acids differs between rye and wheat[J].Plant physiology,2000,123(4):1537-1544.
[25]ZHANG W,RYAN P,TYERMAN S.Malate-permeable channels and cation channels activated by Aluminum in the apical cells of wheat roots[J].Plant physiology,2001,125(3):1459-1472.
[26]RICHARDS K,SCHOTT E,SHARMA Y,et al.Aluminum induces oxidative stress genes in Arabidopsis thaliana[J].Plant physiology,1998,116(1):409-418.
[27]TESFAYE M,TEMPLE S,ALLAN D,et al.Overexpression of malate dehydrogenase in transgenic alfalfa enhances organic acid synthesis and confers tolerance to Aluminum[J].Plant physiology,2001,127(4):1836-1844.
[28]YANG Z M, NIAN H, SIIVAGURU M, et al. Characterisation of aluminum-induced citrate seretion in aluminum-tolerance soybean plants [J]. Plant physiology,2001,113:64-71.
[29]YAMAGUCHI M,SASAKI T,SIVAGURU M,et al.Evidence for the plasma membrane localization of Al-activated malate transporter (ALMT1)[J].Plant & cell physiology,2005,46(5):812-816.
[30]吳柳杰,张永先,凌桂芝,等.铝胁迫下黑麦和小麦根尖分泌有机酸的研究[J].广西植物,2014,34(4):455-459.
[31]PIEROS M,KOCHIAN L.A patch-clamp study on the physiology of Aluminum toxicity and Aluminum tolerance in maize. Identification and characterization of Al3+-induced anion channels[J].Plant physiology,2001,125(1):292-305.

