利奈唑胺治疗新生儿革兰氏阳性菌感染的研究进展
孙 静,秦 侃,李 磊,凡小燕,王 焱(安徽医科大学第三附属医院药学部,合肥 230061)
利奈唑胺治疗新生儿革兰氏阳性菌感染的研究进展
孙 静*,秦 侃#,李 磊,凡小燕,王 焱(安徽医科大学第三附属医院药学部,合肥 230061)
目的:了解利奈唑胺治疗新生儿革兰氏阳性菌感染的研究进展。方法:查阅近年来国内外相关文献,就利奈唑胺的作用机制、药动学特征和在新生儿革兰氏阳性菌感染中应用的研究进行归纳和总结。结果和结论:利奈唑胺未被完全批准用于新生儿,但多项研究显示出利奈唑胺治疗新生儿耐药革兰氏阳性菌感染安全、有效,尤其是对新生儿败血症的治疗,利奈唑胺与万古霉素疗效相当。在新生儿中,利奈唑胺的给药可根据疾病、出生时体质量、胎龄和日龄等因素选择给药方案。新生儿中利奈唑胺的不良反应发生率较万古霉素低,但由于会引起骨髓抑制,用药期间需密切监测全血细胞计数。我国尚需大样本的研究用于评估利奈唑胺在新生儿革兰氏阳性菌感染治疗中的疗效和安全性。
利奈唑胺;新生儿;革兰氏阳性菌;疗效;安全性
革兰氏阳性菌是新生儿重症监护病房中最常见的严重感染,尤其是凝固酶阴性葡萄球菌和肠球菌[1-2],且屎肠球菌在新生儿败血症中的检出率呈增长趋势[3]。国内也有多篇文献报道指出新生儿感染中常见的致病菌为革兰氏阳性菌,其中以耐甲氧西林凝固酶阴性葡萄球菌为新生儿血流感染最常见的病原菌[4-7]。上述病原菌可在留置的导管中聚集,并引发早产儿早发或晚发型败血症[8-9],且对抗菌药物如氨苄西林、头孢噻肟等的耐药性增加,需要使用糖肽类抗菌药物如万古霉素等进行治疗。但是,万古霉素的过度使用存在较大风险,比如静脉注射引起静脉炎等输液反应,促进抗菌药物耐药性的产生,以及多重耐药菌或真菌的定植等[9];抗菌速度缓慢,组织穿透能力较弱[10];对患儿具有一定的耳肾毒性,尤其是联用氨基糖苷类抗菌药物时[11],应谨慎使用。利奈唑胺在新生儿尤其是早产儿感染性疾病中的应用越来越普遍[12],但国内报道较少,缺乏根据患儿胎龄、日龄和体质量等调整利奈唑胺剂量的临床研究,尚存在利奈唑胺是否较万古霉素在新生儿感染性疾病中用药更安全的争议。鉴于此,笔者查阅近年来国内外相关文献,就利奈唑胺治疗新生儿革兰氏阳性菌感染的研究进行归纳和总结,以期为其临床应用提供参考。
1 利奈唑胺的作用机制和药动学特征
2 利奈唑胺在新生儿感染性疾病中的应用
利奈唑胺可用于新生儿菌血症、社区或医院获得性肺炎、皮肤或软组织感染、对万古霉素耐药的屎肠球菌感染等[15]。2011年,美国传染病协会(IDSA)发布的耐甲氧西林金黄色葡萄球菌(MRSA)感染治疗指南推荐利奈唑胺为中枢神经系统MRSA感染的治疗用药,但脑室腹膜分流术患儿的药动学资料显示,单次或多次给予利奈唑胺后,患儿脑脊液中的药物浓度差异较大,并未总能达到或维持脑脊液的有效治疗浓度,故不推荐利奈唑胺经验性用于患儿的中枢神经系统感染[16]。2002年,美国食品与药物管理局(FDA)批准利奈唑胺用于耐药肺结核患儿[17],但许多欧洲国家仍未批准该用法[18]。
2.1 药动学
利奈唑胺的峰浓度和分布容积在不同年龄患儿中具有相似性,但清除率存在差异。利奈唑胺在≤7 d的早产儿体内的清除率为2 mL/(kg·min),≤7 d的足月儿为3.8 mL/(kg·min),>7~28 d的足月儿为5.1 mL/(kg· min),>28~<90 d的患儿为5.4 mL/(kg·min),90 d~11岁的患儿为3.8 mL/(kg·min),>11~18岁的患儿为2.1 mL/(kg·min)[19]。由此可见,早产儿与足月儿以及不同日龄的新生儿之间,利奈唑胺的清除率存在较大的个体差异。
2.2 给药方案
利奈唑胺的药品说明书中指出,0~11岁患儿的给药剂量为10 mg/kg,q8 h,ivgtt或po。《中国国家处方集化学药品与生物制品卷(儿童版)》[20]中指出,利奈唑胺在≤7 d的新生儿体内清除率低,给药间隔需增长,给药方案为10 mg/kg,q12 h,且需要评估感染的严重程度和临床疗效,若疗效欠佳,可改为q8 h;>7 d的新生儿,给药方案为10 mg/kg,q8 h。国外相关新生儿剂量手册则根据适应证和患儿的出生体质量、胎龄、日龄等因素对利奈唑胺给药方案进行了详细推荐[21],详见表1。
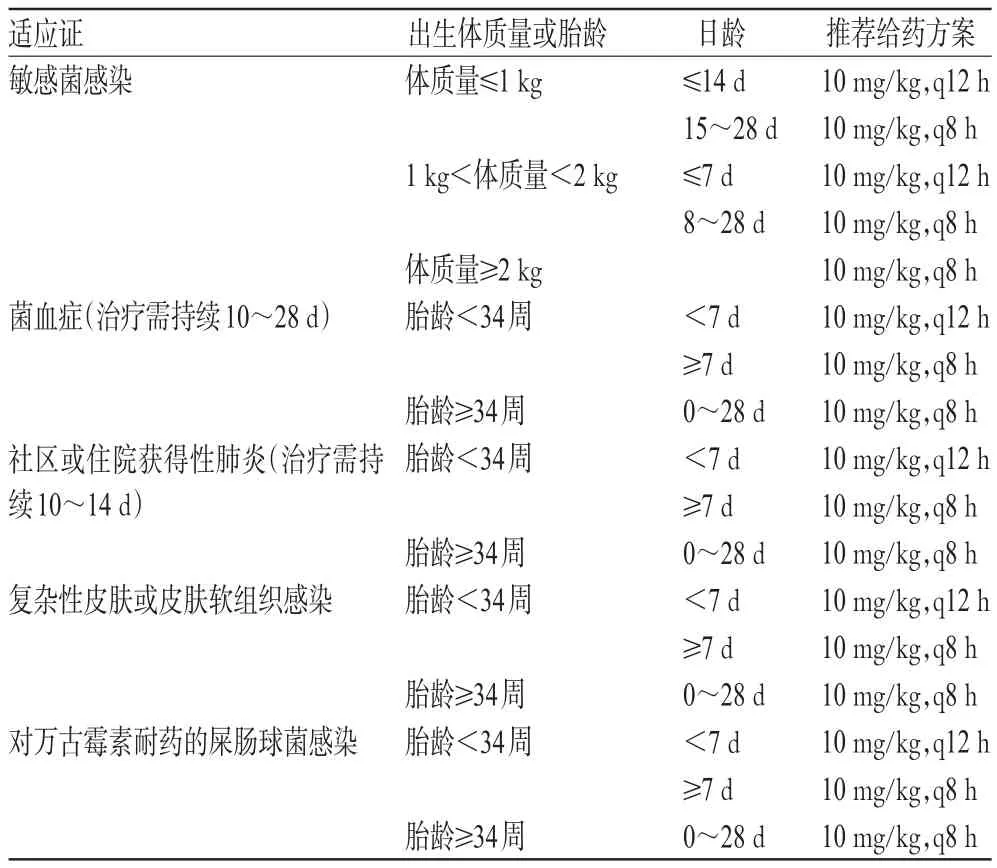
表1 国外利奈唑胺新生儿给药方案推荐
利奈唑胺在早产儿耐万古霉素心内膜炎、脑膜炎或脑室炎治疗中的最大剂量为12~15 mg/kg,q8 h[22-23]。利奈唑胺在患儿中的最大合理剂量为30 mg/(kg·d),但若其的最低抑菌浓度在2 μg/mL时则需要增加剂量,故35~45 mg/(kg·d)对于患儿是有效且安全的剂量[24]。利奈唑胺从静脉给药转换为口服给药时无需调整剂量。其药品说明书中建议对皮肤、皮肤软组织感染和肺炎的治疗疗程为10~14 d,对耐药屎肠球菌感染包括菌血症的治疗疗程为14~28 d。
2.3 革兰氏阳性菌感染的耐药性检测
利奈唑胺与细菌50S亚基的23S核糖体RNA上的位点结合,从而阻滞形成功能性70S始动复合物,后者为细菌转译过程中重要的组成部分。由于利奈唑胺需要特定的23S核糖体RNA突变,机体较少对利奈唑胺产生耐药[25]。根据《2014年CHINET中国细菌耐药性监测》[26]数据显示,葡萄球菌属和链球菌属中未检出对万古霉素、替考拉宁和利奈唑胺耐药的菌株,粪肠球菌和屎肠球菌中均有少数对万古霉素、利奈唑胺和替考拉宁耐药的菌株。近年来,国内新生儿感染性疾病中革兰氏阳性菌多重耐药现象严重,但均未发现对万古霉素和利奈唑胺耐药的菌株[4-7]。
Gu B等[27]的研究显示,利奈唑胺对98%的葡萄球菌属敏感,对金黄色葡萄球菌的耐药率为0.05%,对凝固酶阴性葡萄球菌的耐药率为1.4%,耐利奈唑胺的凝固酶阴性葡萄球菌中表皮葡萄球菌占较大比例。利奈唑胺最常见的耐药机制为23S核糖体的突变或氯霉素一氟甲砜霉素耐药核糖体甲基转移酶的传递[28]。López-Hernández等[29]的研究报道了从1例囊性纤维化患儿的呼吸样本中分离出的耐利奈唑胺的MRSA菌株,耐药机制尚未明确。Hill RLR等[30]的研究报道了1例囊性纤维化患儿产生利奈唑胺耐药的菌株,临床停止使用利奈唑胺后,菌株又重新恢复对利奈唑胺的敏感性。
2.4 临床疗效
Kaplan SL等[31]的研究纳入疑似或确诊的多重耐药革兰氏阳性菌感染患儿(日龄0~90 d),观察使用利奈唑胺和万古霉素的临床有效性和安全性。63例新生儿中,43例(包括26例早产儿)采用利奈唑胺10 mg/kg,q8 h治疗;20例(包括8例早产儿)采用万古霉素10~15 mg/kg,q6 h至qd,静脉给药至少3 d后转为口服序贯治疗,共10~28 d。结果显示,两组患儿的疗效相当,且均具有较好的耐受性。Deville JG等[32]对Kaplan SL等[31]的Ⅳ期试验中的新生儿人群进行了亚组分析,结果显示两组病例中最主要的诊断为菌血症(57.1%),凝固酶阴性葡萄球菌为分离最多的病原菌;利奈唑胺组患儿的治愈率较万古霉素组高,但差异无统计学意义(78%vs.61%,P>0.05);利奈唑胺和万古霉素的细菌清除率比较,差异无统计学意义(对金黄色葡萄球菌清除率为67%vs.60%,P=0.85;对凝固酶阴性葡萄球菌清除率为88%vs. 100%,P=0.38)。由此可见,利奈唑胺对MRSA和耐甲氧西林的表皮葡萄球菌的效果与万古霉素相当。Simon A等[33]的研究显示,新生儿严重感染时使用利奈唑胺的有效率和细菌清除率也与万古霉素相当。Kocher S等[12]的研究指出,利奈唑胺可作为替代万古霉素用于多重耐药的革兰氏阳性球菌感染的早产儿的安全选择。利奈唑胺为耐药革兰氏阳性菌感染患儿的有效、安全的治疗药物。
王晓蕾等[34]报道了30例耐药革兰氏阳性菌血流感染的新生儿使用利奈唑胺的临床疗效,有22例治愈(73.3%),总有效率为90%,细菌清除率为96.7%。徐海莉等[35]报道了116例利奈唑胺治疗的血流感染患儿,根据细菌培养结果分为革兰氏阳性菌感染(79例)和革兰氏阴性菌感染(37例);革兰氏阳性菌感染患儿的临床有效率为91.14%,细菌清除率为95.7%;革兰氏阴性菌感染患儿的临床有效率为65.57%,细菌清除率为100%。刘伟等[36]报道了应用利奈唑胺治疗使用万古霉素无效的14例败血症患儿,治愈8例(57.1%),显效2例(14.3%),无效1例(伴重症肺炎,后诊断为巨细胞病毒感染),总有效率达71.4%,细菌培养转阴率达75.0%。唐莲等[37]评价了195例利奈唑胺治疗败血症的患儿(包括133例早产儿),给药方案为利奈唑胺10 mg/kg,q8 h或q12 h,ivgtt,总有效率为89.74%,细菌清除率为96.92%。
由此可见,利奈唑胺治疗新生儿耐药革兰氏阳性菌败血症的疗效好、细菌清除率高。但是,FDA于2007年发出警告,利奈唑胺在1项导管相关血流感染包括插管部位感染的研究中显示出死亡的不均衡性,故利奈唑胺未被批准且不能应用于治疗导管相关的血流感染或插管部位感染患者。IDSA发布的MRSA感染治疗指南也提出对于MRSA引起的新生儿败血症如果与血管内病灶无关,利奈唑胺可作为万古霉素的替代选择[16]。因此,利奈唑胺在新生儿耐药革兰氏阳性菌引起的血流感染的使用需排除血管内病灶或者导管相关感染。
2.5 不良反应
利奈唑胺在患儿中的血液和神经方面的不良反应均小于成年患者。Garazzino S等[38]的研究指出,这可能与儿童对线粒体毒性的敏感性较成人低,同时与较少长疗程使用利奈唑胺有关。Deville JG等[32]的研究显示,利奈唑胺在患儿中的不良反应发生率明显低于万古霉素(11.6%vs.31.6%,P<0.05),两组患儿发生血液学或者血生化指标异常的比例相似,但利奈唑胺组患儿更易发生血红蛋白、血细胞比容下降和总胆红素升高。Meissner HC等[39]的研究比较了给予患儿利奈唑胺和万古霉素后血液系统的不良反应发生率,结果显示利奈唑胺组患儿发生血小板减少、贫血的比例较万古霉素组高,但差异无统计学意义(P>0.05)。利奈唑胺在患儿中的不良反应主要为胃肠道不适、头痛和呕吐,其次是皮疹和丙氨酸转氨酶升高[38]。Jones SJ等[40]的研究显示,利奈唑胺引起患儿血小板减少症的发生率为29%,其中57%的患儿存在肾功能损伤。利奈唑胺引起的全血细胞减少,在停药后会得以缓解。如果需要给予早产儿利奈唑胺,因存在骨髓抑制风险,建议每周对其进行全血细胞计数监测[12]。
刘伟等[36]的研究中有2例患儿出现贫血,2例贫血较治疗前加重,但未见血小板减少、肝肾功能损害加重、皮疹和听神经损伤等不良反应。赵宏明等[41]的研究显示,利奈唑胺致新生儿血小板减少症的发生率显著低于老年患者,新生儿发生血小板减少症的高危因素包括早产的低体质量、围产期窒息及高胆红素血症。黎颖然等[42]的研究也报道了4例早产的极低出生体质量患儿使用利奈唑胺后出现血小板减少,停药后血小板恢复正常。许平等[43]的研究报道了口服利奈唑胺治疗的62例革兰氏阳性球菌败血症新生患儿中,4例出现不良反应,其中3例为胃肠道症状(腹泻、呕吐),1例出现血象改变(贫血),但症状均较轻,故继续用药并未作处理。唐莲等[37]的研究报道了195例患儿给予利奈唑胺出现的不良反应以血小板减少为主,27例(13.85%)发生利奈唑胺相关性血小板减少,立即停药后19例自行恢复,6例接受对症治疗后恢复正常;1例患儿给药9 d后发生丙氨酸转氨酶升高,给予保肝药对症治疗后好转;1例患儿给药4 d后出现腹泻,给予对症治疗后好转。
由此可见,国内报道中的新生儿使用利奈唑胺出现的不良反应以血小板减少为主。利奈唑胺致血小板减少的危险因素主要包括出生时体质量低、胎龄小、基础血小板值低、基础白蛋白水平低和基础总胆红素水平高等,其中胎龄小、基础血小板值低、基础白蛋白水平低和基础总胆红素水平高是利奈唑胺相关血小板减少的独立危险因素[37]。
3 结语
虽然利奈唑胺未被完全批准用于新生儿,但多项研究显示出利奈唑胺治疗新生儿耐药革兰氏阳性菌感染安全、有效,尤其是对新生儿败血症的治疗,利奈唑胺与万古霉素疗效相当。在新生儿中,利奈唑胺的给药可根据疾病、出生时体质量、胎龄和日龄等因素选择给药方案。我国尚未在新生儿中发现耐利奈唑胺的菌株,但仍需合理使用利奈唑胺,以维持利奈唑胺对敏感细菌的抗菌活性。新生儿中利奈唑胺引起的不良反应发生率较万古霉素低,但由于会引起骨髓抑制,用药期间需密切监测全血细胞计数。
我国有关利奈唑胺在新生儿革兰氏阳性菌感染中的疗效和不良反应的报道较少,需要大样本的研究用于评估利奈唑胺在新生儿革兰氏阳性菌感染治疗中的疗效和安全性。同时,应推广新生儿中利奈唑胺血药浓度监测,以确保用药安全、合理和有效。
[1] Sohn AH,Garret DO,Sinkowitz-Cochran RL,et al.Prevalence of nosocomial infections in neonatal intensive care unit patients:results from the first national point-prevalence survey[J].J Pediatr,2001,139(6):821-827.
[2] Brodie SB,Sands KE,Gray JE,et al.Occurrence of nosocomial bloodstream infections in six neonatal intensive care units[J].Pediatr Infect Dis J,2000,19(1):56-65.
[3] Shailaja VV,Reddy AK,Rangaiahgari A,et al.Increased isolation of Enterococcus faecium from neonates with sepsis:an attempt to investigate the suspected outbreak[J].J Infect Dis,2016,45:341-342.
[4] 唐晓娟,冯星.1 606例新生儿败血症病原菌分布及其耐药性分析[J].临床儿科杂志,2014,32(3):210-213.
[5] 陈彦香,陈少峰,吴瑛,等.2007—2010年NICU中细菌分布及耐药变迁的分析[J].中国抗生素杂志,2013,38(3):227-229.
[6] 屠志琴,屠芳兰,延晓曦.NICU患儿感染病原菌分布及耐药性分析[J].中华医院感染学杂志,2014,24(24):6060-6062.
[7] 钟巧,李晖,高晓玲,等.NICU血培养标本中病原菌及耐药特征研究[J].中华医院感染学杂志,2013,23(15):3775-3777.
[8] Stoll BJ,Gordon T,Korones SB,et al.Early-onset sepsis in very low birth weight neonates:a report from the National Institute of Child Health and Human Development Neonatal Research Network[J].J Pediatr,1996,129(1):72-80.
[9] Stoll BJ,Gordon T,Korones SB,et al.Late-onset sepsis in very low birth weight neonates:a report from the National Institute of Child Health and Human Development Neonatal Research Network[J].J Pediatr,1996,129(1):63-71.
[10] Grossi PA.Early appropriate therapy of Gram-positive bloodstream infections:the conservative use of new drugs [J].Int J Antimicrob Ag,2009,34(Suppl 4):S31-S34.
[11] 万古霉素临床应用剂量专家组.万古霉素临床应用中国专家共识:2011版[J].中国新药与临床杂志,2011,30(11):641-648.
[12] Kocher S,Müller W,Rescha B.Linezolid treatment of nosocomial bacterial infection with multiresistant Gram-positive pathogens in preterm infants:a systematic review[J]. Int J Antimicrob Ag,2010,36(2):106-110.
[13] Kloss P,Xiong L,Shinabarger DL,et al.Resistance mutations in 23S rRNA identify the site of action of the protein synthesis inhibitor linezolid in the ribosomal peptidyl transferase center[J].J Mol Biol,1999,294(1):93-101.
[14] 汪复,张婴元.实用抗感染治疗学[M].2版.北京:人民卫生出版社,2013:390-392.
[15] 中国医药教育协会感染疾病专业委员会,中华结核和呼吸杂志编辑委员会,中国药学会药物临床评价研究专业委员会.抗菌药物超说明书用法专家共识[J].中华结核和呼吸杂志,2015,38(6):410-444.
[16] Liu C,Bayer A,Cosgrove SE,et al.Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant staphylococcus aureus infections in adults and children[J].Pediatr Infect Dis J,2003,22(suppl 9):285-292.
[17] Condos R,Hadgiangelis N,Leibert E,et al.Case series report of a linezolid-containing regemen for extensively drug-resistant tuberculosis[J].Chest,2008,134(1):187-192.
[18] Garazzino S,Krzysztofiak A,Esposito S,et al.Use of linezolid in infants and children:a retrospective multicentre study of the italian society for paediatric infectious diseases[J].J Antimicrob Chemother,2011,66(10):2393-2397.
[19] Jungbluth GL,Welshman IR,Hopkins NK.Linezolid pharmacokinetics in pediatric patients:an overview[J].Pediatr Infect Dis J,2003,22(Suppl 9):153-157.
[20]《中国国家处方集》编委会.中国国家处方集化学药品与生物制品卷:儿童版[M].北京:人民军医出版社,2013:153-154.
[21] Taketomo CK,Hodding JH,Kraus DM.Pediatric&neonatal dosage handbook with international trade names index[M].Amsterdam:Wolters Kluwer,2014:678-679.
[22] Kumar S,Kohlhoff S,Valencia G,et al.Treatment of vancomycin-resistant Enterococcus faecium ventriculitis in a neonate[J].Int J Antimicrob Agents,2007,29(6):740-741.
[23] Ang JY,Lua JL,Turner DR,et al.Vancomycin-resistant Enterococcus faecium endocarditis in a premature infant successfully treated with linezolid[J].Pediatr Infect Dis J,2003,22(12):1101-1103.
[24] Matsumoto K,Shigemi A,Takeshita A,et al.Linezolid dosage in pediatric patients based on pharmacokinetics and pharmacodynamics[J].J Infect Chemother,2014,21(1/2):70-73.
[25] Tsiodras S,Gold HS,Sakoulas G,et al.Linezolid resistance in a clinical isolate of Staphylococcus aureus[J]. Lancet,2001,358(9277):207-208.
[26] 胡付品,朱德妹,汪复,等.2014年CHINET中国细菌耐药性监测[J].中国感染与化疗杂志,2014,15(5):401-410.
[27] Gu B,Kelesidis T,Tsiodras S,et al.The emerging problem of linezolid-resistant Staphylococcus[J].J Antimicrob Chemother,2013,68(1):4-11.
[28] Mendes RE,Deshpande LM,Jones RN.Linezolid update:Stable in vitro activity following more than a decade of clinical use and summary of associated resistance mechanisms[J].Drug Resist Update,2014,17(1/2):1-12.
[29] López-Hernández,Valverde MD,Díaz NB,et al.First report of linezolid dependence in methicillin-resistant Staphylococcus aureus[J].Clin Microbiol Infec,2015,21(7):1-4.
[30] Hill RLR,Kearnes AM,Nash J,et al.Linezolid-resistant ST36 methicillin-resistant Staphylococcus aureus associated with prolonged linezolid treatment in two paediatric cystic fibrosis patients[J].J Antimicrob Chemother,2010,65(3):442-445.
[31] Kaplan SL,Deville JG,Yogev R,et al.Linezolid versus vancomycin for treatment of resistant Gram-positive infections in children[J].Pediatr Infect Dis J,2003,22(8):677-686.
[32] Deville JG,Adler S,Azimi PH,et al.Linezolid versus vancomycin in the treatment of known or suspected resistant gram-positive infections in neonates[J].Pediatr Infect Dis J,2003,22(Suppl 9):158-163.
[33] Simon A,Müllenborn E,Prelog M,et al.Use of linezolid in neonatal and pediatric inpatient facilities:results of a retrospective multicenter survey[J].Eur J Clin Microbiol Infect Dis,2012,31(7):1435-1442.
[34] 王晓蕾,孙海滨,陈桃英,等.利奈唑胺治疗新生儿耐药革兰氏阳性球菌败血症临床分析[J].中国儿童保健杂志,2013,21(2):213-214.
[35] 徐海莉,艾银凤,段志娴.利奈唑胺对新生儿血流感染患儿的疗效评价[J].抗感染药学,2014,11(3):255-256.
[36] 刘伟,陈玲,专晨昱,等.利奈唑胺治疗新生儿败血症的临床疗效和安全性[J].中国当代儿科杂志,2015,17(4):405-407.
[37] 唐莲,王三南,翁小红,等.利奈唑胺治疗新生儿败血症的疗效及对血小板的影响[J].药物不良反应杂志,2016,18(2):99-104.
[38] Garazzino S,Tovo PA.Clinical experience with linezolid in infants and children[J].J Antimicrob Chemother,2011,66(Suppl 4):23-41.
[39]Meissner HC,Townsend T,Wenman W,et al.Hematologic effects of linezolid in young children[J].Pediatr Infect Dis J,2003,22(9):186-192.
[40] Jones SJ,Nichols KR,DeYoung HL,et al.Linezolid-associated thrombocytopenia in children with renal impairment [J].JPIDS,2015,4(3):272-275.
[41] 赵宏明,唐莲,虞燕霞,等.利奈唑胺致新生儿与老年患者血小板减少分析[J].中国医院药学杂志,2013,33(10):803-806.
[42] 黎颖然,卢荣枝.利奈唑胺相关新生儿血小板减少4例 [J].药物不良反应杂志,2011,13(4):243-244.
[43] 许平,吴银弟,石微娜.口服利奈唑胺治疗新生儿革兰阳性球菌败血症的临床分析[J].临床合理用药杂志,2014,7(8):58-59.
(编辑:陶婷婷)
R978.1
A
1001-0408(2017)05-0711-05
2016-07-29
2016-09-23)
*主管药师,硕士。研究方向:儿科药学。电话:0551-62183192。E-mail:sjygj2015@163.com
#通信作者:副主任药师,硕士。研究方向:临床药学。电话:0551-62183192。E-mail:qinkan99@163.com
DOI10.6039/j.issn.1001-0408.2017.05.37

