小檗碱治疗糖尿病肾病的研究进展
任妍林+王定坤+董慧+陆付耳
[摘要]糖尿病肾病是与糖代谢异常有关的慢性肾脏微血管并发症,是导致终末期肾病的重要原因。糖尿病可通过多种途径损害肾脏,包括肾脏血管、肾小球、肾小管、肾间质均可受累。因此,糖尿病肾病的治疗必须采取综合的治疗过程,选择合适的药物在糖尿病肾病治疗中具有重要意义。小檗碱对糖尿病肾病的治疗具有显著疗效,而其机制与小檗碱降血糖、改善肾脏血流动力学、降血脂、抗炎等作用有关。
[关键词]糖尿病肾病; 小檗碱
[Abstract]Diabetic kidney disease (DKD) is a chronic renal microvascular complication associated with abnormal glucose metabolism, which is an important cause of end stage renal disease. Diabetes can damage the kidney through many ways, including renal vascular, glomerular, tubular, and renal interstitial damages. Therefore, a comprehensive treatment process must be taken for the treatment of DKD, and the selection of appropriate drugs has important significance in the treatment of DKD. Berberine has significant curative effect in the treatment of DKD, and the mechanism is related to the reduction of blood sugar, improvement of renal hemodynamics abnormality, regulation of blood lipid profile and the attenuation of systemic and local inflammation.
[Key words]diabetic kidney disease; berberine
糖尿病肾病(diabetic kidney disease,DKD)主要表现为糖尿病性肾小球硬化,是糖尿病重要的慢性微血管并发症,是终末期肾病的主要原因之一。研究表明,中国糖尿病患者已超过9 200万人,并有1.48亿处于糖尿病前期,而其中大约有1/3糖尿病患者会并发糖尿病肾病[1-2]。研究表明,DKD的形成与血脂异常,高血糖,血流动力学改变,氧化应激(oxidative stress,OS),炎症反应及遗传易感性有关,导致肾脏细胞外基质累积,肾小球肥大,肾小球基底膜(glomerular basement membrane,GBM)增厚和肾小球硬化的病理特点[3],并随着时间迁延,最终引起终末期肾病。小檗碱(berberine,BBR)属异喹啉生物碱,是中药黄连、黄柏的主要有效成分,因其良好的降糖、降脂、抗氧化并减轻炎症的药理作用在DKD的治疗中疗效显著[4]。近年來有关BBR作用于糖尿病及DKD的综述多集中在临床研究、动物实验、药理学研究、机制研究,并没有结合最新的DKD发病的分子机制,该文旨在回顾DKD最新的发病机制及BBR应用于DKD的治疗特点,进一步阐明小檗碱治疗DKD可能的机制。
1 DKD与高血糖
目前,有多项研究表明,高血糖与糖尿病并发症有密切关系,长期的高血糖是导致肾组织损伤及肾功能损害的最重要因素,从而引起DKD。DKD以进行性肾功能衰竭为特征,肾小球系膜细胞(glomerular mesangial cells,GMC)增殖和细胞外基质(extracellular matrix,ECM)蛋白在肾小球的沉积增加,导致系膜细胞增生,进而ECM积聚,系膜细胞肥大,最终形成肾小球硬化和萎缩[4]。长期的高血糖激活多元醇代谢通路的醛糖还原酶(aldose reductase,AR),引起多元醇信号通路的活化,活化的AR进一步造成肾小球细胞内山梨醇堆积,长期的高渗状态导致细胞结构的破坏,从而降低了Na+-K+-ATP酶活性,并使ECM在肾小球堆积,进而影响肾脏的生理功能,如肾小管重吸收,并导致肾脏纤维化[5]。
DKD的肾损伤与OS有关。OS是指体内氧化与抗氧化作用失衡,倾向于氧化,导致中性粒细胞炎症浸润,蛋白酶分泌增加,产生大量氧化中间产物。多元醇通路可以增强机体OS作用,干扰细胞内正常代谢[6]。长期的高血糖引起OS,而OS一方面使血管紧张素Ⅱ分泌增加,肾小球受压,肾小球滤过率增加,形成蛋白尿并导致GBM增厚,加速DKD的进展[7]。另一方面,OS激活细胞内信号通路,例如JNK和PKC通路,并激活转录因子如NF-κB和AP-1,加速了ECM 的沉积并减少细胞外基质的降解,导致肾小球硬化及肾脏纤维化[8]。
不仅如此,高血糖引起的肾脏持续OS反应导致胰岛素受体受损,干扰了胰岛素与胰岛素受体结合的胰岛素信号通路的传导,引起胰岛素抵抗[9]。胰岛素抵抗会提高肾小球毛细血管压力梯度,减少了出球小动脉收缩而降低静水压力和渗透,导致肾小球肥大及硬化[10]。胰岛素抵抗激活p38丝裂原活化蛋白激酶(p38AMPK)及细胞外信号调节激酶(ERK)信号通路,促进了GMC内转化生长因子β(TGF-β)、纤维连接蛋白及胶原蛋白的表达,导致ECM沉积,形成肾小球硬化和肾小管间质纤维化,高血糖也可使细胞膜外产生多余的糖基化终产物,影响Ⅳ型胶原的产生及ECM,TGF-β的形成,从而导致肾损伤[11]。同时,高胰岛素血症促进生长因子的表达,如胰岛素样生长因子(IGF-)1,IGF-2和转化生长因子β1(TGF-β1),加速了细胞外基质的形成,同样促进肾小球肥大与硬化[12]。
BBR可以通过增加脂肪细胞和骨骼肌细胞对葡萄糖的利用,减少葡萄糖在肠道的吸收产生降血糖作用。研究表明,BBR使AR的mRNA及蛋白质表达减少,显著抑制AR活性。因此,多元醇信号通路中的限速酶活性被抑制,多元醇信号通路的活性显著降低,Na+-K+-ATP酶活性得以提升,ECM在肾小球系膜内集聚减少,系膜扩张程度减轻,从而有效改善肾小球损伤和肾功能不全,改善肾小球硬化及萎缩,减缓DKD的进展[13-14]。BBR能抑制高糖诱导的肾脏细胞增生肥大,进而控制细胞外基质的累积及肾小球硬化;BBR可抑制NF-κB p65核移位,并能降低高血糖引起的TGF-β1基因表达、转录及DNA结合蛋白激酶1(AP-1)的活性,延缓了肾小球硬化及肾组织纤维化的进程。miR122是信号通路HNF-4α的关键调控点,对于肝脏糖异生和HepG2细胞脂质代谢调控起着重要作用,研究表明,BBR能通过调控miR122介导HNF-4α信号通路,通过肝脏糖异生途径降低血糖[15]。
Liu等利用C57BL/6小鼠建立DKD模型,实验组用BBR(300 mg·kg-1·d-1)干预12周,发现用BBR干预的DKD小鼠血糖明显下降,肾脏肥大指数及肾脏纤维化程度显著降低,NF-κB及AP-1在肾脏细胞内的表达减少,促使细胞间黏附分子-1(ICAM-1),TGF-β1 表达显著减少,表明BBR可抑制高血糖导致的肾脏细胞增生,阻断高血糖诱导的NF-κB和AP-1信号通路的活性,抑制纤连蛋白的活性,从而抑制ECM累积和肾小球硬化的发展,延缓了DKD发展[16-17]。另外,Xia等用SD大鼠建造糖尿病模型,用BBR(380 mg·kg-1·d-1)干预12周,发现BBR可以通过增加骨骼肌GLUT4转位来提高骨骼肌对胰岛素的敏感性,这与MAPK-GLUT4 相互作用有关,说明BBR可促进由p39MAPK活化蛋白激酶激活的GLUT4的表达,提高葡萄糖的摄取和利用,随着高血糖的改善,阻止了肾脏生理功能的破坏,从而抑制DKD进展[18]。
研究表明,BBR具有抑制OS的作用,表现在提高超氧化物歧化酶mRNA表达[19]。Hsu等认为BBR通过抑制Nrf-2通路来抑制OS作用,并抑制 AMPK,PI3K/Akt和P38通路的活性,同时激活抗氧化酶如超氧化物歧化酶及谷胱甘肽的表达[20],最终阻止了肾小球硬化的形成和肾组织纤维化的进程。因此,BBR可能通过多途径调节血糖水平,达到治疗DKD 的效果。
2 DKD与肾脏血流动力学异常
DKD早期治疗非常重要。DKD早期特点主要表现在肾脏血流动力学异常,而肾脏血流动力学异常主要体现于肾小球内血管阻力下降,单个肾单位内入球小动脉阻力较出球小动脉下降更为明显,使肾单位内血浆流量增加,肾小球高灌注,降低了水盐重吸收,导致肾小球高滤过[21]。细胞内MAPK,PKC,NF-κB通路、多种血管活性激素信号通路及多种生长因子如促硬化细胞因子TGF-β,CTGF参与了这一过程,進而出现OS作用活化,ECM累积,肾小球基底膜增厚等DKD标志性病理变化[22]。目前认为DKD的血流动力学异常主要有如下机制:①肾小球高压及高滤过率使肾小球系膜基质扩张及基底膜增厚,导致肾小球局灶性硬化;②血浆流量增加所致的机械力和剪切力损伤肾小球毛细血管内皮及上皮细胞,破坏了正常的血液滤过屏障,使蛋白滤过增加[23]。
Liu等利用C57BL/6小鼠建立糖尿病模型,实验组用BBR(300 mg·kg-1)治疗干预,发现肾脏内ECM在肾小球系膜内的堆积显著减少,相应的下游蛋白TGF-β1蛋白、细胞间黏附分子1水平下调,从而减轻肾小球内血管阻力,控制肾小球内血浆流量,改善肾小球高压等血流动力学异常现象,最终改善肾脏结构及功能[16]。另外,BBR对肾组织中OS作用的抑制作用,减轻了肾小球内中性粒细胞炎症浸润,降低了蛋白酶的分泌,减少了氧化中间产物的堆积,从而缓解了肾小球内血浆流速,阻止了肾小球局灶性硬化,改善了DKD早期血流动力学异常[24]。
3 DKD与高血脂
高血脂是指空腹、餐后甘油三酯及总胆固醇水平升高,高密度脂蛋白水平降低,低密度脂蛋白水平升高,载脂蛋白A-Ⅰ(ApoA-Ⅰ)或载脂蛋白A-Ⅱ(ApoA-Ⅱ)水平降低,载脂蛋白C-Ⅱ(ApoC-Ⅱ)或载脂蛋白C-Ⅲ(ApoC-Ⅲ)水平增高[24]。流行病学调查显示,高血脂是影响糖尿病肾病进展的首要因素。早在1982年,Moorhead等提出GMC和脂蛋白累积造成系膜增生,并导致肾小球硬化[25]。同时,尿蛋白及肾功能异常也会导致血脂异常,进而反馈性加重肾损伤。胰岛素抵抗被认为是糖尿病肾病血脂异常的主要诱因。胰岛素抵抗伴随着游离脂肪酸持续流向肝脏,促进肝脏产生甘油三酯,加速了Apo-B和极低密度脂蛋白的分泌[25];OS加速低密度脂蛋白的生成,并在高血脂的形成过程中扮演重要角色[9],同时高密度脂蛋白分泌减少。Mooradian A D等认为高密度脂蛋白减少的机制可能与胰岛素上调ApoA-Ⅰ功能失常有关[26]。因此,在肥胖且伴有高血糖患者,可能出现高密度脂蛋白减少。Haas M J等认为糖尿病血脂异常的发病机制还跟炎症因子产生增多有关,比如肿瘤坏死因子(TNF-α),炎症因子加重胰岛素抵抗,并下调apoA-Ⅰ和高密度脂蛋白的含量,增强关键酶的活性而引起高甘油三酯血症[27]。高血脂激活MAPK通路,MAPK通路的变化在DKD进展过程中起一定作用,尤其是ERK1/2,JNK和p38MAPK[28]。降脂药物对于改善DKD进展有一定价值,HDL-c降低干预性研究证实降脂药可以改善DKD尿蛋白状况及肾损进展[29]。
BBR能诱导机体显著降低血浆低密度脂蛋白(LDL-C)和总胆固醇(TC)水平,显著增加高密度脂蛋白(HDL-C)水平,且没有明显副作用,并能减少动脉病变,类似于他汀类药物的作用[30];还能改善代谢综合征患者的体重指数和腰围,降低胆固醇的活性,显著增加肝脏低密度脂蛋白受体(LDLR)的表达[31]。BBR能抑制血脂异常导致的OS。研究表明,BBR可以增加低密度脂蛋白受体mRNA的表达,从而有效控制低密度脂蛋白含量,降低血脂异常激活的巨噬细胞在肾小球产生OS反应水平,并减少临床期DKD的趋化因子和细胞因子的水平[32],从而间接减少ECM蛋白的累积,间质炎症因子的产生及抑制OS反应,改善系膜扩张,肾小球炎症浸润而阻止DKD进展。另外,BBR可以减少GMC对低密度脂蛋白的吸收,减少了包括血栓素和白三烯的类花生酸的合成[33],从而抑制DKD发展。
4 DKD与炎症反应
糖尿病肾病是一种炎症性疾病,最近多项研究证实了糖尿病肾病肾功能损伤与肾脏炎性细胞的累积密切相关[34]。近年来,在细胞及分子水平对DKD病因的深入研究,发现由先天免疫系统异常激活引起的炎症促使代谢紊乱,如Ⅱ型糖尿病病人胰岛素抵抗;激活固有免疫系统产生的促炎因子如白介素1β(IL-1β)、白介素18(IL-18)能够通过模式识别受体(PRR)识别侵入肾脏内的保守的病原体相关分子模式(PAMPs)或受损细胞内释放的损伤相关分子模式(DAMPs),从而激活下游信号通路,引起免疫反应[35]。Shahzad等阐明了炎性小体Nlrp3及其组件Nlrp3,ASC,caspase-1表达水平与DKD病情程度的正相关性,并利用小鼠模型证明炎性小体Nlrp3,IL-1β和IL-18与DKD病情程度的正相关关系[36]。认识糖尿病肾损伤的炎症机制,有助于找到新的抗炎靶点并制定对应的治疗策略。DKD患者的血液及尿液中强效促炎细胞因子——白细胞介素18(IL-18)较对照组显著升高,促进了GMC中干扰素释放γ(IFN-γ)的表达;同时,进一步诱导炎症因子IL-1和TNF-α活化,ICAM-1表达,诱导炎性细胞与内皮细胞间的黏附作用增强,使肾脏内皮细胞凋亡[37-38],导致肾组织炎症性损伤。转化生长因子-β(transforming growth factor-beta1,TGF-β)是一个重要的抗炎症细胞因子,在DKD病变发展中起着重要作用,通过下游丝/苏氨酸激酶受体(Smad)信号通路发挥作用。SnoN是TGF-β1/Smad信号通路中重要的核转录抑制因子,在负向调控 TGF-β1/Smad信号通路中起重要作用[39],长期抑制可能激发炎症。DKD患者的肾管状细胞中炎症因子IL-18表达增加,激发TGF-β活化的 MAPK通路,进一步诱导下游炎症细胞活化,增加炎症介质表达,促进炎症因子的产生,并能抑制免疫活性细胞的增殖[40],从多途径加重肾组织炎症细胞的浸润。DKD早期病變如肾脏肥大及高滤过与TNF-α,IL-6的表达密切相关,其在体内的含量高于糖尿病非肾脏病变患者[41]。肾脏内皮细胞、上皮细胞、肾小球膜和肾小管细胞亦能合成炎症因子TNF-β,IL-1和 IL-6,这些炎症因子以旁分泌或自分泌的方式诱发肾脏结构的多处改变,导致严重肾疾病[42]。
抗炎在DKD的预防与治疗中有一定意义。邓晓威等亦发现BBR能缓解炎症细胞及炎性因子在组织中的累积[43],Lo等认为BBR携带的亚甲二氧基具有抗炎作用,可抑制体内多种炎性介质的活性[44]。NF-κB是控制炎症的关键因子,BBR抑制IKK-β造成IκBα稳定性增强,从而阻止NF-κB核移位[45]。BBR作用于肾脏的抗炎能力在动物实验、细胞培养及临床研究中均得以证实,小檗碱可降低链脲佐菌素及高脂饮食诱导的糖尿病小鼠肾脏炎症因子的表达,同时胰岛素敏感性增加[46]。以1 g Qd的剂量服用3个月,还可显著降低患者血清IL-6含量[47],这都为BBR减轻肾脏内炎性损伤提供了依据。BBR能抑制DKD大鼠肾脏炎症反应的NF-κB及TGF-β/Smad3信号通路,降低了炎性细胞因子的产生,从而减轻炎性因子对肾组织的浸润[48]。BBR 能降低DKD大鼠肾脏组织中TGF-β1蛋白及 mRNA表达,使SnoN蛋白表达升高,BBR可能是通过调控Smad信号通路来调节DKD大鼠肾组织TGF-β1/SnoN表达的动态平衡,从而改善早期DKD大鼠肾脏炎性病变及下游炎症介质介导的肾组织纤维化,同时减少ECM、炎症介质及其余促纤维化因子的合成,因而减少ECM的沉积及炎症反应,减弱了肾小球硬化程度,对于延缓DKD的发展起重要作用[46]。
5 结语与展望
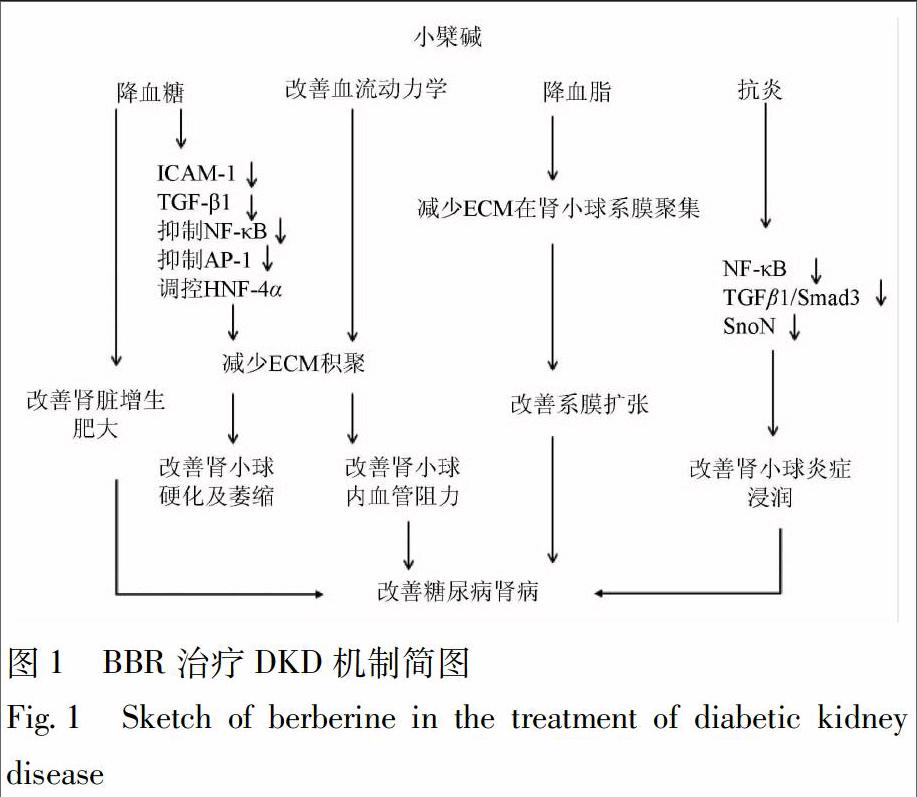
鉴于糖尿病对肾脏的多途径损害,造成DKD病情的复杂性,寻找安全且疗效确切的治疗药物具有重要意义。DKD确切的发病机制至今尚未阐明,目前相关的研究还不够充分,主要集中于降血糖、改善血流动力学、降血脂、抗炎等方面。BBR治疗DKD的实验研究有较多报道,在细胞及动物模型中探索BBR对DKD的治疗作用,并取得有价值的成果,体现出对DKD肾功能改善作用。但BBR治疗糖尿病肾病的作用机制非常复杂,需要进一步探索加以明确(图1)。
[参考文献]
[1]Yang W Y, Lu J M, Weng J P, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090.
[2]Atkins R C, Zimmet P. Diabetic kidney disease: act now or pay later[J]. Med J Aust, 2010, 192(5): 272.
[3]Catania J M, Chen G. Role of matrix metalloproteinases in renal pathophysiologies[J]. Am J Physiol Renal Physiol, 2007, 292(3): F905.
[4]Yin J, Xing H. Efficacy of berberine in patients with type 2 diabetes mellitus[J]. Metabolism, 2008, 57(5): 712.
[5]Kikkawa R, Koya D, Haneda M, et al. Progression of diabetic nephropathy[J]. Am J Kidney Dis, 2003, 41(3 Suppl 1): S19.
[6]Cumbie B C, Hermayer K L. Current concepts in targeted therapies for the pathophysiology of diabetic microvascular complications[J]. Vasc Health Risk Manag, 2007, 3(6): 823.
[7]Kamiyama M, Urushihara M, Morikawa T, et al. Oxidative stress/angiotensinogen/renin-angiotensin system axis in patients with diabetic nephropathy[J]. Int J Mol Sci, 2013, 14(11): 23045.
[8]Wu J, Mei C, H Vlassara, et al. Oxidative stress-induced JNK activation contributes to proinflammatory phenotype of aging diabetic mesangial cells[J]. Am J Physiol Renal Physiol, 2009, 297(6): F1622.
[9]Evans J L, Goldfine I D, Maddux B A, et al. Are oxidative stress-activated signaling pathways mediators of insulin resistance and beta-cell dysfunction[J]. Diabetes, 2003, 52(1): 1.
[10]Juncos L A, Ito S. Disparate effects of insulin on isolated rabbit afferent and efferent arterioles[J]. J Clin Invest, 1993, 92(4): 1981.
[11]Konrad D, Somwar R, Sweeney G, et al. The antihyperglycemic drug alpha-lipoic acid stimulates glucose uptake via both GLUT4 translocation and GLUT4 activation: potential role of p38 mitogen-activated protein kinase in GLUT4 activation[J]. Diabetes, 2001, 50(6): 1464.
[12]Aihara K, Ikeda Y, Yagi S, et al. Transforming growth factor-beta1 as a common target molecule for development of cardiovascular diseases, renal insufficiency and metabolic syndrome[J]. Cardiol Res Pract, 2010, 2011: 175381.
[13]Ni W J, Ding H H, Tang L Q. Berberine as a promising anti-diabetic nephropathy drug: an analysis of its effects and mechanisms[J]. Eur J Pharmacol, 2015, 760: 103.
[14]Srivastava S K, Ramana K V, Bhatnagar A. Role of aldose reductase and oxidative damage in diabetes and the consequent potential for therapeutic options[J]. Endocr Rev, 2005, 26(3): 380.
[15]Wei S, Zhang M, Yu Y, et al. Berberine attenuates development of the hepatic gluconeogenesis and lipid metabolism disorder in type 2 diabetic mice and in palmitate-incubated HepG2 cells through suppression of the HNF-4alpha miR122 pathway[J]. PLoS ONE, 2016, 11(3): e0152097.
[16]Liu W, Zhang X, Liu P, et al. Effects of berberine on matrix accumulation and NF-kappa B signal pathway in alloxan-induced diabetic mice with renal injury[J]. Eur J Pharmacol, 2010, 638(1/3): 150.
[17]Lan T, Wu T, Chen C, et al. Berberine attenuates high glucose-induced proliferation and extracellular matrix accumulation in mesangial cells: involvement of suppression of cell cycle progression and NF-kappaB/AP-1 pathways[J]. Mol Cell Endocrinol, 2014, 384(1/2): 109.
[18]Xia X, Yan J, Shen Y, et al. Berberine improves glucose metabolism in diabetic rats by inhibition of hepatic gluconeogenesis[J]. PLoS ONE, 2011, 6(2): e16556.
[19]Moghaddam H K, Baluchnejadmojarad T, Roghani M, et al. Berberine ameliorate oxidative stress and astrogliosis in the hippocampus of STZ-induced diabetic rats[J]. Mol Neurobiol, 2014, 49(2): 820.
[20]Hsu Y Y, Chen C S, Wu S N, et al. Berberine activates Nrf2 nuclear translocation and protects against oxidative damage via a phosphatidylinositol 3-kinase/Akt-dependent mechanism in NSC34 motor neuron-like cells[J]. Eur J Pharm Sci, 2012, 46(5): 415.
[21]Gnudi L, Viberti G, Raij L, et al. GLUT-1 overexpression: link between hemodynamic and metabolic factors in glomerular injury?[J]. Hypertension, 2003, 42(1): 19.
[22]Wolf G. New insights into the pathophysiology of diabetic nephropathy: from haemodynamics to molecular pathology[J]. Eur J Clin Invest, 2004, 34(12): 785.
[23]蘇衍进,马居里,王郁金. 糖肾一号胶囊对早期糖尿病肾病患者血浆AngⅡ及GMP-140影响[J]. 中国实验方剂学杂志, 2011(2): 227.
[24]Wu D, Wen W, Qi C L, et al. Ameliorative effect of berberine on renal damage in rats with diabetes induced by high-fat diet and streptozotocin[J]. Phytomedicine, 2012, 19(8/9): 712.
[25]Moorhead J F, Chan M K. Lipid nephrotoxicity in chronic progressive glomerular and tubulo-interstitial disease[J]. Lancet, 1982, 2(8311): 1309.
[26]Mooradian A D, Haas M J, Wehmeier K R, et al. Obesity-related changes in high-density lipoprotein metabolism[J]. Obesity (Silver Spring), 2008, 16(6): 1152.
[27]Haas M J, Mooradian A D. Regulation of high-density lipoprotein by inflammatory cytokines: establishing links between immune dysfunction and cardiovascular disease[J]. Diabetes Metab Res Rev, 2010, 26(2): 90.
[28]Ni W J, Tang L Q, Wei W. Research progress in signalling pathway in diabetic nephropathy[J]. Diabetes Metab Res Rev, 2015, 31(3): 221.
[29]Toyama T, Shimizu M, Furuichi K, et al. Treatment and impact of dyslipidemia in diabetic nephropathy[J]. Clin Exp Nephrol, 2014, 18(2): 201.
[30]司凤霞,杨殿生,王柏欣. 黄连素对2型糖尿病大鼠肾脏的保护作用[J]. 黑龙江医药科学, 2005(4):10.
[31]Chang W, Chen L, Hatch G M. Berberine as a therapy for type 2 diabetes and its complications: from mechanism of action to clinical studies[J]. Biochem Cell Biol, 2015, 93(5): 479.
[32]Li X, Liu W, Wang Q, et al. Emodin suppresses cell proliferation and fibronectin expression via p38MAPK pathway in rat mesangial cells cultured under high glucose[J]. Mol Cell Endocrinol, 2009, 307(1/2): 157.
[33]Krysiak R, Gdula-Dymek A, Bachowski R, et al. Pleiotropic effects of atorvastatin and fenofibrate in metabolic syndrome and different types of pre-diabetes[J]. Diabetes Care, 2010, 33(10): 2266.
[34]陈好利,万毅刚,赵青,等. 糖尿病肾病肾组织炎症信号通路p38MAPK的调节机制及中药的干预作用[J]. 中国中药杂志,2013,38(14):2268.
[35]Takeuchi O, Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6): 805.
[36]Shahzad K, Bock F, Dong W, et al. Nlrp3-inflammasome activation in non-myeloid-derived cells aggravates diabetic nephropathy[J]. Kidney Int, 2015, 87(1): 74.
[37]Okamura H, Tsutsi H, Komatsu T, et al. Cloning of a new cytokine that induces IFN-gamma production by T cells[J]. Nature, 1995, 378(6552): 88.
[38]Schwarz M, Wahl M, Resch K, et al. IFNgamma induces functional chemokine receptor expression in human mesangial cells[J]. Clin Exp Immunol, 2002, 128(2): 285.
[39]Sarker K P, Wilson S M, Bonni S. SnoN is a cell type-specific mediator of transforming growth factor-beta responses[J]. J Biol Chem, 2005, 280(13): 13037.
[40]Miyauchi K, Takiyama Y, Honjyo J, et al. Upregulated IL-18 expression in type 2 diabetic subjects with nephropathy: TGF-beta1 enhanced IL-18 expression in human renal proximal tubular epithelial cells[J]. Diabetes Res Clin Pract, 2009, 83(2): 190.
[41]DiPetrillo K, Gesek F A. Pentoxifylline ameliorates renal tumor necrosis factor expression, sodium retention, and renal hypertrophy in diabetic rats[J]. Am J Nephrol, 2004, 24(3): 352.
[42]Noronha I L, Niemir Z, Stein H, et al. Cytokines and growth factors in renal disease[J]. Nephrol Dial Transplant, 1995, 10(6): 775.
[43]邓晓威,谢宁.黄连素治疗2型糖尿病研究进展[J]. 中国中药杂志, 2014, 39(8): 1374.
[44]Lo S N, Shen C C, Chang C Y, et al. The effect of oxidation on berberine-mediated CYP1 inhibition: oxidation behavior and metabolite-mediated inhibition[J]. Drug Metab Dispos, 2015, 43(7): 1100.
[45]Wan X, Chen X, Liu L, et al. Berberine ameliorates chronic kidney injury caused by atherosclerotic renovascular disease through the suppression of NFkappaB signaling pathway in rats[J]. PLoS ONE, 2013, 8(3): e59794.
[46]刘圣,余娜,张小力,等. 小檗碱对早期糖尿病肾病大鼠肾组织TGF-β1/SnoN表达失衡及其Smad信号通路的调控作用[J]. 中国中药杂志,2012,37(23):3604.
[47]Jeong H W, Hsu K C, Lee J W, et al. Berberine suppresses proinflammatory responses through AMPK activation in macrophages[J]. Am J Physiol Endocrinol Metab, 2009, 296(4): E955.
[48]Sun S F, Zhao T T, Zhang H J, et al. Renoprotective effect of berberine on type 2 diabetic nephropathy in rats[J]. Clin Exp Pharmacol Physiol, 2015, 42(6): 662.
[責任编辑 张宁宁]

