嗜热菌乙醇代谢途径研究进展
乐易林+倪黎+郭星星
摘要:微生物利用木质纤维素发酵生产乙醇是可再生能源发展策略之一。人们对常温菌发酵生产乙醇的代谢途径和机理进行了广泛深入的研究。目前天然高效发酵产乙醇菌不能利用五碳糖,因为能利用五碳糖的常温菌乙醇产率低。随着产乙醇嗜热微生物的深入研究,嗜热菌发酵产乙醇的发展为研究带来了契机。文中综述了发酵产乙醇嗜热菌的种类、代谢途径及其关键酶功能特性的研究进展。
关键词:木质纤维素;乙醇;嗜热菌;代谢途径;五碳糖
中图分类号:S216.2 文献标志码: A
文章编号:1002-1302(2016)11-0022-04
我国农业每年产生大量秸秆,这些生物质如能得到开发利用,可以满足人类对能源的需求。木质纤维原料的开发利用是现代生物技术领域研究热点之一。木质纤维水解产生的五碳糖和六碳糖通过微生物发酵生产乙醇是可再生能源发展策略之一。以酿酒酵母(Saccharomyces cerevisiae)和运动发酵单孢菌(Zymomonas mobilis)为代表的乙醇代谢途径是通过丙酮酸脱羧酶(PDC)和乙醇脱氢酶(Adh)将丙酮酸转化成乙醇,即所谓的双酶法[1]。酵母菌和运动发酵单胞菌能将六碳糖转化成乙醇和二氧化碳,酵母菌和运动发酵单胞菌发酵生产乙醇的缺点是都不能代谢五碳糖产乙醇。针对酵母菌和运动发酵单胞菌不能利用五碳糖发酵乙醇的问题,将酿酒酵母或运动发酵单胞菌来源的丙酮酸脱羧酶和乙醇脱氢酶基因在能够高效代谢五碳糖的微生物中共表达,代谢五碳糖的微生物经过代谢工程改造从而获得发酵乙醇能力;也可以将五碳糖代谢途径在酿酒酵母和运动发酵单胞菌中表达,使代谢途径改造后的酿酒酵母和运动发酵单胞菌能够利用五碳糖发酵产乙醇[2-3]。
微生物中另外一条乙醇代谢途径是通过丙酮酸铁氧还蛋白氧化还原酶(POR)或丙酮酸甲酸裂解酶(PFL),将丙酮酸转化为乙酰辅酶A,再通过辅酶A-依赖型的乙醛脱氢酶(AdhE)转化为乙醛,最后在乙醇脱氢酶作用下生成乙醇,即所谓的三酶法。大肠杆菌虽然有完整的己糖和戊糖代谢途径,但用葡萄糖或木糖等进行发酵时,产物中乙醇只占很小的一部分,大部分为乳酸、甲酸、琥珀酸和醋酸等[4]。对产乙醇重组大肠杆菌的研究和探索进行了大量工作,将大肠杆菌代谢途径中的一些基因敲除,通过代谢工程改造获得具有乙醇生产能力较强的工程菌株[4]。
自20世纪80年代初,国外开始提出利用嗜热菌发酵生产乙醇[5]。嗜热菌利用底物范围比较广,即能够利用纤维素、半纤维素和淀粉,也可以利用木糖、葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖等发酵生产生物能源[6-9]。嗜热菌发酵生产乙醇的优势是能够同步进行原料的生物降解、乙醇发酵和产物分离。本文主要总结了嗜热菌乙醇代谢途径及其关键酶。
1 分离鉴定的产乙醇嗜热菌
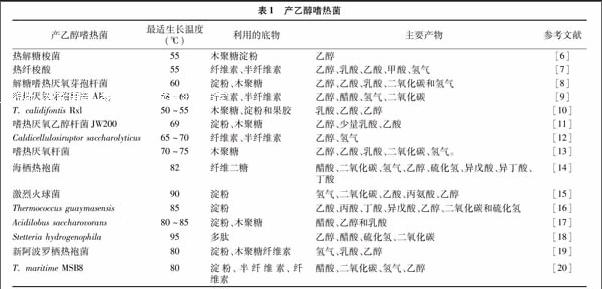
至今人们已经从多种环境中分离到产乙醇嗜热菌,主要有来源于梭菌属的热解糖梭菌(Clostridium thermosaccharolyticum)、热纤梭菌(C. thermocellum),热厌氧杆菌属的解糖嗜热厌氧芽孢杆菌(Thermoanaerobacterium saccharolyticum)、嗜热厌氧芽孢杆菌AK17(Thermoanaerobacterium AK17),来源极端嗜热菌的嗜热厌氧乙醇杆菌JW200(T. ethanolicus JW200),马瑞氏嗜热厌氧杆菌(T. mathranii)以及来源于超嗜热菌的激烈火球菌(Pyrococcus furiosus)、海栖热袍菌(Thermococcus paralvinellae)、新阿波罗栖热袍菌(Thermotoga neapolitana)(表1)[6-20]。虽然嗜热菌具有利用多种底物发酵生产乙醇的能力,但是目前嗜热菌发酵生产乙醇的浓度还很低,产物中除了乙醇,还伴有乳酸、乙酸、二氧化碳等。对嗜热菌发酵产乙醇的代谢调控机理是人们研究的热点。
2 嗜热菌乙醇代谢途径研究进展
嗜热微生物根据最适生长温度可以分成3类:最适生长温度在50~64 ℃的中温嗜热菌(moderate thermophiles)、最适生长温度在65~79 ℃的极端嗜热菌(extreme thermophiles)以及最适生长温度超过80 ℃的超嗜热菌(hyperthermophiles)[21]。
2.1 中温菌乙醇代谢途径
中温厌氧芽孢杆菌主要利用糖酵解途径(EMP)代谢葡萄糖生成丙酮酸,丙酮酸出路:一是直接被乳酸脱氢酶还原生成乳酸;一是生成乙酰辅酶A,乙酰辅酶A先后催化生成乙酸,或者乙酰辅酶A经乙醛脱氢酶和乙醇脱氢酶先后催化生成乙醇。一般高温菌的发酵途径大多为混合酸发酵途径,产物中除了乙醇,它们会产生乳酸、乙酸,有的还会产生二氧化碳、氢气等[6-8]。中温菌发酵产乙醇面临的问题有:伴有乳酸和乙酸等副产物,有机酸的积累对细菌的生长具有很强的抑制作用,同时乙醇产率和乙醇耐受性低。
最近分离到的1株高温厌氧芽孢杆菌发酵甘露醇产乙醇的初期,伴随着微量的乙酸产生,随后乙酸又立即被消耗。通过添加外源乙酸,发现高温厌氧芽孢杆菌的乙醇产量获得提高,推测RX1可能存在将乙酸转化为乙醇的代谢途径,目前对该菌的乙醇代谢途径还在研究中[10]。
2.2 极端嗜热菌乙醇代谢途径
极端嗜热菌如嗜热厌氧乙醇杆菌JW200最适生长温度为69 ℃,可以利用五碳糖、六碳糖、乳糖、蔗糖、纤维二糖、淀粉等发酵生产乙醇[11]。嗜热厌氧乙醇杆菌JW200发酵生產乙醇时,当乙醇浓度超过1%,乙醇发酵受到反馈抑制,产物从乙醇转向乙酸和乳酸。嗜热厌氧乙醇杆菌乙醇代谢受到严格的调控,人们对嗜热厌氧乙醇杆菌中的醛脱氢酶和醇脱氢酶的功能特性进行了系统研究,至2000年先后纯化了2种醇脱氢酶(AdhA和AdhB),并克隆了相应的基因AdhA和AdhB,酶学特性表明AdhB具有醛/醇脱氢酶双功能活性,起初人们认为AdhB是嗜热厌氧乙醇杆菌乙醇代谢的关键酶[22-23]。2008 年,从嗜热厌氧乙醇杆菌JW200中纯化到了醛脱氢酶(AdhE),AdhE具有醛/醇脱氢酶双功能[24]。随后AdhE基因也被克隆,在嗜热乙醇杆菌乙醇转化途径中存在2个双功能的醛/醇脱氢酶AdhB和AdhE以及一个醇脱氢酶AdhA。研究表明,在模拟的生理条件下,adhB只有微弱的醛脱氢酶活性,adhE却有很高的醛脱氢酶活性而没有醇脱氢酶活性。通过实时定量PCR测定adhA、adhB和adhE基因的转录情况,结果表明adhB和adhE的转录水平随着乙醇浓度的增加逐步下降[25]。随后试验表明,在嗜热厌氧杆菌中乙醇代谢关键酶基因表达受蛋白PAdhE-1和PAdhE-2(RSP)的调控[26]。
2.3 超嗜热菌乙醇代谢途径及其关键酶功能特性
研究表明超嗜热古菌激烈火球菌和超嗜热细菌新阿波罗栖热袍菌可以产生少量乙醇或微量乙醇以及一些醋酸、乳酸、氢气和二氧化碳[15,19]。对超嗜热古菌发酵产乙醇的机理还不是很清楚。尽管超嗜热菌基因组测序工作有了很大进展,在已测序的超嗜热菌基因组中还没有发现编码丙酮酸脱羧酶(PDC,可作用于丙酮酸形成二氧化碳和乙醛)的基因或是同源蛋白的基因[27]。此外,目前在超嗜热菌基因组中也没有发现AdhE的编码基因,AdhE功能之一是催化乙酰辅酶A生产乙醛。在极端嗜热菌如嗜热厌氧乙醇杆菌JW200中发现,AdhB醇脱氢酶具有醛/醇脱氢酶双功能活性,但是,目前研究的超嗜热菌来源的醇脱氢酶并不具有醛/醇脱氢酶活性功能[28-31]。来源激烈火球菌的醇脱氢酶最适反应温度超过 95 ℃,需要辅酶NADP+和金属离子Zn2+[29]。来源激烈火球菌的醇脱氢酶最适反应温度超过 95 ℃,最适反应pH值为10.4,需要辅酶NADP+和金属离子Zn2+[29]。来源激烈火球菌的醇脱氢酶最适反应温度超过 95 ℃,最适反应pH值为10.4,需要辅酶NADP+和金属离子Fe2+或Zn2+[29]。
迄今为止,在超嗜热菌中没有发现类似酿酒酵母和运动发酵单孢菌为代表的乙醇代谢途径,即通过丙酮酸脱羧酶(PDC)和乙醇脱氢酶(ADH)将丙酮酸转化成乙醇,也没有发现类似极端嗜热厌氧乙醇杆菌为代表的乙醇代谢途径(通过辅酶A-依赖型的乙醛脱氢酶(AdhE)转化为乙醛,最后在乙醇脱氢酶(ADH)作用下生成乙醇的代谢途径[27]。
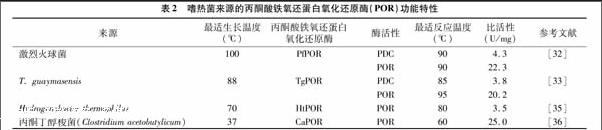
人们从超嗜热菌中分离纯化了丙酮酸铁氧还蛋白氧化还原酶(POR),并对POR进行了酶学特性分析。1997年,在超嗜热菌激烈火球菌中分离纯化到的一个TPP-和CoA-依赖型丙酮酸铁氧还蛋白氧化还原酶(POR),该酶具有双功能活性,具有POR活性和PDC活性[32]。随后在更多的超嗜热菌中纯化到丙酮酸铁氧还蛋白氧化还原酶(POR)[32-34]。表2比较了多种生物中分离纯化的丙酮酸铁氧还蛋白氧化还原酶(POR)的特性。来源于超嗜热菌激烈火球菌、海栖热袍菌的丙酮酸铁氧还蛋白氧化还原酶(POR)是一个双功能的酶,该酶既具有PDC活性,又具有POR活性[35-36]。但是在生理条件下,丙酮酸铁氧还蛋白氧化还原酶(POR)是更倾向于将丙酮酸转化为乙酰辅酶A,还是将丙酮酸直接转化为乙醛,目前还不是很清楚。
3 嗜热菌遗传转化体系
嗜热菌的遗传转化系统与常温菌的遗传转化技术有差异。高温条件下,大部分抗菌素会很快失效,一些抗药基因编码的蛋白质也不够稳定。目前,嗜热厌氧乙醇杆菌的基因转化技术已经建立[37]。运用超声波技术后,嗜热厌氧杆菌的基因转化效率得到提高[38]。超嗜热古菌的遗传转化技术发展迅速[39-42],營养缺陷型筛选标记在超嗜热古菌中得到应用,构建了乳清酸核苷-5-磷酸脱羧酶编码基因pyrF缺陷型菌株激烈火球菌(P. furiosus COM1)[39]。嗜热厌氧杆菌的转基因技术已成为研究胞内基因功能的重要步骤。
4 存在的问题与展望
嗜热菌具有广泛的底物利用能力,可以利用纤维素、半纤维素、淀粉等多聚糖底物,也可以利用核糖、木糖、葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖等发酵生产生物能源如乙醇和氢气[7,11,15]。嗜热菌高温发酵的优势既可以抑制杂菌的生长,又可以提高化合物的分散度和溶解度,从而引起人们的极大兴趣。目前面临的主要问题包括嗜热菌的遗传转化系统不够稳定、嗜热菌代谢途径及其调控机理不够清晰。随着合成生物学技术和基因组编辑技术的发展,嗜热菌的遗传转化和代谢途径的改造提供了巨大的发展空间和机遇。
参考文献:
[1]Kunduru M R,Pometto A L. Continuous ethanol production by Zymomonas mobilis and Saccharomyces cerevisiae in biofilm reactors[J]. J Ind Microbiol,1996,16(4):249-256.
[2]Ingram L O,Gomez P F,Lai X,et al. Metabolic engineering of bacteria for ethanol production[J]. Biotechnol Bioeng,1998,58(2/3):204-214.
[3]Nevoigt E. Progress in metabolic engineering of Saccharomyces cerevisiae[J]. Microbiol Mol Biol Rev,2008,72(3):379-412.
[4]Frster A H,Gescher J. Metabolic engineering of Escherichia coli for production of mixed-acid fermentation end products[J]. Front Bioeng Biotechnol,2014,2:16.
[5]Wiegel J. Formation of ethanol by bacteria. A pledge for the use of extreme thermophilic anaerobic bacteria in industrial ethanol fermentation processes[J]. Experientia,1980,36(12):1434-1446.
[6]Mistry F R,Cooney C L. Production of ethanol by Clostridium thermosaccharolyticum:Ⅰ. Effect of cell recycle and environmental parameters[J]. Biotechnol Bioeng,1989,34(10):1295-1304.
[7]Akinosho H,Yee K,Close D,et al. The emergence of Clostridium thermocellum as a high utility candidate for consolidated bioprocessing applications[J]. Front Chem,2014,2:66.
[8]Currie D H,Raman B,Gowen C M,et al. Genome-scale resources for Thermoanaerobacterium saccharolyticum[J]. BMC Syst Biol,2015,9(1):1.
[9]Almarsdottir A R,Sigurbjornsdottir M A,Orlygsson J. Effect of various factors on ethanol yields from lignocellulosic biomass by Thermoanaerobacterium AK17[J]. Biotechnol Bioeng,2012,109(3):686-694.
[10]Shang S M,Qian L,Zhang X,et al. Themoanaerobacterium calidifontis sp. nov.,a novel anaerobic,thermophilic,ethanol-producing bacterium from hot springs in China[J]. Arch Microbiol,2013,195(6):439-45.
[11]Wiegel J,Ljungdahl L G. Thermoanaerobacter ethanolicus gen. nov.,spec. nov.,a new,extremely,thermophilic,anaerobic bacterium[J]. Arch Microbiol,1981,128(4):343-348.
[12]Isern N G,Xue J,Rao J V,et al. Novel monosaccharide fermentation products in Caldicellulosiruptor saccharolyticus identified using NMR spectroscopy[J]. Biotechnol Biofuels,2013,6(1):47.
[13]Larsen L,Nielsen P,Ahring B K. Thermoanaerobacter mathranii sp. nov.,an ethanol-producing,extremely thermophilic anaerobic bacterium from a hot spring in Iceland[J]. Arch Microbiol,1997,168(2):114-119.
[14]Ma K,Loessner H,Heider J,et al. Effects of elemental sulfur on the metabolism of the deep-sea hyperthermophilic archaeon Thermococcus strain ES-1:characterization of a sulfur-regulated,non-heme iron alcohol dehydrogenase[J]. J Bacteriol,1995,177(16):4748-4756.
[15]Kengen S W,de Bok F A,van Loo N D,et al. Evidence for the operation of a novel Embden-Meyerhof pathway that involves ADP-dependent kinases during sugar fermentation by Pyrococcus furiosus[J]. J Biol Chem,1994,269(26):17537-17541.
[16]Ying X,Ma K. Characterization of a zinc-containing alcohol dehydrogenase with stereoselectivity from the hyperthermophilic archaeon Thermococcus guaymasensis[J]. J Bacteriol,2011,193(12):3009-3019.
[17]Prokofeva M I,Kostrikina N A,Kolganova T V,et al. Isolation of the anaerobic thermoacidophilic crenarchaeote Acidilobus saccharovorans sp. nov. and proposal of Acidilobales ord. nov.,including Acidilobaceae fam. nov. and Caldisphaeraceae fam. nov[J]. Int J Syst Evol Microbiol,2009,59(12):3116-3122.
[18]Jochimsen B,Peinemann-Simon S,Vlker H,et al. Stetteria hydrogenophila,gen. nov. and sp. nov.,a novel mixotrophic sulfur-dependent crenarchaeote isolated from Milos,Greece[J]. Extremophiles,1997,1(2):67-73.
[19]Vrije T,Bakker R R,Budde M A,et al. Efficient hydrogen production from the lignocellulosic energy crop Miscanthus by the extreme thermophilic bacteria Caldicellulosiruptor saccharolyticus and Thermotoga neapolitana[J]. Biotechnol Biofuels,2009,2(1):12.
[20]Eram M S,Wong A,Oduaran E,et al. Molecular and biochemical characterization of bifunctional pyruvate decarboxylases and pyruvate ferredoxin oxidoreductases from Thermotoga maritima and Thermotoga hypogea[J]. J Biochem,2015,158(6):459-466.
[21]Stetter,K O. Hyperthermophilic prokaryotes[J]. FEMS Microbiol Rev,1996,18:149-158.
[22]Holt P J,Williams R E,Jordan K N,et al. Cloning,sequencing and expression in Escherichia coli of the primary alcohol dehydrogenase gene from Thermoanaerobacter ethanolicus JW200[J]. FEMS Microbiol Lett,2000,190(1):57-62.
[23]Burdette D S,Vieille C,Zeikus J G. Cloning and expression of the gene encoding the Thermoanaerobacter ethanolicus 39E secondary-alcohol dehydrogenase and biochemical characterization of the enzyme[J]. Biochem J,1996,316(1):115-122.
[24]Peng H,Wu G,Shao W. The aldehyde/alcohol dehydrogenase(AdhE)in relation to the ethanol formation in Thermoanaerobacter ethanolicus JW200[J]. Anaerobe,2008,14(2):125-127.
[25]Pei J,Zhou Q,Jiang Y,et al. Thermoanaerobacter spp. control ethanol pathway via transcriptional regulation and versatility of key enzymes[J]. Metab Eng,2010,12(5):420-428.
[26]Pei J,Zhou Q,Jing Q,et al. The mechanism for regulating ethanol fermentation by redox levels in Thermoanaerobacter ethanolicus[J]. Metab Eng,2011,13(2):186-193.
[27]Eram M S,Ma K. Decarboxylation of pyruvate to acetaldehyde for ethanol production by hyperthermophiles[J]. Biomolecules,2013,3(3):578-596.
[28]Ying X,Ma K. Characterization of a zinc-containing alcohol dehydrogenase with stereoselectivity from the hyperthermophilic archaeon Thermococcus guaymasensis[J]. J Bacteriol,2011,193(12):3009-3019.
[29]Ying X,Grunden A M,Nie L,et al. Molecular characterization of the recombinant iron-containing alcohol dehydrogenase from the hyperthermophilic Archaeon,Thermococcus strain ES1[J]. Extremophiles,2009,13(2):299-311.
[30]Ma K,Adams M W. An unusual oxygen-sensitive,iron-and zinc-containing alcohol dehydrogenase from the hyperthermophilic archaeon Pyrococcus furiosus[J]. J Bacteriol,1999,181(4):1163-1170.
[31]Schwarzenbacher R,von Delft F,Canaves J M,et al. Crystal structure of an iron-containing 1,3-propanediol dehydrogenase(TM0920)from Thermotoga maritima at 1.3 A resolution[J]. Proteins,2004,54(1):174-177.
[32]Ma K,Hutchins A,Sung S J,et al. Pyruvate ferredoxin oxidoreductase from the hyperthermophilic archaeon,Pyrococcus furiosus,functions as a CoA-dependent pyruvate decarboxylase[J]. Proc Natl Acad Sci,1997,94(18):9608-9613.
[33]Eram M S,Oduaran E,Ma K. The bifunctional pyruvate decarboxylase/pyruvate ferredoxin oxidoreductase from Thermococcus guaymasensis[J]. Archaea,2014,2014:349379.
[34]Eram M S,Wong A,Oduaran E,et al. Molecular and biochemical characterization of bifunctional pyruvate decarboxylases and pyruvate ferredoxin oxidoreductases from Thermotoga maritima and Thermotoga hypogea[J]. J Biochem,2015,158(6):459-466.
[35]Yoon K S,Ishii M,Kodama T,et al. Purification and characterization of pyruvate:ferredoxin oxidoreductase from Hydrogenobacter thermophilus TK-6[J]. Arch Microbiol,1997,167(5):275-279.
[36]Meinecke B,Bertram J,Gottschalk G. Purification and characterization of the pyruvate-ferredoxin oxidoreductase from Clostridium acetobutylicum[J]. Arch Microbiol,1989,152(3):244-250.
[37]Peng H,Fu B,Mao Z,et al. Electrotransformation of Thermoanaerobacter ethanolicus JW200[J]. Biotechnol Lett,2006,28(23):1913-1917.
[38]Lin L,Song H,Ji Y,et al. Ultrasound-mediated DNA transformation in thermophilic gram-positive anaerobes[J]. PLoS One,2010,5(9):e12582.
[39]Farkas J,Stirrett K,Lipscomb G L,et al. Recombinogenic properties of Pyrococcus furiosus strain COM1 enable rapid selection of targeted mutants[J]. Appl Environ Microbiol,2012,78(13):4669-4676.
[40]Lipscomb G L,Stirrett K,Schut G J,et al. Natural competence in the hyperthermophilic archaeon Pyrococcus furiosus facilitates genetic manipulation:construction of markerless deletions of genes encoding the two cytoplasmic hydrogenases[J]. Appl Environ Microbiol,2011,77(7):2232-2238.
[41]Hopkins R C,Sun J,Francis E,et al. Homologous expression of a subcomplex of Pyrococcus furiosus hydrogenase that interacts with pyruvate ferredoxin oxidoreductase[J]. PLoS One,2011,6(10):e26569.
[42]Thiel A,Michoud G,Moalic Y,et al. Genetic manipulations of the hyperthermophilic piezophilic archaeon Thermococcus barophilus[J]. Appl Environ Microbiol,2014,80(7):2299-2306.

