不对称PCR的引物浓度优化及在柑橘基因型分析上的应用
魏召新+朱世平+阳佳位
摘要:对柑橘不对称PCR的引物比例浓度进行优化筛选,并以不同柑橘品种的基因组片段为模板验证不对称PCR在柑橘品种基因型分析中的可行性。结果表明,不对称PCR双侧的引物最佳浓度因引物不同而不同,当浓度为10 ∶1时均能达到理想效果,可见不对称PCR可以用于柑橘基因型分析。
关键词:不对称PCR;单链构象多态性;柑橘;引物浓度比;基因型分析
中图分类号: S666.201 文献标志码: A
文章编号:1002-1302(2016)11-0046-02
不对称PCR利用不等量的一对引物进行PCR扩增,产生单链产物(ssDNA),这对引物分别称为非限制性引物与限制性引物。在PCR反应的最初10~15个循环中,其扩增产物主要是双链DNA(dsDNA),但当限制性引物消耗完后,非限制性引物引导的PCR就会产生大量的单链产物。不对称PCR作为一个基础试验技术,方法简单、成本低廉、用途广泛,用于制备单链模板以用于双脱氧测序[1],用于cDNA扩增以研究真核生物的DNA外显子[2],用于单链探针制备[3],还可与酶联免疫法结合检测柑橘CTV病毒[4],甚至结合毛细管电泳技术对人进行疾病诊断[5]。
不对称PCR制备ssDNA须多次摸索优化2条引物的比例。常规不对称PCR是利用单侧引物进行一次PCR,然后进行电泳检测,这种方法要消耗大量的DNA模板。而二次PCR是先用等浓度的引物PCR扩增制备dsDNA,然后以此dsDNA为模板,再以其中的一条引物进行第2次PCR,制备ssDNA,大大减少模板的消耗量,产生的dsDNA与ssDNA由于分子量不同可以在电泳中分开,并可利用单链构象多态性鉴别不同样品之间的差异。
利用不对称PCR进行基因差异分析,不仅具有PCR-SSCP研究单核苷酸多态性(SNP)的功能,而且简化了操作步骤,提高了工作效率。柑橘资源丰富、品种繁多、种属间易于杂交、芽变材料多、基因组大(约367 Mbp)[6],随着甜橙[7]和单倍体克里曼丁橘[8]成功测序推动,SNP研究必將得到进一步拓展和深化,尽管有利用不对称PCR对基因突变效率进行检测的报道[9],但利用SNP应用于柑橘基因研究方面还比较少,因此本试验对不对称PCR体系中上下游引物浓度比进行优化,并以柑橘为材料进行基因型研究的可行性。
1 材料与方法
根据柑橘的基因序列设计3对引物,产物片段长度在 100~300 bp。采用二次PCR方式,均采用25 μL体系,ddH2O 18.35 μL,10×Buffer 2.5 μL,dNTPs(25 mmol/L)1.0 μL,MgCl2 1 μL,上游引物0.5 μL,下游引物0.5 μL,rTaq 0.15 μL,模板1.0 μL。引物M1源于Unigen Cit.47.1,上游引物为5′-CCGAGAAAACGCAAAAGCTA-3′,下游引物为5′-TTGTACTCGAGCAGCGACAC-3′。引物M2源于Unigen Cit.107.1,上游引物为5′-CCCTGAGACGAAGAACAAGG-3′,下游引物为5′-CTGGCAAGCAACTGGAAGAC-3′。引物M3源于Unigen Cit.10080.1,上游引物为5′-ACCATGACCGCTGAGGAATA-3′,下游引物为5′-GGAAAACAGGGCAACTTCAG-3′。其中,第2次PCR引物对在一侧引物保持原浓度的条件下,另一侧引物按比例稀释,模板以第1次PCR产物稀释100~200倍后,各组分均按第1次PCR体系体积加入反应体系。
PCR反应条件沿用前期优化过的PCR反应条件:95 ℃ 预变性5 min;94 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃延伸 30 s,33 个循环;最后72 ℃ 延伸10 min 。取3 μL扩增产物,加6 μL 98%去离子甲酰胺,10 mmol/L EDTA(pH值8.0),0.25% 二甲苯青,0.25%溴酚蓝变性剂混匀,上样于10%聚丙烯酰胺凝胶(polyacrylamide gel electrophoresis,PAGE),10 ℃ 110 V条件下电泳5 h,银染显色。
2 结果与分析
2.1 不对称PCR引物浓度比优化
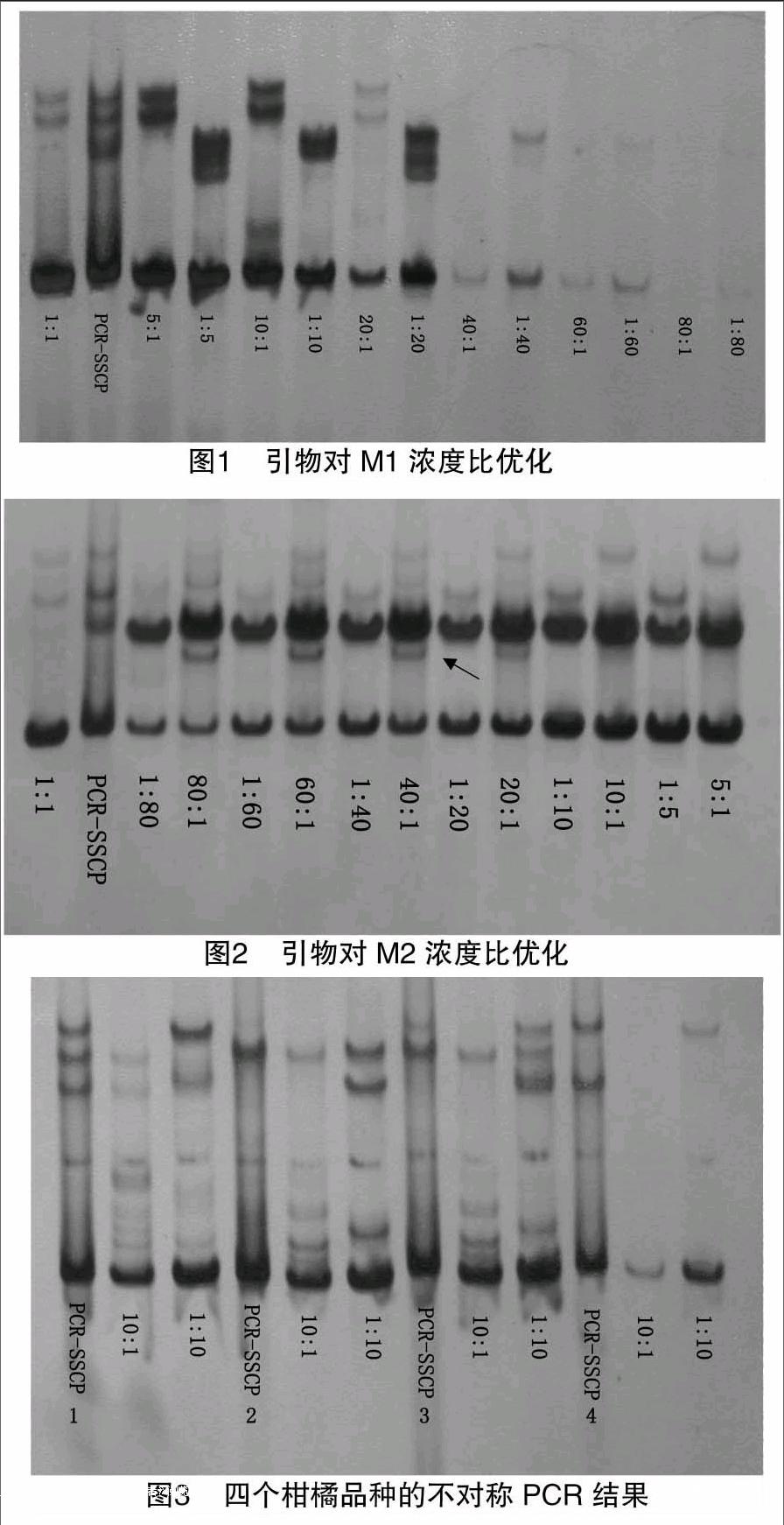
以特洛维塔甜橙的DNA为模板,采用M1和M2引物对进行引物不同浓度的不对称PCR比较,电泳结果见图1和图2。图1和图2中各对应的泳道其产物PCR条件和电泳条件均相同,唯一不同的是引物,电泳后的效果差异明显,图1中上下游引物从40 ∶1时产物带开始明显不清晰,但图2中的单双链产物始终存在。
由图1的电泳结果可见,随着单侧引物浓度的降低,双链产物和单链产物也逐渐减少,上下游引物比例在10 ∶1时,单链产物量未明显降低,不影响产物电泳及显色观察;上下游引物比例变为20 ∶1时,单链产物量明显减少。此外,在上下游引物浓度比为1 ∶5、1 ∶10、1 ∶20和1 ∶40时,带型明显不能对应正常PCR-SSCP的带型,而引物相反浓度的电泳结果正确对应正常PCR-SSCP的带型,这说明下游引物所产生的单链之间形成了多种构象。
由图2的电泳结果可见,M2引物对不同浓度比例的优化结果有所不同,随着单侧引物浓度的增加,双链产物也逐渐增加,但单链产物量增加不明显。此外,在上下游引物浓度比例为80 ∶1、60 ∶1、40 ∶1和20 ∶1的电泳图中,可见一特殊条带(图2中箭头所示),此条带仅在下游引物中出现,在相反的上下游引物浓度比中未出现,并且不能对应到正常PCR-SSCP的带型,这应该是下游引物产生的单链之间形成的二级结构。
2.2 不同模板的不对称PCR验证
由图3中电泳结果可见,以模板1、2、3、4进行不对称PCR所得产物带型因模板不同而相同。同一个模板,因上下游引物浓度比例不同也会产生不同的带型,通过比较上下游引物不对称PCR的带型和常规PCR-SSCP的带型,可以推断带型的来源。反之,可以以不对称产物带型的不同推断产物之间存在差异,以此鉴别产物的差异,也可以判断不同材料的基因型以进行聚类分析。
图3中1、2、3和4由左至右依次是以不同的柑橘品种特洛维塔、圆金柑、长寿金柑和红河大翼橙为模板,利用M3引物对按上下游引物1 ∶1常规PCR-SSCP、10 ∶1和1 ∶10进行二次不对称PCR的结果。
3 结论与讨论
本试验通过不对称PCR研究单侧引物在双链模板上延伸的合理条件,同时探索利用该方法进行基因型鉴定的可行性。以上试验结果表明,不对称PCR可以用于单链产物扩增,也可以用于部分柑橘品种区分、等位基因分析及目标片段的基因型鉴定。
不对称PCR反应扩增长度有限,在多次试验中,目标片段长度在500 bp以上的结果均不理想,因此利用普通Taq酶进行不对称PCR时,所扩增的目的片段长度不宜过长,一般宜控制在500 bp以下。而研究长片段时,宜改用或改进试验方法,Sofia等在研究欧洲栗内切β-1,3-葡聚糖酶基因的一段片段(1 231 bp)时,就改用了不对称巢式PCR技术,采用多个引物进行研究[10]。此外,用其他方法可以对引物进行常规预扩增,产物经PAGE检测目标双链仅1条带,无杂带干扰,以获得带型简单易于分析的结果。从本试验结果比较可见,不同引物的PCR效率是不同的,甚至模板也能影响引物的扩增效率,因此必要时可以对引物进行初步筛选或结合其他方式进一步分析,Gruz等利用不对称PCR技术结合熔解曲线分析能够对单核苷酸多态性进行高通量的基因分型[11]。
常规的PCR条件下,不对称PCR所使用的引物的量不同,一次PCR所获得单链产物较少,要获得更多单链产物,模板浓度应足够大,或进行二次PCR。尽管曾鸿普等一次不对称PCR就得到了较为清晰的结果[12],但在试验过程中发现,第1次PCR产物稀释100~200倍后作为二次PCR的模板进行不对称PCR,不仅大大减少了模板用量,而且带型清晰、易于分析,结果更为理想。
单侧引物浓度不变,另一侧引物稀释为原浓度的1/10后进行不对称PCR,目标双链和单链产物带清晰,浓度比例较为适当,也说明二次不对称PCR同时使用上下游引物更容易获得高浓度的dsDNA。此外,本试验结果表明单链产物在利用单链构象多态性进行凝胶检测时,单链在凝胶上所体现的形式因单链产物及其自身所形成的构象不同而可能有多种,因此基于SSCP的产物检测应注意在相同条件下进行多重比较,以避免误判,方能获得更为可靠的分析结果。
参考文献:
[1]彭年才,张丽丽,王春林,等. 用于焦磷酸测序的不对称PCR制备单链DNA实验研究[C]//中国生物医学工程进展——2007中国生物医学工程联合学术年会论文集:下册. 西安:中国电子学会生物医学电子学分会、中国生物医学工程学会生物医学测量分会、中国生物医学工程学会生物信息与控制分会、中国生物医学工程学会生物医学传感器技术学会,2007:162-164.
[2]李 红,毛伟敏. 非小细胞肺癌患者XRCC1基因多态性对p53基因突变发生的影响[J]. 临床肿瘤学杂志,2009,14(9):777-781.
[3]Wu G F,Wang Z,Yang N. Electrochemical detection of β-1,3-glucanase gene from transgenic capsicums using asymmetric PCR generated by a detecting probe and an anchoring probe[J]. Journal of Biotechnology,2010,145(11):1-8.
[4]Nolascoa G,Santosb C,Silvaa G,et al. Development of an asymmetric PCR-ELISA typing method for citrus tristeza virus based on the coat protein gene[J]. Journal of Virological Methods,2009,155(2):97-108.
[5]Shin G W,Cho Y S,Hwang H S,et al. A new single-step quantitative pathogen detection system:Template-tagging followed by multiplex asymmetric PCR using common primers and CE-SSCP[J]. Electrophoresis,2009,30(15):2728-2736.
[6]Ollitrault P,Jacquemond C,Dubois C,et al.Citrus. In Genetic diversity of cultivated tropical plants[M]. Montpellier:CIRAD edition,2003:193-217.
[7]Gmitter F G.The haploid mandarin and diploid sweet orange genome sequences[C]. Plant & Animal Genomes XIX Conference. San Diego:CA,2011:15-19.
[8]Aleza P,Juarez J,Hernandez M,et al.Recovery and characterization of a Citrus clementina Hort. ex Tan. ‘Clemenules haploid plant selected to establish the reference whole citrus genome sequence[J]. BMC Plant Biol 2009,9(11):110.
[9]張小辉,许尚忠,高 雪,等. 不对称PCR-SSCP在基因突变检测中的应用[J]. 西北农林科技大学学报:自然科学版,2007,35(6):15-18.
[10]Sofia M,Marisa C,ngel D,et al. Isolation and characterization by asymmetric PCR of the ENDO1 gene for glucan endo-1,3-β-D-glucosidase in Phytophthora cinnamomi associated with the ink disease of Castanea sativa Mill[J]. Brazilian Archives of Biology and Technology,2010,53(3):513-518.
[11]Cruz R E,Shokoples S E.,Manage D P. High-throughput genotyping of single nucleotide polymorphisms in the Plasmodium falciparum dhfr gene by asymmetric PCR and melt-curve analysis[J]. Journal of Clinical Microbiology,2010,48(9 ):3081-3087.
[12]曾鸿普,王东劲,管 松,等. 五指山猪H-FABP基因不对称PCR-SSCP研究[J]. 家畜生态学报,2009,30(2):18-21.

