蜻蜓凤梨AfERF109基因的克隆及响应乙烯的表达特性分析
雷明+王之+王加宾

摘要:以热带观赏花卉蜻蜓凤梨(Aechemia fasciata)为材料,在分析蜻蜓凤梨转录组数据的基础上,结合cDNA末端快速扩增(rapid amplification of cDNA ends,简称RACE)技术克隆了APETALA2/乙烯反应元件结合蛋白(APETALA2/Ethylene Response Element Binding Protein,简称AP2/EREBP)家族的1个转录因子编码序列,并将其命名为AfERF109。AfERF109基因cDNA全长939 bp,开放阅读框(open reading frame,ORF)长762 bp,编码的蛋白含253个氨基酸残基。AfERF109分子量为28.275 1 ku,理论等电点为5.24;AfERF109不含信号肽和跨膜域,预测其定位于细胞核;AfERF109含有1个典型的AP2结构域,该结构域的二、三级结构构象保守;系统进化分析该蛋白分属ERF亚族的B-4类。实时荧光定量PCR分析表明,AfERF109转录本的表达量随着植株年龄的增长上调,在开花后的花柄中表达量最高。此外,AfERF109转录本的表达量受外源乙烯处理呈现正调控趋势。研究结果初步证实AfERF109参与乙烯调控路径,可能参与蜻蜓凤梨营养生长到生殖生长的时期转换及花柄的发育,为进一步研究AfERF109基因功能、通过基因工程手段调控蜻蜓凤梨开花提供了理论依据。
关键词:蜻蜓凤梨;AfERF109;克隆;乙烯;表达特性分析
中图分类号: S668.301 文献标志码: A
文章编号:1002-1302(2016)11-0051-06
凤梨科植物(Bromeliaceae)原产于南美洲,是一类广泛分布于热带亚热带地区、形态多样的植物之一[1-2]。人工栽培种中,按照用途可以将其分为重要的热带水果——食用凤梨(俗称菠萝,Ananas comosus)和重要的热带花卉——观赏凤梨。常用作观赏的凤梨品种有光萼荷属(Aechmea)、果子蔓属(Guzmania)、铁兰属(Tillandsia)、彩叶凤梨属(Neoregelia)、 水塔花属(Billbergia)、 姬凤梨属(Crytanthus)、 巢凤梨属(Nidularium)等[3]。观赏凤梨株型优美、花型奇特、花期持久,相应市场发展突飞猛进,已成为仅次于兰花和红掌的第三大热带花卉[4]。
为了满足市场需求,调节上市时间,生产上普遍使用乙烯及其衍生物促进凤梨科植物开花。利用14C标记的乙烯利处理凤梨的结果表明,其吸收外源乙烯的部位为叶片[5]。阻断内源乙烯合成后,凤梨在乙烯诱导和自然生长条件下开花时间均显著延迟[6-8],这表明施加外源乙烯及其衍生物增加了内源乙烯含量,从而促进了凤梨开花,但一直以来内源乙烯调控凤梨等凤梨科植物开花的机制并不清楚。
作为一种植物生长调节物质,乙烯参与了种子萌发、幼苗生长、开花诱导、果实成熟、器官衰老和病原菌响应等植物生长发育过程[9-10]。在拟南芥中,乙烯受体蛋白结合乙烯后抑制了Raf-like Ser/Thr 蛋白酶 CONSTITUTIVE TRIPLE RESPONSE1(简称CTR1)的磷酸化能力,激活膜蛋白ETHYLENE INSENSITIVE2(简称EIN2),使得转录因子EIN3在核内稳定表达[11-14]。EIN3蛋白则通过结合到Ethylene Response Factors(ERFs)基因(如ERF1)的启动子区,调控后者的表达,最终启动植物体对各种信号的应答响应[15]。
ERFs基因编码的是一类家族蛋白,这类蛋白属于APETALA2/Ethylene Response Element Binding Protein(簡称AP2/EREBP)家族。以前一直认为AP2/EREBP家族为植物所特有,现在发现其广泛存在于植物、原生生物、蓝藻和真菌中[16-17]。AP2/EREBP家族蛋白的共同特点是含有1或2个保守的AP2结构域。ERFs属于AP2/EREBP家族中的1个亚族,该亚族成员含有1个AP2结构域,大部分为转录激活因子,少部分为转录抑制因子[18-22]。ERFs转录因子主要通过结合到靶基因启动子区的核心AGCCGCC(简称GCC盒)顺式元件和(或)干旱响应元件(dehydration-responsive elements,简称DREs/CRT)上应答生物和非生物胁迫,功能广泛[23-27]。
目前关于乙烯促进观赏凤梨科植物开花分子机制的研究相对较少。Li等曾通过转录组分析在蜻蜓凤梨中筛选到一些响应乙烯的AP2/EREBP家族基因[28],Lei等证明了AP2/EREBP家族中的1个AP2同源基因AfAP2-1响应了外源乙烯处理,且在拟南芥中过表达显著延迟了开花[29]。笔者从蜻蜓凤梨(Aechmea fasciata)中克隆到1个ERF亚族蛋白编码基因AfERF109,通过实时荧光定量PCR(quantitative real-time PCR,简称qRT-PCR)技术研究其组织表达特异性,发现其表达响应了外源乙烯处理,为进一步解析乙烯调控其表达的分子机制、通过基因工程手段调控凤梨科植物生长发育的研究提供了理论依据。
1 材料与方法
1.1 材料与处理
蜻蜓凤梨取自中国热带农业科学院热带作物品种资源研究所离体保存与繁育研究室大棚,环境温度为30~32 ℃。所用材料均为移栽成活的试管苗,幼株为成活后株龄6个月的植株;成株为成活后株龄11~14个月的植株。外源乙烯利处理时,取10 mL体积分数为400 μL/L的乙烯利灌心分别处理1、6、24 h,以清水灌心的材料为对照。不同组织材料在处理后迅速于液氮中冷冻,之后置于-80 ℃冰箱中保存备用。
1.2 总RNA提取及cDNA第1条链的合成
蜻蜓凤梨总RNA的提取采用改良的CTAB法[30]。cDNA第1条链的合成采用TranScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(法国Transgene股份有限公司)。
1.3 5′和3′ RACE
克隆目的基因的5′和3′ RACE模板参照SMARTerTM RACE cDNA Amplification Kit说明书合成(美国Clontech公司)。PCR扩增得到的特异性条带采用美国OMEGA公司的胶回收试剂盒进行回收。纯化后的特异条带分别连接到pEASY-blunt克隆载体上,测序。
1.4 生物信息学分析
用DNAMAN 6.0软件比对氨基酸序列的同源性;用MEGA 6软件和邻接法构建进化树;其他生物信息学分析软件见表1。
1.5 实时荧光定量PCR
运用Primer premier 5.0 设计用于实时荧光定量PCR的各基因特异性引物。选用TransStart Tip Green qPCR SuperMix(法国Transgene股份有限公司)进行PCR反应,在Therma PikoReal 96TM荧光定量PCR仪(美国Thermo Fisher Scientific公司)上进行。反应体系(10 μL):qRT-PCR混合反应液SuperMix 5 μL,模板1 μL,正反向引物各0.3 μL,灭菌的去离子水补齐至10 μL;反应程序:95 ℃预变性7 min;在95 ℃ 5 s、60 ℃ 30 s的条件下扩增40个循环,循环结束后于65 ℃ 30 s,20 ℃停止。每个样品2个生物学重复,3次技术重复。数据分析采用双delta法,选取蜻蜓凤梨的β-actin(AfACTB)为内参。通过制作标准曲线获得目的基因和内参基因的扩增效率。所有引物序列见表2。
2 结果与分析
2.1 AfERF109 cDNA全长的克隆与序列分析
以蜻蜓凤梨心叶cDNA为模板,利用RACE及PCR技术获得1条长度为939 bp的AP2/EREBP家族基因的cDNA序列。分析后发现,其5′非编码区、3′非编码区长度分别为40、137 bp(包括30 bp的polyA)。该cDNA序列有1个762 bp的开放阅读框,编码253个氨基酸残基。Blast比对后发现,该cDNA编码序列与很多植物中AP2/EREBP家族中ERF亚族的ERF109或ERF109-like具有很高的相似性,故将其命名为AfERF109。
2.2 AfERF109属于ERF亚族的B-4类
结构域分析发现,AfERF109具有1个典型的AP2结构域(图1-A),因此,为了进一步分析AfERF109蛋白的一级结构特性,笔者将其与其他物种中的ERF109蛋白进行同源性比对,结果表明,AfERF109与海枣(Phoenix dactylifera)的ERF109、油棕(Elaeis guineensis)的ERF109、二穗短柄草(Brachypodium distachyon)的ERF109、小果野芭蕉(Musa acuminata subsp. malaccensis)的ERF109和小米(Setaria italica)的ERF109分别具有48.86%、48.34%、45.36%、45.21%、44.24%的同源性(图1-B)。进一步分析发现,AfERF109的AP2结构域包含保守的YPG和RAYD元件(图1-B)。此外,该保守的AP2结构域的第14位和第19位分别为保守的丙氨酸(Ala,A)和天冬氨酸(Asp,D)残基(图1-B)。因此,根据这些结构特点,AfERF109被归为AP2/EREBP家族的ERF亚族。
已知ERF亚族又可以分为B-1到B-6共6类,因此,为了进一步分析AfERF109的类别,笔者将其与拟南芥ERF亚族B-1到B-6类别中的部分蛋白序列进行进化树分析,结果发现AfERF109在进化关系上并不与AtERF109同属于B-3类,而是与拟南芥RAP2.6和RAP2.6L等的进化关系最近,同属于B-4类(图2)。
2.3 AfERF109是定位于细胞核的酸性亲水蛋白
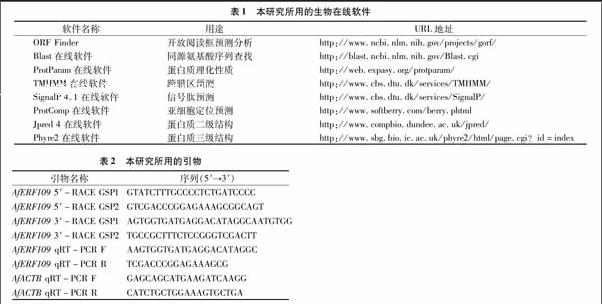
为了进一步了解AfERF109蛋白的特性,笔者对其一系列理化性质进行了分析。ProtoParam在线软件分析表明,AfERF109的分子量为28.275 1 ku,理论等电点为5.24;总平均亲水性(grand average of hydropathicity,简称GRAVY)、脂肪系数(aliphatic index)分别为-0.892、56.80,表明AfERF109属于酸性親水蛋白类,脂溶性较差。
为了进一步验证AfERF109的亲疏水性,笔者利用ProtScale在线软件对其进行进一步的分析该蛋白的绝大部分氨基酸都是亲水性氨基酸(图3-A),因此,AfERF109为亲水性蛋白。为了解析AfERF109是否具有跨膜区,笔者利用TMHMM在线软件对其进行分析,结果发现,该蛋白中可能位于跨膜螺旋中的氨基酸残基数的分值为 0.421 56,远小于18,故推测其不含跨膜区(图3-B)。进一步用SignalP 4.1在线软件对AfERF109信号肽预测的结果表明,该蛋白序列中不含信号肽(图3-C)。AfERF109属于AP2/EREBP转录因子家族,理论上可结合到靶标基因的启动子区顺式作用元件上调控后者的表达。因此,为了了解其是否定位于细胞核,笔者用ProtComp软件进行预测,结果表明,AfERF109在核中的分值为6.15(总分为10),极有可能是一种定位于细胞核的非分泌蛋白。
2.4 AfERF109的二级和三级结构
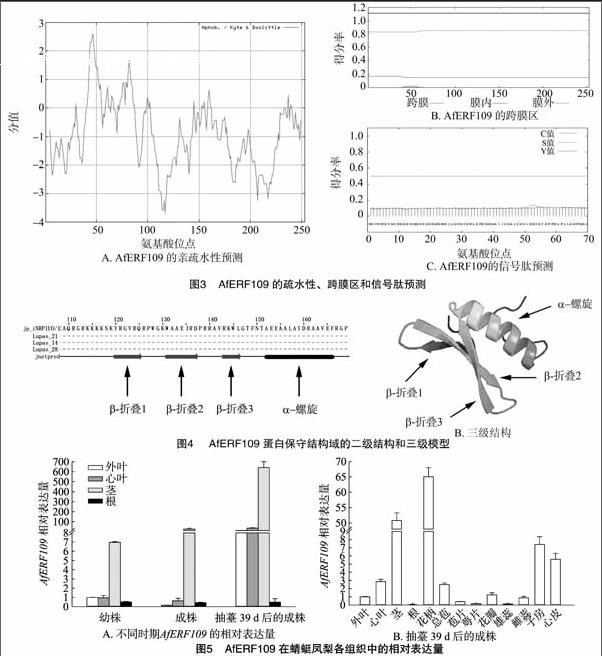
蛋白只有形成稳定的空间结构才能执行一定的功能。因此,笔者首先利用Jpred 4在线软件对其二级结构进行解析。结果表明,AfERF109二级结构中有4个β-折叠和2个 α- 螺旋,其中,在保守的AP2结构域中含有3个β-折叠和1个α-螺旋(图4-A)。笔者进一步对AfERF109的60个氨基酸残基组成的AP2结构域进行三维结构构建。从图4-B中可以看出,该三维结构图中含有3个反向平行的β-折叠,而在N端则具有1个典型的α-螺旋。该结构与包括拟南芥的ERF1在内的很多ERF蛋白的AP2结构域构象类似,表明预测的三维结构合理。
2.5 AfERF109在蜻蜓凤梨中的组织表达特性
为了研究AfERF109在蜻蜓凤梨各组织中的表达特性,笔者分别选取了幼株、成株和抽薹39 d后成株的外叶、心叶、茎和根,提取RNA,反转录成cDNA,以此为模板利用实时荧光定量PCR技术对其进行验证。结果显示,AfERF109在检测的营养器官和生殖器官中均有表达,尤其是在抽薹39 d后成株的外叶、心叶和茎中的表达量相比幼株组织明显上升(图5)。
2.6 AfERF109的转录本表达响应了外源乙烯处理
已知ERF家族很多成员均可以响应外源乙烯处理,影响靶标下游基因的表达[27,29]。为了验证AfERF109对外源乙烯处理的响应情况,笔者分别对乙烯处理不同时间后蜻蜓凤梨幼株和成株的外叶、心叶、茎和根中AfERF109转录本的表达情况进行检测。结果显示,无论是在幼株还是在成株中,AfERF109转录本的表达量均响应了外源乙烯处理(图6)。幼株中,乙烯处理1 h后,外叶、茎和根中AfERF109的表达量明显上升,到6 h则迅速下降到处理前的水平;在心叶中,AfERF109的表达量在乙烯处理6 h后上调(图6-A)。成株中,乙烯处理1 h后,AfERF109在外叶、心叶和根中的表达量明显上调,随着处理时间的延长,表达量逐渐下降;在茎中,AfERF109的表达量则呈现下降—上升—下降的趋势(图6-B)。这些结果暗示在幼株和成熟株的不同组织中,AfERF109对外源乙烯响应的方式不尽相同。
2 结论与讨论
AP2/EREBP转录因子是一类大家族,在水稻、拟南芥、大豆中分別有157、147、148个[31-32]。作为AP2/EREBP中的1个亚族,ERF中的很多成员参与了成花诱导和花器官发育的调控。在拟南芥中,过表达ERF96导致莲座叶变小,开花延迟[33]。AP2/EREBP家族的1个同源基因EARLY BUD-BREAK(EBB)在杨树(Populus)、葡萄(Vitis)、云杉(Picea asperata)、日本梨(Pyrus pyrifolia Nakai)等多年生木本植物中均正调控了花芽的形成[34-36]。此外,在矮牵牛(Petunia hybrida)中,PhERFs基因还参与了花器官尤其是花瓣和雌蕊的衰老调控[37]。本研究中,蜻蜓凤梨从营养生长到生殖生长的过程中,AfERF109转录本在外叶、心叶和茎中的表达量显著上升(图5-A),直至成花39 d后的植株中依然持续高水平表达,暗示AfERF109可能参与了蜻蜓凤梨从营养生长到生殖生长时期的转换。凤梨科植物花芽分化部位位于心叶围绕的茎尖。从图5-A中也可以看出,在每个检测时期,AfERF109的转录本在茎尖的表达量均是最高的,尤其是在开花39 d后的茎中表达量相较于幼株茎中的表达量上升了92倍,表明AfERF109很可能参与了蜻蜓凤梨的成花诱导和花器官发育过程。另外,在成花39 d后的植株中,蜻蜓凤梨在花柄中的表达量在所有检测的同时期营养器官和生殖器官中的表达量最高,甚至超过了茎中的表达量(图5-B),进一步证明了AfERF109在花柄发育中可能具有重要作用。AfERF109在其他生殖器官中的表达量则相对较低,尤其是在萼片和雄蕊中几乎检测不到,表明其可能并不参与这些器官的发育和分化(图5-B)。
外源施加乙烯或乙烯衍生物(如乙烯利)可以促进凤梨科植物开花。拟南芥中,响应乙烯信号的ERF基因是ERF1,ERF1再通过结合到下游靶标基因启动子区的顺式元件上,通过一系列级联反应启动了植物体对外源生物或非生物胁迫的应答机制[15]。蜻蜓凤梨幼株和成株各组织中AfERF109转录本的表达量对外源乙烯处理均有响应,但是响应的时间和幅度各有差异,表明在不同的组织中可能有其他的蛋白共同参与了这一调控路径。未来通过克隆该基因的启动子序列,分析其启动子区包含的顺式元件,验证其对胁迫处理的响应,将有助于我们解析其具体的应答机制。
此外,水稻中与拟南芥AfERF109同源的基因OsERF109也响应了乙烯的正调控[38]。研究发现,OsERF109可通过结合到另一个ERF基因OsERF3启动子区的DRE和GCC元件上调控后者的表达[39],而在水稻中过表达或通过RNA干扰降低OsERF109表达量后则分别降低或增加了乙烯的合成量,参与了干旱胁迫[38]。因此,通过在蜻蜓凤梨中过表达或沉默AfERF109,进一步研究它在开花中的分子机制以及与乙烯之间的调控关系,有助于我们更好地解析乙烯诱导凤梨科植物开花的分子机制,为人工调控凤梨科植物开花提供理论依据。
参考文献:
[1]Luther H E. An alphabetical list of bromeliad binomials[M]. Florida:The Bromeliad Society International,2010:4.
[2]Versieux L M,Barbara T,Wanderley M,et al. Molecular phylogenetics of the Brazilian giant bromeliads(Alcantarea,Bromeliaceae):implications for morphological evolution and biogeography[J]. Molecular Phylogenetic Evolution,2012,64(1):177-189.
[3]龔明霞,何铁光,黄如葵,等. 观赏凤梨组培快繁技术研究进展[J]. 广西农业科学,2010,41(5):412-415.
[4]李志英. 凤梨科植物组织培养技术[M]. 北京:中国农业出版社,2014:1.
[5]Turnbull C G,Sinclair E R,Anderson K L,et al. Routes of ethephon uptake in pineapple(Ananas comosus)and reasons for failure of flower induction[J]. Journal of Plant Growth Regulation,1999,18(4):145-152.
[6]Kuan C S,Yu C W,Lin M L,et al. Foliar application of aviglycine reduces natural flowering in pineapple[J]. HortScience,2005,40(1):123-126.
[7]Dukovski D,Bernatzky R,Han S. Flowering induction of Guzmania by ethylene[J]. Scientia Horticulturae,2006,110(1):104-108.
[8]Trusov Y,Botella J R. Silencing of the ACC synthase gene ACACS2 causes delayed flowering in pineapple[Ananas comosus (L.) Merr.][J]. Journal of Experimental Botany,2006,57(14):3953-3960.
[9]Müller M,Munné-Bosch S. Ethylene response factors:a key regulatory hub in hormone and stress signaling[J]. Plant Physiology,2015,169(1):32-41.
[10]Shakeel S N,Gao Z,Amir M,et al. Ethylene regulates levels of ethylene receptor/CTR1 signaling complexes in Arabidopsis thaliana[J]. The Journal of Biological Chemistry,2015,290(19):12415-12424.
[11]Kieber J J,Rothenberg M,Roman G,et al. CTR1,a negative regulator of the ethylene response pathway in Arabidopsis,encodes a member of the raf family of protein kinases[J]. Cell,1993,72(3):427-441.
[12]Alonso J M,Hirayama T,Roman G,et al. EIN2,a bifunctional transducer of ethylene and stress responses in Arabidopsis[J]. Science,1999,284(5423):2148-2152.
[13]Bleecker A B. Ethylene perception and signaling:an evolutionary perspective[J]. Trends in Plant Science,1999,4(7):269-274.
[14]Chang C,Stadler R. Ethylene hormone receptor action in Arabidopsis[J]. BioEssays:News and Reviews in Molecular,Cellular and Developmental Biology,2001,23(7):619-627.
[15]Solano R,Stepanova A,Chao Q,et al. Nuclear events in ethylene signaling:a transcriptional cascade mediated by ethylene-insensitive3 and ethylene-response-factor1[J]. Genes & Development,1998,12(23):3703-3714.
[16]Wessler S R. Homing into the origin of the AP2 DNA binding domain[J]. Trends in Plant Science,2005,10(2):54-56.
[17]Licausi F,Ohme-Takagi M,Perata P. APETALA2/Ethylene Responsive Factor(AP2/ERF)transcription factors:mediators of stress responses and developmental programs[J]. The New Phytologist,2013,199(3):639-649.
[18]Ohta M,Matsui K,Hiratsu K,et al. Repression domains of class Ⅱ ERF transcriptional repressors share an essential motif for active repression[J]. The Plant Cell,2001,13(8):1959-1968.
[19]Song C P,Agarwal M,Ohta M,et al. Role of an Arabidopsis AP2/EREBP-type transcriptional repressor in abscisic acid and drought stress responses[J]. The Plant Cell,2005,17(8):2384-2396.
[20]Zhang G Y,Chen M,Chen X P,et al. Isolation and characterization of a novel EAR-motif-containing gene GmERF4 from soybean (Glycine max L.)[J]. Molecular Biology Reports,2009,37(2):809-818.
[21]Zhang G Y,Chen M,Li L C,et al. Overexpression of the soybean GmERF3 gene,an AP2/ERF type transcription factor for increased tolerances to salt,drought,and diseases in transgenic tobacco[J]. Journal of Experimental Botany,2009,60(13):3781-3796.
[22]Zhai Y,Li J W,Li X W,et al. Isolation and characterization of a novel transcriptional repressor GmERF6 from soybean[J]. Biologia Plantarum,2012,57(1):26-32.
[23]Ohme-Takagi M,Shinshi H. Ethylene-inducible DNA binding proteins that interact with an ethylene-responsive element[J]. The Plant Cell,1995,7(2):173-182.
[24]Yi S Y,Kim J H,Joung Y H,et al. The pepper transcription factor CaPF1 confers pathogen and freezing tolerance in Arabidopsis[J]. Plant Physiology,2004,136(1):2862-2874.
[25]McGrath K C. Repressor-and activator-type ethylene response factors functioning in jasmonate signaling and disease resistance identified via a genome-wide screen of Arabidopsis transcription factor gene expression[J]. Plant Physiology,2005,139(2):949-959.
[26]Zuo K J,Qin J,Zhao J Y,et al. Over-expression GbERF2 transcription factor in tobacco enhances brown spots disease resistance by activating expression of downstream genes[J]. Gene,2007,391(1/2):80-90.
[27]Cheng M C,Liao P M,Kuo W W,et al. The Arabidopsis ethylene response factor1 regulates abiotic stress-responsive gene expression by binding to different cis-acting elements in response to different stress signals[J]. Plant Physiology,2013,162(3):1566-1582.
[28]Li Z Y,Wang J B,Zhang X Q,et al. Transcriptome sequencing determined flowering pathway genes in Aechmea fasciata treated with ethylene[J]. Journal of Plant Growth Regulation,2016,35(2):316-329.
[29]Lei M,Li Z Y,Wang J B,et al. AfAP2-1,an age-dependent gene of Aechmea fasciata,responds to exogenous ethylene treatment[J]. International Journal of Molecular Sciences,2016,17(3):303.
[30]叢汉卿,信彩云,张银东,等. ‘阿蒂擎天凤梨谷胱甘肽-S-转移酶基因的克隆与乙烯诱导表达特性的初步分析[J]. 分子植物育种,2013,11(3):365-370.
[31]Nakano T,Suzuki K,Fujimura T,et al. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiology,2006,140(2):411-432.
[32]Zhang G,Chen M,Chen X,et al. Phylogeny,gene structures,and expression patterns of the ERF gene family in soybean(Glycine max L.)[J]. Journal of Experimental Botany,2008,59(15):4095-4107.
[33]Wang X P,Liu S,Tian H N,et al. The small ethylene response factor ERF96 is involved in the regulation of the abscisic acid response in Arabidopsis[J]. Frontiers in Plant Science,2015,6:1064-1076.
[34]Tuan P A,Bai S L,Saito T,et al. Involvement of EARLY BUD-BREAK,an AP2/ERF transcription factor gene,in bud break in Japanese pear(Pyrus pyrifolia Nakai)lateral flower buds:expression,histone modifications,and possible target genes[J]. Plant and Cell Physiology,2016,57(5):1038-1047.
[35]Wisniewski M,Norelli J,Artlip T. Overexpression of a peach CBF gene in apple:a model for understanding the integration of growth,dormancy,and cold hardiness in woody plants[J]. Frontiers in Plant Science,2015,6:85.
[36]Busov V,Carneros E,Yakovlev I. EARLY BUD-BREAK1(EBB1)defines a conserved mechanism for control of bud-break in woody perennials[J]. Plant Signaling & Behavior,2016,11(2):e1073873.
[37]Liu J X,Li J Y,Wang H N,et al. Identification and expression analysis of ERF transcription factor genes in petunia during flower senescence and in response to hormone treatments[J]. Journal of Experimental Botany,2011,62(2):825-840.
[38]Yu Y W,Yang D X,Zhou S R,et al. The ethylene response factor OsERF109 negatively affects ethylene biosynthesis and drought tolerance in rice[J]. Protoplasma,2016:1-8.
[39]Zhang H W,Zhang J F,Quan R D,et al. EAR motif mutation of rice OsERF3 alters the regulation of ethylene biosynthesis and drought tolerance[J]. Planta,2013,237(6):1443-1451.

