黄星天牛中肠中内切葡聚糖酶的鉴定与酶活性测定
梅慧珍+陈安利+夏定国
摘要:内切葡聚糖酶(Cx)是纤维素酶系中的主要成分,它包含多种同工酶,能够将可溶性纤维素水解成还原性寡糖。采用 Native-PAGE技术对黄星天牛中肠中Cx进行电泳分离,结合LC-MS/MS技术对黄星天牛中肠中Cx种类进行鉴定,并对其性质进行研究。结果显示黄星天牛中肠中含有多种Cx,通过结构域分析,确定为GHF5家族蛋白,有共同的保守区(IIYETFNEPT),Cx最适反应温度为50 ℃,最适pH值为6.0,且具有较广的pH值稳定范围,低浓度的Mg2+与Co2+对该酶有激活作用,高浓度的Mg2+与Cu2+对该酶有抑制作用。这一结果可为黄星天牛降解纤维素机制的研究提供理论基础,为进一步研究天牛中肠组织的生理功能提供基础信息。
关键词:黄星天牛;中肠;内切葡聚糖酶;鉴定;结构域;保守区;降解纤维素
中图分类号: Q556+.2;S433.5 文献标志码: A
文章编号:1002-1302(2016)11-0165-04
中肠是昆虫食物消化和营养吸收的主要场所,也是许多外来有害物质如农药、毒素、病源微生物等的作用靶标[1-6]。研究昆虫中肠蛋白质的组成和功能,不仅有助于阐明昆虫中肠对营养物质消化吸收的分子机理,也能进一步认识外源物质与中肠内蛋白质之间的相互作用。
天牛作为植食性昆虫,植物中的多糖如纤维素、半纤维素的降解是本身的能量来源之一。自1930年Ripper首次报道天牛自身能分泌纤维素酶后[7],又有一些学者提出天牛自身具有分泌纤维素酶的生化结构基础[8]。用加入抗菌素的饲料人工饲养天牛,天牛肠道消化液中仍有很高的纤维素酶活性[9]。用等电聚焦电泳分离天牛消化道内切葡聚糖酶(Cx),发现不同发育阶段和不同虫态间的Cx同工酶差异很大,这标志着天牛体内共生微生物分泌Cx和天牛摄入真菌Cx的可能性很小[10]。Cx是纤维素降解过程中的一种重要水解酶。它作用于纤维素分子内部的非结晶区,随机水解β-1,4-糖苷键,将长链纤维素分子截短,产生大量带非还原性末端的小分子纤维素。自Chararas等首次报道从欧洲绞天牛(Ergates faber)中分离纯化出内源性纤维素酶以后[11],其他昆虫的内源性纤维素酶也相继得到报道[12-20]。
非变性聚丙烯酰胺凝胶电泳(Native-PAGE)是在不加入十二烷基硫酸钠(SDS)疏基乙醇等变性剂的条件下,对保持活性的蛋白质进行聚丙烯酰胺凝胶电泳,常用于同工酶的鉴定和提纯。未加SDS的天然聚丙烯酰胺凝膠电泳可以使生物大分子在电泳过程中保持其天然的形状和电荷,它们的分离依据其电泳迁移率的不同和凝胶的分子筛作用,因而可以得到较高的分辨率,尤其是在电泳分离后仍能保持酶等蛋白质生物大分子的生物活性,对于生物大分子的鉴定有重要意义。
本研究基于Native-PAGE技术对黄星天牛中肠中Cx进行电泳分离并采用LC-MS/MS技术对黄星天牛中肠中的Cx进行筛选,同时对黄星天牛中肠中Cx的活性进行初步研究,可为探索黄星天牛消化纤维素的机制提供理论基础,为进一步认识与研究天牛中肠组织的功能提供基础信息。
1 材料与方法
1.1 试验材料
黄星天牛成虫收集于中国农业科学院蚕业研究所桑园。
1.2 试验方法
1.2.1 中肠总蛋白的提取
将采集的黄星天牛成虫置于 -80 ℃ 冰箱中保存过夜,翌日解剖,取出中肠,用ddH2O反复冲洗,至无明显的内含物,用吸水纸吸干。利用一步法动物组织活性蛋白提取试剂盒[生工生物工程(上海)股份有限公司]提取总蛋白:将组织剪切成小块,用液氮研磨至粉末状,加入预冷的抽提试剂(每1 mL抽提试剂加入1 μL DTT、10 μL PMSF、1 μL 蛋白酶抑制剂),涡旋振荡10 s,冰上放置20 min,期间取出振荡3~5次,再 4 ℃、12 000 r/min 离心 10 min,上清液作为组织总活性蛋白部分,于-80 ℃冰箱中保存备用(具体试验方法参照试剂盒说明书)。
1.2.2 Cx分析
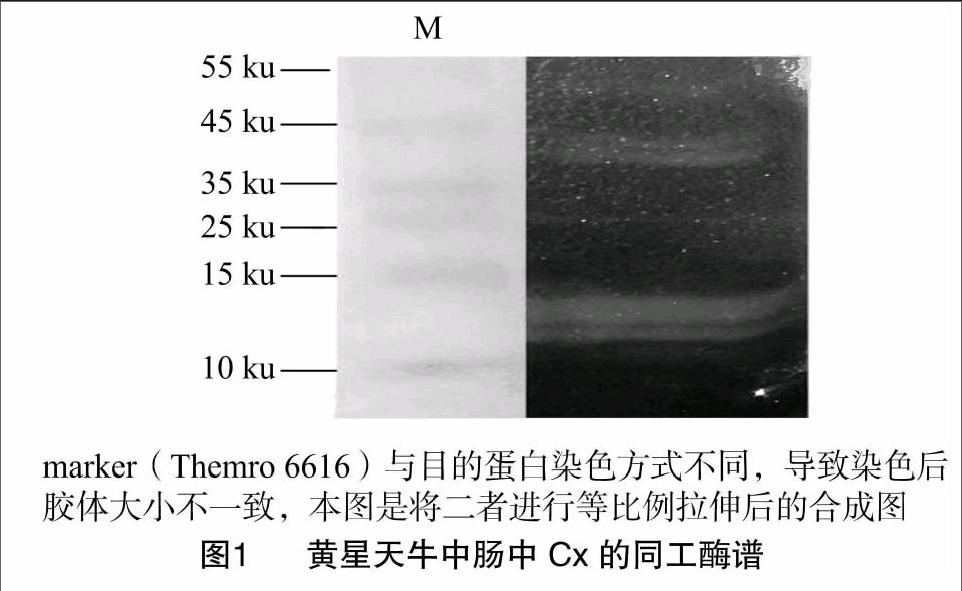
参考李庆的方法[10],制备含有1% CMC、12%凝胶的非变性胶,进行电泳,电泳在低于 8 ℃ 条件下进行。电泳完毕后,将胶剥离,将marker的区域与蛋白样品的区域切割分离,含有marker的胶进行考染,含有蛋白样品的胶移至pH值为6.0的0.2 mol/L NaH2PO4-NaHPO4缓冲液中,37 ℃水浴保温10 min,倒去缓冲液,加入2.0% KI+0.2% I2染色液于25 ℃水浴染色5 min,倒去染色液,用自来水冲洗多余染液,加入60% 硫酸处理5~10 min,终止酶活,倒去硫酸,用水冲洗,直至背景胶板上出现透明带(Cx带)。
1.2.3 Cx带的胶回收及质谱分析
将Cx带的部分切下,用ddH2O将胶中蛋白质条带脱色到胶体接近无色,室温、12 000 r/min 条件下离心5 min,去除上清保留胶体,然后用生工生物工程(上海)股份有限公司的PAGE胶蛋白微量回收试剂盒回收胶中的蛋白,所得蛋白溶液委托深圳华大基因科技服务有限公司进行LC-MS/MS分析。
1.2.4 Cx的酶活性测定
采用DNS定糖法测定Cx的活性[21]。取10 μL适当稀释的粗酶液,加入200 μL 1% 羧甲基纤维素钠(用0.05 mol/L柠檬酸缓冲液配制,pH值4.8),50 ℃ 反应1 h,加入500 μL DNS试剂,煮沸 6 min,再加入 500 μL 蒸馏水,在540 nm波长下测定吸光度。定义1 min产生1 g葡萄糖所需酶量为1个酶活性单位。
1.2.5 中肠Cx活性的研究
1.2.5.1 最适pH值的测定 分别用pH值为2.0、4.0、6.0、8.0、10.0的缓冲液配制1%羧甲基纤维素钠溶液[醋酸缓冲液(pH值2.0),柠檬酸缓冲液(pH值4.0、6.0),Tris-HCl缓冲液(pH值8.0),甘氨酸-氢氧化钠 (pH值10.0)][18],作为不同pH值条件下的酶作用底物,加入稀释后的粗酶液,于50 ℃保温1 h,测定酶活性,以酶活性最高者为100%,确定最适pH值。
1.2.5.2 最适温度的测定 用pH值 6.0的柠檬酸缓冲液配制1%羧甲基纤维素钠溶液,作为底物,加入稀释后的粗酶液,于不同温度(30~70 ℃)水浴保温1 h,测定酶活性,以最大酶活性为100%,确定最适反应温度。
1.2.4.3 金属离子对酶活性的影响 分别配制含有浓度为5、100 mmol/L 的CoCl2、MgCl2、CuCl2、CaCl2 的1%羧甲基纤维素钠溶液,在最适温度与pH值下保温1 h,测定酶活性。以不加任何无机盐的1%羧甲基纤维素钠溶液作为底物所测出来的值为100%。
2 结果与分析
2.1 Cx检测结果
Native-PAGE电泳共发现5条透明度大小不同的Cx带(图1),酶带透明度越大,说明酶活性越大(酶活性由Cx与羧甲基纤维素钠反应的强度有关)[10]。结果表明,黄星天牛中肠中可能存在多种Cx。Cx的分子大小范围分布很广,一般分子量介于23~146 ku之间,当然也有例外,如纤维黏菌内切酶分子量小至6.3 ku[22]。电泳结果显示,黄星天牛Cx带的分子量主要分布在35~55 ku与10~15 ku这2个范围内。
2.2 LC-MS/MS结果分析
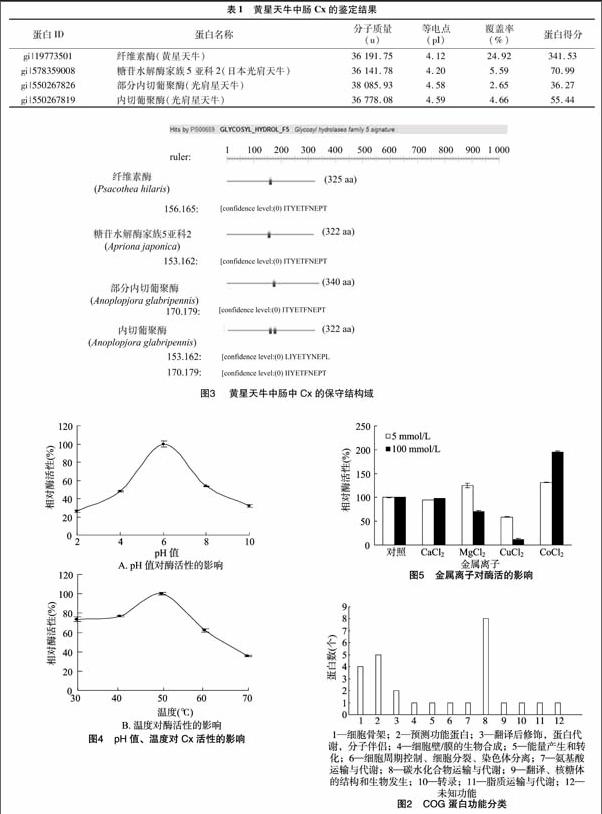
本研究委托深圳华大基因科技服务有限公司,利用Triple TOF 5600质谱仪对Native-PAGE电泳所获得的蛋白样品进行LC-MS/MS(液相-质谱联用鉴定蛋白质混合物的技术)分析。通过与NCBI天牛科(Cerambycidae)蛋白质数据库进行比对分析(http://www.ncbi.nlm.nih.gov/protein/?term=txid41088),共得到265个蛋白分子(包括重复蛋白质)。其中,与Native-PAGE电泳胶面Cx分子量分布一致的有66个非重复蛋白,分子量分布在35~55 ku之间的蛋白有54个,分子量分布在10~15 ku之间的蛋白有12个,对所得的蛋白进行COG分类发现,66个蛋白中有27个蛋白具有COG的功能性分类(图2),其中11个蛋白与代谢有关,如氨基酸(amino acid transport and metabolism)、能源代谢(energy production and conversion)、碳水化合物(Carbohydrate transport and metabolism)、脂质(lipid transport and metabolism)的运输和新陈代谢。
2.3 黄星天牛中肠中Cx种类的鉴定与分析
通过LC-MS/MS 技术对黄星天牛中肠中Cx的鉴定,结果显示,黄星天牛有4种非重复的Cx(表1),其蛋白理论分子量分布在36~38 ku之间,等电点在4.3左右。
利用Prosite生物在线软件(http://prosite.expasy.org/prosite.html)对Cx的结构域进行分析,结果显示,这4种Cx均属于GHF 5家族(图3),存在共同的保守区(IIYETFNEPT)。
2.4 Cx的最适pH值与温度
从图4-A可以看出,Cx在pH值4~8时,该酶活性在最大酶活性的50%以上,可见Cx具有较广的pH值稳定性,在pH值为6.0时的酶活性最高。这可能是由于pH值改变了酶分子的带电状态,特别是改变了酶活性中心上有关基团的电离状态,导致该酶与底物不能很好地结合,从而影响底物被酶水解,最终使酶催化活性有不同程度的下降。图4-B表明,温度在30~50 ℃之間时,Cx的酶活性随着温度的升高而升高,在50 ℃时达到最大,随着温度继续上升,酶活性逐渐下降。
2.5 金属离子对Cx的影响
用5、100 mmol/L Co2+及5 mmol/L Mg2+对Cx进行处理,酶活性最高分别能够提高31.37%、95.17%、25.24%;Ca2+对酶活性基本无影响;而5、100 mmol/L Cu2+及100 mmol/L Mg2+对酶有抑制作用(图5)。
3 结论与讨论
以木质纤维素为食的昆虫(如白蚁、甲虫、蠹虫、木食性蟑螂以及木蜂等)能非常有效地将食物中的纤维素、半纤维素物质转化为糖类,并从中获取自身生长发育所需的能量[23],Cx是纤维素降解途径中的一种重要的酶系。2014年,Pauchet等在日本光肩天牛的中肠中证实了6个分子量皆在35~50 ku的GHF5蛋白中,且他们发现雄性成虫中只有4种属于GHF5的蛋白中,而雌性成虫中没有GHF5家族的蛋白[17]。本试验在黄星天牛中肠中鉴定出4种Cx,均属于GHF5,这一结果与Pauchet等的结果[17]一致。GHF45作为Cx家族的另一成员,已在很多种类的天牛中发现,如云斑天牛、桑天牛[16-20]。本试验在黄星天牛中未鉴定出GHF5家族,这可能与蛋白表达丰度有关[20]。此外,本研究发现2条分子量低于15 ku的内切酶条带,迄今为止还未见报道。
对黄星天牛中肠中Cx活性研究表明,无论是最适作用温度还是最适作用pH值,Cx均显示出广泛的适应性。Cx作为纤维素的主要消化酶,广泛的pH值适应范围使其能适应食物的不同pH值条件及肠道各部分的内环境,直接作用于天牛摄入的纤维类物质,并随食物在肠道内向后移动时持续发挥作用[24]。金属离子对Cx的活性有一定的影响,Co2+及低浓度的Mg2+对Cx都有较强的激活作用,Cu2+及高浓度的Mg2+对酶都有抑制作用。高浓度的Cu2+相比低浓度的Mg2+而言,其抑制作用更强。Cu2+是一些杀虫剂的重要成分,施用Cu2+试剂如波尔多液等,既可防疾病,又可抑制天牛的消化酶,从而起到控制天牛为害的作用。
本试验通过对黄星天牛中肠内切酶的研究,不仅可以为黄星天牛降解纤维素机制的研究提供理论基础,也为以后天牛中肠蛋白质研究提供了重要的数据资料。
参考文献:
[1]Wang J,McCommas S,Syvanen M. Molecular cloning of a glutcanlione S-transferase overproduced in an insecticide-resistant strain of the housefly(Musca domestica)[J]. Molecular and General Genetics MGG,1991,227(2):260-266.
[2]Fournier D,Bride J M,Poirie M,et al. Insect glutathione S-transferases. Biochemical characteristics of the major forms of houseflies susceptible and resistant to insecticides[J]. Journal of Biological Chemistry,1992,267(3):1840-1845.
[3]Ranson H,Rossiter L,Ortelli F,et al. Identification of a novel class of insect glutathione S-transferases involved in resistance to DDT in the malaria vector Anopheles gambine[J]. Biochemical Journal,2001,359(2):295-304.
[4]Vontas J G,Small G J,Hemingway J. Glutathione S-transferases as antioxidant defence agents confer pyrethroid resistance in Nilaparvata lugens[J]. Biochemical Journal,2001,357(1):65.
[5]Scott J G. Cytochromes P450 and insecticide resistance[J]. Insect Biochemistry and Molecular Biology,1999,29(9):757-777.
[6]Feyereisen R. Insect cytochrome P450[J]. Comprehensive Molecular Insect Science,2005,4:1-77.
[7]Ripper W. Zur frage des celluloseabhaus bei der holzverdanung xylophager insektenlarven [J]. Zeitschriftfür Vergleichende Physiologie,1930,13(2):313-333.
[8]Terra W R,Ferreira C. Insect digestive enzymes:properties,compartmentalization and function[J]. Comparative Biochemistry and Physiology,1994,109(1):1-62.
[9]Scrivener A M,Slaytor M,Rose H A. Symbiont-independent digestion of cellulose and starch in Panesthia cribrata Saussure,an Australian wood-esting cockroach[J]. Journal of insect Physiology,1989,35(12):935-941.
[10]李 慶. 天牛消化纤维素的机制研究[J]. 林业科学,1991,27(4):418-423.
[11]Chararas C,Eberhard K,Courtois J E,et al. Purification of three cellulases from the xylophageous larvae of ergates faber (Coleoptera:Cerambycidae)[J]. Insect Biochemistry,1983,13(2):213-218.
[12]Scivener A M,Slaytor M. Properties of the endogenous cellulase from Panesthia cribrate Saussure and purification of major endo-β-1,4-glucanase components [J]. Insect Biochemistry and Molecular Biology,1994,24(3):223-231.
[13]Tokuda G,Watanabe H,Matsumoto T,et al. Cellulose digestion in the wood-eating higher termite,Nasutitermes takasagoensis (Shiraki):distribution of cellulases and properties of endo-β-1,4-glucanase[J]. Zoological Science,1997,14(1):83-93.
[14]Watanabe H,Nakamura M,Tokuda G,et al. Site of secretion and properties of endogenous endo-β-1,4-glucanase components from Reticulitermes speratus (Kolbe),a Japanese subterranean termite[J]. Insect Biochemistry and Molecular Biology,1997,27(4):305-313.[HJ1.65mm]
[15]Lee S J,Kim S R,Yoon H J,et al. cDNA cloning,expression,and enzymatic activity of a cellulase from the mulberry longicorn beetle,Apriona germari[J]. Comparative Biochemistry and Physiology:Biochemistry and Molecular Biolagy,2004,139(1):107-116.
[16]Lee S J,Lee K S,Kim S R,et al. A novel cellulase gene from the mulberry longicorn beetle,Apriona germari:gene structure,expression,and enzymatic activity[J]. Comparative Biochemistry and Physiology:Biochemistry and Molecular Biolagy,2005,140(4):551-560.
[17]Pauchet Y,Kirsch R,Giraud S,et al. Identification and characterization of plant cell wall degrading enzymes from three glycoside hydrolase families in the cerambycid beetle Apriona japonica[J]. Insect Biochemistry and Molecular Biology,2014,49(1):1-13.
[18]Wei Y D,Lee K S,Gui Z Z,et al. Molecular cloning,expression,and enzymatic activity of a novel endogenous cellulase from the mulberry longicorn beetle,Apriona germari[J]. Comparative Biochemistry and Physiology:Biochemistry and Molecular Biolagy,2006,145(2):220-229.
[19]Xia D G,Wei Y D,Zhang G Z,et al. cDNA cloning,expression,and enzymatic activity of a novel endogenous cellulase from the beetle Batocera horsfieldi[J]. Gene,2013,514(1):62-68.
[20]Sugimura M,Watanabe H,Lo N,et al. Purification,characterization,cDNA cloning and nucleotide sequencing of a cellulase from the yellow-spotted longicorn beetle,Psacothea hilaris[J]. European journal of biochemistry,2003,270(16):3455-3460.
[21]Miller G L. Use of the dinitrosalicylic acid reagent for the determination of reducing sugars [J]. Analytical Chemistry,1959,31(3):426-428.
[22]路 梅. 嗜熱毛壳菌纤维素酶液体发酵条件和内切β-葡聚糖酶的分离纯化[D]. 济南:山东大学,2002:1-53.
[23]黄胜威. 暗黑鳃金鱼幼虫肠道微生物分子多态性及纤维素降解菌多样性研究[D]. 武汉:华中农业大学,2012.
[24]殷幼平. 天牛消化纤维素的机制及天牛纤维素酶的研究[D]. 重庆:西南农业大学,1996.

