辣椒种子萌发和幼苗生理特性对盐胁迫的响应
郑佳秋+郭军+梅燚

摘要:在土培条件下采用模拟盐胁迫方法,研究6个辣椒(Capsicum annum L.)品种在盐胁迫下萌芽期和幼苗期的生理特性。结果表明,盐胁迫使所有供试辣椒品种萌芽期的发芽率、发芽势、发芽指数、苗长、胚根长、苗质量和胚根质量均不同程度降低;幼苗期的超氧化物歧化酶(SOD)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)活性和可溶性糖含量总体表现为增加,过氧化氢酶(CAT)活性总体呈下降趋势,可溶性蛋白含量不同品种表现不同。方差分析发现相对发芽率、相对发芽势等14个相对性状指标均达到显著水平,基于品种因子得分值进行系统聚类分析将供试辣椒品种(系)分为3类,Y08-27和S-322尖椒为耐盐性较强的品种(系),Y148-1、Y802-1为耐盐性中等品系,Y802-2、Y08-29属于盐敏感品系。
关键词:辣椒;盐胁迫;种子萌发;生理特性
中图分类号: S641.301 文献标志码: A
文章编号:1002-1302(2016)11-0182-04
目前,世界盐渍土地面积约10亿hm2,中国盐渍土地面积约3 460万hm2,盐碱化耕地760万hm2[1]。苏北平原拥有滩涂面积约65.3万hm2,目前仍在不断淤积增长,江苏省年淤涨面积达1 334 hm2[2],给农业生产和人类的生存环境带来严重影响。盐胁迫已经成为影响植物生长和作物减产的主要限制因素,因此,提高作物的耐盐性已经成为当前作物育种的一个主攻方向。已有研究表明,不同植物及作物种类耐盐性各异,即便同一种作物不同品种间也存在耐盐性差异[3]。挖掘作物种质本身的耐盐能力,筛选培育耐盐品种,利用盐渍化土壤进行农业生产显得尤为重要[4-5]。
辣椒(Capsicum annum L.)是一种世界性的蔬菜,是中国主要的大宗蔬菜作物之一,也是产值最大的蔬菜作物[6]。目前,长江流域春季蔬菜种植大面积发展,成为沿海农业区订单式高效农业的典范,但由于工业污染的加剧,化肥的大量施用及设施农业的迅猛发展,盐渍土壤面积不断扩大,使得辣椒栽培中经常出现根系不发达、植株矮小、病害加重等现象,早期产量和总产量降低,严重影响经济效益。因此,挖掘辣椒物质本身的耐盐能力,筛选培育耐盐品种,对充分利用沿海盐渍土壤发展辣椒产业具有重要意义。为克服土壤盐渍化,人们对辣椒在盐碱胁迫下的生理响应已开始研究[7],但关于萌芽期和幼苗期2个时期耐盐性综合评价还鲜见报道。种子萌发期和幼苗期是大多数作物全生育期中对盐胁迫最为敏感的时期,本试验研究不同的辣椒品种和定向选育的品系在NaCl胁迫下种子萌发期和幼苗期的生长和生理指标变化,探讨辣椒耐盐生理机制,为筛选耐盐种质资源,培育耐盐品种打下基础。
1 材料与方法
1.1 供试材料
本试验选用的6个辣椒(Capsicum annum L.)品种(系)为Y148-1、Y802-1、Y802-2、Y08-29、Y08-27和S-322尖椒,由江苏沿海地区农业科学研究所蔬菜室提供。
1.2 试验方法
1.2.1 萌芽期盐胁迫处理
将辣椒种子用5% NaClO消毒 5 min,蒸馏水冲洗5次,分别置于铺有2层滤纸的培养皿中,每个培养皿50粒,然后加入蒸馏水(对照)和150 mmol/L NaCl溶液各7 mL,于28 ℃培养箱中发芽,重复3次。每天记录发芽数(以胚根长达1/2种子长作为萌芽标志)补充等量蒸馏水和NaCl溶液,计算培养7 d的发芽势和14 d的发芽率,测定苗长、胚根长、苗鲜质量、胚根鲜质量。
1.2.2 幼苗期盐胁迫处理
供試的辣椒种子经催芽后于穴盘中育苗,育苗基质为体积比1 ∶1的过筛菜园土和黑土混合物。试验在两面通风能防雨的塑料大棚(昼温20~25 ℃、夜温10~15 ℃)中进行。四叶一心时,将长势一致的幼苗移至含盐量0.5 g/kg的营养钵(0.1m×0.1m)中进行盐胁迫处理。以正常灌施1/2 Hoagland营养液为对照;胁迫处理在营养液中加分析纯NaCl使其浓度达150 mol/L,每5 d灌施1次,每次灌施量为基质持水量的2倍,处理15 d采取生长点下第3张展开真叶进行渗透调节物质含量及抗氧化酶活性测定,重复3次。
1.3 测定指标及方法
1.3.1 生长指标
发芽指数Gi=∑(Gt/Dt),式中:Gt为t日的发芽数,Dt为相应的发芽日数;相对盐害率=[(对照发芽率-处理发芽率)/对照发芽率]×100%;将辣椒幼苗从培养皿中取出,用去离子水冲洗,再用吸水纸吸干后称鲜质量。
1.3.2 抗氧化酶活性
POD活性参考Kochba等的方法[8]测定吸光度D470 nm;CAT活性采用叶凡等的方法[9]测定;SOD活性测定采用氮蓝四唑(NBT)光还原法[10];抗坏血酸过氧化物酶(APX)活性测定参照Nakano等的方法[11]。
1.3.3 可溶性蛋白和可溶性糖含量
可溶性蛋白含量采用考马斯亮蓝G-250染色法[12]测定;可溶性糖含量用蒽酮法[10]测定。
1.4 数据分析
由公式RV=(Xs/Xc)×100%计算各生理指标的相对值,其中Xs为盐胁迫下测定指标平均值,Xc是所测指标在对照下的平均值。
采用Excel进行数据整理,用DPS 7.05软件进行单因素方差分析和显著性测验分析(Duncans多重比较法),采用SPSS 19.0进行因子分析和系统聚类分析。
2 结果与分析
2.1 盐胁迫对辣椒种子萌芽期生长指标的影响
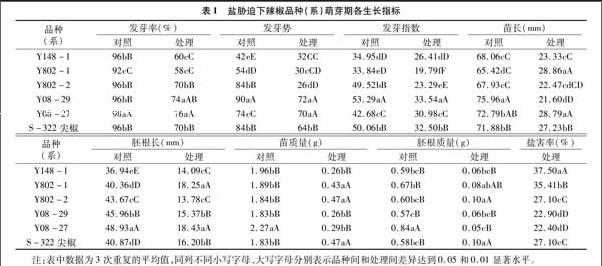
由表1可见,6个供试辣椒品种在盐胁迫下的苗长、胚根长、苗质量和胚根质量、发芽率、发芽势、发芽指数均较对照下降,品种间降幅存在差异。盐胁迫下Y802-1的发芽率最低,是对照的63.04%,而Y08-29和Y08-27的发芽率最高,是对照的77.08%、77.55%,盐害率均小于23.00%;Y802-2的发芽势和发芽指数均最低,分别为对照的30.95%和47.03%,而Y148-1的发芽指数占对照值最高,为对照的75.56%,盐害率达到37.50%;Y802-2和Y08-29的苗长和胚根长明显低于对照,仅为对照的34.00%以下,Y08-27的苗质量和胚根质量仅为对照的13.00%以下,而Y802-1的苗长和胚根长均为对照的44.00%以上,S-322尖椒的苗质量和胚根质量均达到对照的17.00%以上。可见,很难用单一性状指标评价辣椒不同品种的耐盐性,需要将这些性状指标综合分析。
2.2 盐胁迫对辣椒幼苗SOD、POD、CAT和APX活性的影响
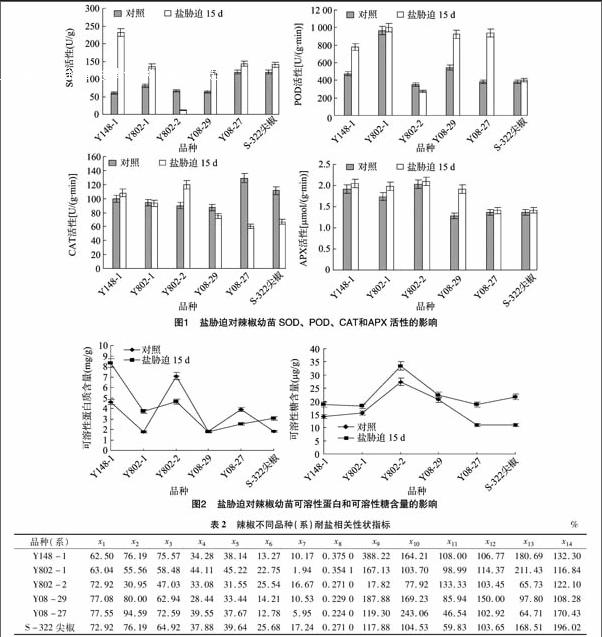
SOD、POD、CAT和APX是植物体内酶促防御系统中主要的保护酶[13],与非酶促系统协同作用,可清除植物体内的超氧阴离子自由基,减轻自由基对植物细胞膜的伤害。如图1所示,盐胁迫下供试品种除Y802-2表现为SOD、POD活性下降,分别为对照的17.82%和77.92%外,其他品种的SOD、POD和APX活性均表现为上升。除Y148-1和Y802-2的CAT活性表现为增加外,分别为对照的108.00%和133.33%,其他品种CAT活性总体呈下降趋势,其中 Y08-27 下降幅度最大,为对照的46.54%。
2.3 盐胁迫对辣椒幼苗可溶性糖和可溶性蛋白含量的影响
可溶性糖和可溶性蛋白在植物逆境时可通过主动积累来降低渗透势,是植物细胞中的重要渗透调节物质。由图2可知,盐胁迫后,所有供试品种(系)可溶性糖含量均表现为增加,其中Y08-27、S-322尖椒增加幅度最大,分别为对照的170.43%和196.02%。可溶性蛋白含量表现不一,因品种(系)而异,Y148-1、Y802-1和S-322尖椒表现为增加,Y802-1增加幅度最大,为对照的211.43%,而Y802-2、Y08-29和Y08-27表现为下降趋势,其中Y08-27下降幅度最大,为对照的64.71%。
2.4 因子分析
为消除不同品种间固有的生物学特性差异,分析中采用相对值来衡量辣椒品种的耐盐性(表2)。方差分析结果表明,14个相对性状指标均达到显著水平,作为耐盐评价的指标进行因子分析。计算14个相对性状间相关系数矩阵与相应的特征向量矩阵,将特征值按大小次序排列,可知前4个特征值累计贡献率已达93.78%,进一步对因子载荷矩阵进行旋转达到使结构简化的目的,但在方差极大旋转过程中,由于各品种的内在因素之间始终存在着错综复杂的联系,需要引入斜交因子解,使主因子生物学意义更加明显,从表3可知,第1主因子是相对发芽率、相对发芽势、相对发芽指数载荷值较大,故称为萌芽因子;第2主因子是相对苗量、相对胚根质量载荷值较大,故称为生物量因子;第3主因子是相对POD活性、相对CAT活性载荷值较大,称为酶促防御因子;第4主因子是相对可溶性蛋白含量和相对可溶性糖含量载荷值较大,称为渗透调节因子。
2.5 供试辣椒品种(系)耐盐性比較
根据Promax斜交旋转后品种斜交因子得分值,计算品种间的平方Euclidean距离,用离差平方和法(ward氏法)可将6个参试材料分为3类。从图3可知,第1类有Y08-27和S-322尖椒,总体特征是盐胁迫下相对发芽率下降22.45%~27.08%,相对发芽势下降27.41%~35.08%,相对发芽指数下降27.41%~35.08%,苗质量下降74.32%~87.22%,胚根质量下降82.76%~94.05%,盐害率为22.40%~27.10%,可溶性糖含量增加70.43%~96.02%,除CAT活性下降外,其余抗氧化酶活性整体增加,各生长和生理指标受盐胁迫的影响程度在3个类群中最小,属于耐盐性较强的一类。
第2类有Y802-2和Y08-29,总体特征是盐胁迫下相对发芽率下降22.92%,相对发芽势下降20.00%~69.05%,相对发芽指数下降37.06%~52.97%,苗质量下降 74.46%~85.79%,胚根质量下降83.33%~89.47%,盐害率22.90%~27.10%,可溶性糖含量增加8.28%~22.10%,相对APX活性增加3.45%~50.00%,其余抗氧化酶活性和可溶性蛋白含量均有降低的表现,降低幅度各异。各生长和生理指标受盐胁迫的影响程度在3个类群中最大,属于盐敏感性品种(系)。
第3类有Y148-1和Y802-1,总体特征是盐胁迫下相对发芽率下降36.96%~37.50%,相对发芽势下降 23.81%~44.44%,相对发芽指数下降24.43%~41.52%,苗质量下降77.25%~86.73%,胚根质量下降89.83%~98.06%,盐害率35.41%~37.50%,抗氧化酶活性和可溶性糖、可溶性蛋白含量整体表现为增加,各生长和生理指标受盐胁迫的影响程度介于第1类群和第2类群之间,属于耐盐性中等品种(系)。
3 讨论
种子萌发期是作物生育期中对盐胁迫最为敏感的时期之一,许多研究都表明种子萌发期耐盐性可以反映出该品种其他时期的耐盐性[14]。本研究采用土培模拟盐胁迫的方法对辣椒萌芽期和幼苗期进行盐胁迫试验,结果表明,在盐胁迫下所有供试辣椒品种(系)萌芽期的发芽率、发芽势等6个性状指标均比对照下降,下降幅度品种间存在差异,说明辣椒品种(系)间对盐胁迫的耐受水平和生长降低幅度不同。
抗氧化防御系统是在自由基伤害学说的基础上建立的。到目前为止,已确定它由一些能清除活性氧的酶系统和抗氧化物质组成,如SOD、POD、CAT、APX[15]等,并且它们协同作用共同抵抗盐胁迫诱导的氧化伤害,单一的抗氧化酶不足以防御这种氧化胁迫。在保护酶系统中SOD处于核心地位[16],催化细胞中多余的 O-2[KG-*2]·。转化成H2O2和O2[17-18]。POD是细胞膜中清除H2O2的酶,CAT是过氧化物体中清除H2O2的酶。APX是另一酶保护系统即抗坏血酸-谷胱甘肽循环的关键酶[19]。本试验研究表明,盐胁迫下耐盐性较强的品种(系)SOD、POD和APX能维持较高的活性,能有效地清除活性氧使之保持较低水平,从而减少盐胁迫对膜结构和功能的伤害。
可溶性糖和可溶性蛋白这些小分子物质在正常情况下含量很低,只有在盐胁迫等逆境条件下合成反应才会被激活,在植物体内逐渐积累,以调节细胞内的渗透势、维持水分平衡,还可以保护细胞内许多重要代谢活动所需的酶类活性,与植物的抗逆性关系密切,因植物的种类、器官和组织的不同所占的比例不同。盐胁迫下植物体内可溶性糖积累[20],许多植物都表现为可溶性糖含量的增加[21-22],本试验研究结果表明盐胁迫下所有供试辣椒品种(系)可溶性糖含量增加,这与前人研究结果相一致,可溶性蛋白含量变化存在品种差异,总体表现为耐盐性较强的品种(系)可溶性蛋白含量呈增加趋势。
植物的耐盐机理,是植株水平到细胞水平、分子水平,是涉及多策略、多层次、多环节、多基因的复杂机制[23],本试验从辣椒种子萌芽期和幼苗期的生长和生理指标的变化综合评价耐盐性,以品种因子得分值为综合变量进行系统聚类分析将供试辣椒品种(系)分为3类,Y08-27和S-322尖椒为耐盐性较强的品种(系),Y148-1、Y802-1为耐盐性中等品系,Y802-2、Y08-29属于盐敏感品系。
参考文献:
[1]周和平,张立新,禹 锋,等. 我国盐碱地改良技术综述及展望[J]. 现代农业科技,2007(11):159-161,164.
[2]洪立洲,隆小华,刘 玲,等. 苏北沿海滩涂盐土上油葵盐肥效应研究[J]. 土壤,2009,41(5):801-805.
[3]李卫欣,陈贵林,赵 利,等. NaCl胁迫下不同南瓜幼苗耐盐性研究[J]. 植物遗传资源学报,2006,7(2):192-196.
[4]方先文,汤陵华,王艳平. 耐盐水稻种质资源的筛选[J]. 植物遗传资源学报,2004,5(3):295-298.
[5]杜中军,翟 衡,罗新书,等. 苹果砧木耐盐性鉴定及其指标判定[J]. 果树学报,2002,19(1):4-7.
[6]邹学校. 辣椒遗传育种[M]. 北京:科学出版社,2009:33-38.
[7]徐珊珊. 辣椒对盐碱胁迫的生理反应及适应性机理研究[D]. 长春:吉林农业大学,2007.
[8]Dhindas R S,Plumb-dhindas P,Thorpe T A. Leaf senescence:correlated with increased levels of membrane permeability and lipid peroxidation and decreased levels of superoxide dismutase and catalase[J]. Journal of Experimental Botany,1981,32:93-101.
[9]叶 凡,侯喜林,袁建玉. 高温胁迫对不结球白菜幼苗抗氧化酶活性和膜质过氧化作用的影响[J]. 江苏农业学报,2007,23(2):154-156.
[10]李合生,孙 群,赵世杰,等. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:130-137.
[11]Nakano Y,Asada K. Hydrogen-peroxide is scavenged by ascorbate-specific peroxidase in spinach-chloroplasts [J]. Plant and Cell Physiology,1981,22(5):867-880.
[12]趙世杰,李德全. 现代植物生理学实验指南[M]. 北京:科学出版社,1999:305-306.
[13]田 婧,郭世荣,刘香娥,等. 外源亚精胺对高温下黄瓜幼苗叶片抗氧化系统的影响[J]. 西北植物学报,2009,29(11):2261-2267.
[14]王广印,周秀梅,张建伟,等. 不同黄瓜品种种子萌芽期的耐盐性研究[J]. 植物遗传资源学报,2004,5(3):299-303.
[15]Pitman M G. Transport across the root and shoot/root interactions[M]//Staoles R C,Toenniessen G H. Salinity tolerance in plant strategies for crop improvement. New York:John Wiley & Sons,1984:93-123.
[16]Badawi G H,Yamauchi Y,Shimada E,et al.Enhanced tolerance to salt stress and water deficit by overex pressing superoxide dismutase in tobacco(Nicotiana tabacum)chloroplasts[J]. Plant Sci,2004,166(4):919-928.
[17]Vaidy anathan H,Sivakumar P,Chakrabarty R,et al.Scavenging of reactive oxygen species in NaCl-stressed rice(Oryza sativa L.):diferential response in salt-tolerant and sensitive varieties[J]. Plant Sci,2003,165(6):1411-1418.
[18]Meloni D A,Oliva M A,Martinez C A,et al. Photosynthesis and activity of superoxide dismutase,peroxidase and glutathione reductase in cotton under salt stress[J]. Environmental and Experimental Botany,2003,49(1):69-76.
[19]Lee D H,Kim Y S,Lee C B.The inductive responses of the antioxidant enzymes by salt stress in the rice(Oryza sativa L.)[J]. J Plant Physiol,2001,158:737-745.
[20]Parida A K,Das A B. Effects of NaCl stress on nitrogen and phosphorous metabolism in a true mangrove Bruguiera parviflora grown under hydroponic culture[J]. Journal of Plant Physiology,2004,161(8):921-928.
[21]Kerepesi I,Galiba G. Osmotic and salt stress-induced alteration in soluble carbolhydrate content in wheat seedlings[J]. Crop Science,2000,40(2):482-487.
[22]Khatkar D,Kuhad M S. Short-term salinity induced changes in two wheat cultivars at different growth stages[J]. Biol.Plant,2000,43(4):629-632.
[23]廖 岩,彭友贵,陈桂珠. 植物耐盐性机理研究进展[J]. 生态学报,2007,27(5):2077-2089.

