桉树染色体压片技术优化研究
韩超+徐建民+黄芳芳

摘要:为了探索和优化桉树染色体压片技术,获得收缩度好、分散充分的桉树染色体显微镜观察图,对比不同取材时间、不同预处理剂和不同解离方法处理下的染色体压片效果,得出最优的处理方法为:上午09:00进行取材,以8-羟基喹啉进行预处理4 h,用卡诺氏固定液于4 ℃固定24 h,酶解35 min,卡宝品红染色10 min,最后在显微镜下观察,可以得到清晰、可计数的染色体。该技术可用于桉树染色体核型分析和倍性鉴定等细胞生物学层面的研究。
关键词:桉树;染色体;压片;优化
中图分类号: Q94-336 文献标志码: A
文章编号:1002-1302(2016)11-0233-03
染色体的数目、形态是物种显著的遗传性特征,可用于鉴别或辅助性鉴别物种、物种间的亲缘关系和物种的变异程度[1]。掌握染色体压片和技术,进行染色体的数量和形态观察是一项基本的和基础性的细胞生物学研究技术和手段,这种技术在物种鉴定和鉴别、物种间亲缘关系确定、物种倍性鉴定和杂交育种等研究中有广泛的应用。
桉树是桃金娘科(Mytraceae)杯果木属(Angophora)、伞房属(Corymbia)和桉属(Eucalyptus)树种的统称[2]。桉树是一种外来树种,现在对其研究主要集中在杂交育种、优良无性系选育、分子育种及生态效应等相关方面[3-6],对其细胞层面的研究较少。国外曾有人做过不同种桉树染色体的观察研究[7],但国内只有零星的研究,从研究报道看,还是没有掌握成熟、稳定和高质量的染色体压片技术。如果能够开发出该物种成熟、稳定的染色体压片技术,则可为开展桉树种间鉴别、倍性鉴定(笔者正在从事桉树四倍体诱导研究)和种间亲缘关系确定提供必要的技术支持。
本研究以桉树尾巨桉无性系DH32-29的二倍体和四倍体组培生根苗为研究对象,进行染色体压片技术观察,并在预处理、染色和压片环节进行探索试验,最终建立了一套成熟稳定的染色体压片技术体系。
1 材料与方法
1.1 试验材料
试验材料为尾巨桉(Eucalyptus urophylla×Eucalyptus grandis)无性系DH32-29的二倍体和四倍体组培生根苗的根尖,试验材料于2015年在中国林业科学研究院热带林业研究所组培室内经过增殖和生根诱导获得。
试验试剂:8-羟基喹啉、秋水仙素、对二氯苯溶液、卡诺氏固定液、盐酸、纤维素酶、果胶酶和卡宝品红等。
试验器材:培养皿、乙醇灯、显微镜(徕卡,型号DM4000)、载玻片、盖玻片、吸水纸、香柏油、石蜡、镊子和解剖针等。
1.2 试验方法
取生根培养基中培养的无性系DH32-29生根小苗,不定根着生5~8 d后,将其洗净,依次进行取材时间、预处理、固定(卡诺氏固定液低温固定24 h)、解离、染色和压片处理,1 000倍显微镜下观察,拍照。在前期预试验基础上设计不同处理组合。
1.2.1 取材时间
以2 h为间隔进行取材,取材时间为 08:00、10:00、12:00、14:00、16:00、18:00。在这6个时间点获得的压片效果的基础上,进一步细化时间间隔,设置取材时间间隔为0.5 h。根据上述试验结果,发现在上午08:00到10:00进行取材效果较好,因此,细化后的取材时间分别为08:00、08:30、09:00、09:30、10:00。
1.2.2 预处理
以0.002 mol/L 8-羟基喹啉、0.1 g/L秋水仙素和饱和对二氯苯溶液为预处理剂,在4 ℃条件下浸泡材料,处理时间分别为3 、4 、5 h。
1.2.3 固定
将经过预处理的材料经蒸馏水漂洗后放到卡諾氏固定液中,于4 ℃固定24 h。
1.2.4 解离方法
从固定液中取出根尖,用蒸馏水漂洗,使用稀盐酸解离法和混合酶液解离法进行对比。酸解法:1 mol/L 稀盐酸于60 ℃恒温水浴锅中分别解离6、8、10 min。酶解法:10 g/L 纤维素酶 和10 g/L 果胶酶混合液(体积比为1 ∶1)于37 ℃恒温下分别解离30、35、40 min。
1.2.5 染色
根尖用蒸馏水漂洗后放到卡宝品红中染色 10 min 左右。可以把根尖放在载玻片上,然后滴半滴卡宝品红染液,待其半干后,盖盖玻片,盖时从一边先盖,慢慢盖到另一边,盖玻片和载玻片之间允许有气泡。
1.2.6 压片
夹取1个染色后的根尖置于干净载玻片上,用刀片把根冠及延长区剪去,滴少量染色液,并盖上盖玻片,用橡皮擦轻轻敲打盖玻片,用吸水纸把多余的染色液吸干。
1.2.7 镜检
将压片置于显微镜下观察,观察每个根尖所有的视野,以染色体的清晰程度、分散程度以及细胞有丝分裂中期分裂相(处于分裂期的细胞)的多少、染色体的聚缩程度等作为判定制备的染色体效果观察图的标准。根据镜检结果,确定根尖染色体压片技术的最佳试验方案。
2 结果与分析
2.1 预处理对尾巨桉DH32-29染色体压片制备效果的影响
对材料进行预处理,可阻断纺锤体的形成,使细胞分裂终止在中期阶段,提高中期分裂相的出现频率。试验发现预处理时间过短,染色体聚缩不到位,染色体相互交叉和粘连,难以进行染色体分析(图1-A);处理时间过长,染色体也会发生粘连,聚缩程度严重,不易计数(图1-B)。综合染色体聚缩程度、分散程度等多项指标发现,在3个预处理组合中,获取尾巨桉DH32-29染色体标本效果最好的是8-羟基喹啉处理4 h(图1-C),染色体聚缩程度合适、分散均匀,秋水仙素效果次之,最差的是饱和对二氯苯溶液。
2.2 解离方法对尾巨桉DH32-29染色体压片效果的影响
酸解法和酶解法都可使尾巨桉DH32-29根尖完全解离。盐酸在低温条件下对材料解离的时间把握难度较大,容易出现解离过度问题。而混合酶液解离法在材料解离合适时,细胞分散,细胞中染色体也分散,便于计数;若酶解不足(图2-A),染色体不易分散和上色;若解离过度(图2-B),染色体被分解,无法观察到成形的染色体。因此,从操作的便利度及成本考虑,以纤维素酶和果胶酶混合溶液于37 ℃恒温解离35 min为佳(图2-C)。
在给染色体染色过程中,细胞的边界也变得更加清晰,且压片过程中仍然保留了细胞边界的清晰度和完整性,从而能够看到细胞的大小。如图3所示,桉树四倍体细胞(图3-B)比二倍体细胞(图3-A)大,前者大小是后者的2倍左右。
如图4所示,桉树作为木本植物,压片时需要用力平衡且力度足够,否则,容易出现压片时制片过厚,显微镜观察时同一个焦点无法看清全部,不能在一个清晰的视野内看清染色体全貌,需要多次聚焦才能观察染色体全貌,这样就无法一次性成图。
2.3 取材时间对尾巨桉DH32-29染色体压片效果的影响
设置的8个时间点,在08:00和10:00可观察到较多的分裂中期相,而在12:00、14:00、16:00、18:00观察到的分裂中期相较少。然后,在08:00和10:00之间,观察时间点细分为每隔30 min观测1次,发现一般情况下,09:00时分裂中期相较多。但最佳的取材时间并不具有较好的稳定性,有时会发生偏移,且在最佳取材时间获得分裂中期染色体的比例也有较大波动,可获得分裂中期相染色体细胞占总细胞数比例在10%~20%之间。
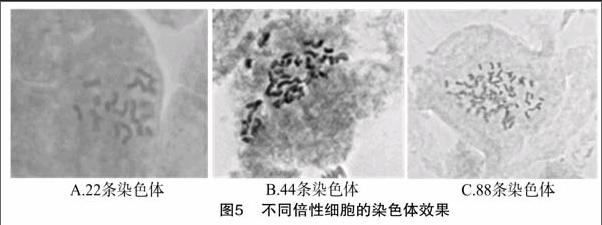
利用本研究优化的压片技术获得了不同倍性的染色体显微镜观察图(图5),加倍获得的八倍体,有88条染色体,但仍然实现了充分的收缩和分布上的分散,能够使用染色体核型分析软件进行计数和核型分析,这也验证了本研究摸索出的方法的可靠性和成熟性。
3 讨论与结论
本研究结果表明,在09:00取根尖获得的分裂中期相的细胞数比例较高,虽然具体比例有较大波动性,但这个时间点分裂中期相比例高且保持了稳定性,说明桉树根尖细胞有丝分裂在24 h的循环周期下具有一定的周期性和稳定性。因此,上午09:00是较合适的取材时间点。
要从桉树这种木本植物的细胞中获得清晰的分裂中期染色体图像,预处理是关键步骤之一。预处理可抑制纺锤体的形成,以积累更多的分裂中期相,同时,可使染色体缩短,便于染色体分散和计数[8-9]。据报道,预处理以4 ℃左右低温处理3~5 h 为宜[10-11]。本研究发现用8-羟基喹啉4 ℃预处理4 h,是制备效果较好的尾巨桉DH32-29染色体的关键。处理时间过短,不仅积累停留在分裂中期相的细胞数量少,而且染色体收缩程度差,染色体个体之间分辨界限不明显,计数难度大;而处理时间过长,染色体收缩程度过大,由短棒状变为纽扣状,染色体间形态差异趋于模糊甚至消失,不利于核型分析和观测染色体形态。
酸解虽然也能够使细胞壁软化,但解离效果不如酶解。推测原因,可能是桉树根尖较坚硬,因此,解离时需要辅助酶来处理。有研究认为,解离的时间控制非常重要[12]。本研究也发现,30、35、40 min之间,相差5 min的解离效果也有很大差异。因此,通过细分解离时间,确定适宜的解离时间,对于获得理想的解离效果具有重要意义。
压片效果要求的2个要点:(1)染色体充分收缩,呈短棒状;(2)染色体充分分散,能较容易实现计数和核型分析。与其他研究[13-18]相比,桉树是较难获得高质量染色体显微镜观察图的树种。从国内已有的研究成果看,虽然谭德冠等均进行了桉树染色体压片观察的研究[19-21],但是,从染色体显微镜观察图来看,未能很好地达到染色压片所要求的2个标准。本研究经过不断摸索和优化試验条件,获得了较高质量的染色体显微镜观察图。
本研究获得的染色体压片技术优化的经验有:(1)预处理和解离时需要设定足够多梯度,从而摸索出最优的试验条件;(2)把握准确的取材处理时间,至少对部分物种是有很大价值的;(3)酶解比酸解在处理难解离材料时,更具有优势。
参考文献:
[1]李懋学,张敩方. 植物染色体研究技术[M]. 哈尔滨:东北林业大学出版社,1991:1-20.
[2]王豁然. 桉树生物学概论[M]. 北京:科学出版社,2010.
[3]黄崇辉,杨朝辉,陈文平,等. 桉树杂交育种技术在雷州林业局的应用[J]. 桉树科技,2008,25(2):55-60.
[4]张 磊,熊 涛,王建忠,等. 广西东门林场桉树无性系选育研究概述[J]. 桉树科技,2015,32(1):45-49.
[5]欧阳乐军,曾富华. 桉树分子育种研究进展[J]. 分子植物育种,2008,6(6):1146-1152.
[6]徐大平,张宁南. 桉树人工林生态效应研究进展[J]. 广西林业科学,2006,35(4):179-187.
[7]Oudjehih B,Abdellah B. Chromosome numbers of the 59 species of Eucalyptus LHerit. (Myrtaceae)[J]. Caryologia,2006,59(3):207-212.
[8]张永兵,陈劲枫,伊鸿平,等. 甜瓜有丝分裂染色体制片技术及核型分析[J]. 西北植物学报,2005,25(9):1735-1739.
[9]王小蓉,汤浩茹,李 玲,等. 根尖压片法制备树莓染色体标本的研究[J]. 四川农业大学学报,2007,25(3):277-281.
[10]陈瑞阳. 中国主要经济植物染色体图谱:第一册——中国果树及其野生近缘植物染色体图谱[M]. 北京:万国学术出版社,1993:263-279.
[11]丁 鸿,邱东萍,陈少雄. 植物染色体标本的制备和染色体核型分析研究进展[J]. 南方农业学报,2012,43(12):1958-1962.
[12]张 羽,王 勇,陈雪燕. 植物染色体制片中疑难问题的解析[J]. 安徽农业科学,2010,38(35):19901-19903.
[13]王 芳,周兰英. 两种榕属植物的染色体核型分析[J]. 西北植物学报,2011,31(9):1749-1752.
[14]郭媛媛,邢世岩,马颖敏,等. 15种榛子种质的染色体核型分析[J]. 园艺学报,2009,36(1):27-32.
[15]杜 培,张新友,李丽娜,等. 高质量花生根尖细胞染色体制片方法研究[J]. 河南农业科学,2013,42(3):31-35.
[16]李永泉,陈清凤,张应中,等. 广宁红花油茶根尖压片制作技术[J]. 广东林业科技,2012,28(2):22-25.
[17]徐道娜,薛志强,李世栋,等. 西瓜染色体压片技术改进研究[J]. 西北农业学报,2007,16(6):301-304.
[18]高和琼,王 英,金 鸽,等. 橡胶树叶片染色体制片方法的优化[J]. 热带作物学报,2009,30(5):565-569.
[19]谭德冠. 刚果12号桉(Eucalyptus 12ABL)组织培养及多倍体诱导的研究[D]. 广州:华南热带农业大学,2004.
[20]李守岭,庄南生,王 英,等. 刚果12号桉胚乳愈伤组织诱导和三倍体植株再生研究[J]. 西北林学院学报,2008,23(3):101-104.
[21]王以红,胡洲鹤,吴幼媚. 桉树染色体的染色和制片技术[J]. 广西林业科学,2004,33(4):177-179.

