保存温度对黄颡鱼肝组织总RNA质量的影响
杨秀荣+王庆容+刘惠茹
摘要:以黄颡鱼肝脏为试验材料,用TRIzol法提取肝脏组织总RNA,将试验样品置于不同温度下保存,在1%琼脂糖凝胶中电泳检测RNA的质量。结果显示:在低温没有密封储存的情况下,RNA保存较长时间,完整性好;-70 ℃下RNA可以保存8个月,-20 ℃下RNA可以保存4个月;在其他温度条件下,若密封保存,4 ℃下可保存2周,10 ℃下可保存4 d以上,20 ℃下保存3 d时条带清晰,保存4 d时条带模糊,30 ℃下保存2.5 d时条带变得模糊,到3 d时全部降解,40 ℃下保存1 d条带清晰,保存2 d条带变得模糊,保存2.5 d时完全降解。此外应注意的是,RNA如果暴露于空气中,5 h内所有试验组的RNA大多数降解。
关键词:黄颡鱼;肝脏总RNA;保存温度;RNA完整性
中图分类号:S917 文献标志码: A
文章编号:1002-1302(2016)11-0258-03
近年来,分子生物学各项技术无论在医学方面还是生物学方面的各个领域均得到广泛应用,高质量的RNA则是其他后续试验的基础。如Northern bolt及杂交分析、寡聚(dT)纤维素选择分离mRNA、cDNA文库的构建、逆转录酶聚合酶链式反应(reversetranscriptase-polymerase chain reaction,简称RT-PCR)、RNA原位杂交、转基因材料鉴定、基因克隆及其表达等试验的成败,在很大程度上取决于RNA的质量[1],对于RNA的质量评价,完整性和均一性是其关键因素[2]。RNA特殊的单链结构导致其自身结构极不稳定,加上周围环境中广泛分布RNA酶(RNase)并且难以灭活,导致RNA很容易降解。有些试验过程中使用RNA的时间跨越度较大,因此确定RNA在不同温度下能保存的最长时间就尤其重要。关于不同温度对RNA质量的影响及不同保存温度下RNA能够保存的最长时间方面的研究,目前相关报道较少。本试验以黄颡鱼肝组织RNA为试验材料,研究不同保存温度对RNA质量的影响,以期为分子生物学研究者日后如何保存RNA提供可行性参考。
1 材料与方法
1.1 试剂配制
0.5×TBE的配制。将10.8 g Tris、5.5 g硼酸、0.744 g EDTA-Na2溶解于经高温灭菌的2 000 mL蒸馏水中,充分摇匀,调节pH值至8.0。
琼脂糖凝胶的制备。取0.7 g琼脂糖溶解于盛有70 mL 0.5×TBE溶液的蓝盖瓶中,将其放入微波炉中反复加热3~4次,直至琼脂糖完全溶解;待胶液冷却至60 ℃,向其中加入7 μL GoldViewⅠ型核酸染色剂(其中琼脂糖的比例为1%,核酸染料的比例为0.01%),将胶液倒入事先已清洗干凈、晾干且插入制胶梳子的胶槽之中,等到胶块冷却凝固后,即可将梳子拔出,完成用于电泳的琼脂糖胶块制作。
1.2 RNA的提取与检测
1.2.1 TRIzol法提取总RNA[3] 取健康黄颡鱼,用剪刀钝处猛击其头部使其昏厥,立即由泻殖孔剪至鳃盖后缘,迅速取肝脏组织(50 mg),将所取组织块放入1.5 mL EP管内并迅速置于液氮中速冻。
向提前灭菌的研钵中倒入液氮以预冷研钵、研钵棒,采用液氮冷冻组织的方法,将组织置于液氮中充分研磨5 min(在研磨过程中要注意及时补充液氮),最终将组织研磨至粉状。用经高温消毒的小钥匙将粉末集中,加入2 000 μL TRIzol试剂以充分破碎细胞组织(按每100 mg组织加入4 000 μL计算),待解冻后转入2个1.5 mL EP管内,离心5 min(13 000 g,4 ℃)。取900 μL上清液转至新的1.5 mL EP管中,加入400 μL三氯甲烷,用力振荡摇匀,室温静置5 min,离心15 min(13 000 g,4 ℃)。将上清液合并于新的1.5 mL EP管中,加入400 μL三氯甲烷,用力振荡摇匀,室温静置2~3 min,离心15 min(13 000 g,4 ℃)。取上清液于另1支EP管中,加入等体积异丙醇,轻轻摇匀,冰上静置15 min,离心15 min(13 000 g,4 ℃)。弃上清,向白色沉淀中加入用 1 000 μL DEPC水配制的75%乙醇清洗沉淀(轻摇混匀),离心5 min(13 000 g,4 ℃),倒掉上清液。真空干燥RNA沉淀,溶解于30 μL DEPC水中。整个总RNA提取过程均在冰上进行,实验台经70%乙醇消毒,铁制试验器具经200 ℃高温消毒300 min,塑料器具置于DEPC水中浸泡过夜后高温灭菌 40 min,试验步骤严格按照规范操作,以防RNA酶污染。
1.2.2 RNA质量检测 通过琼脂糖凝胶电泳的方法对各组RNA进行检测:将胶板没于0.5×TBE的电泳液中,取5 μL RNA样品与1 μL 6×载样缓冲液(loading buffer)混匀后加至点样孔中,130 V 电压电泳20 min,此时条带已接近胶块中央[4],将胶块置于凝胶成像分析仪下观察并拍照记录试验结果。
1.3 RNA的保存
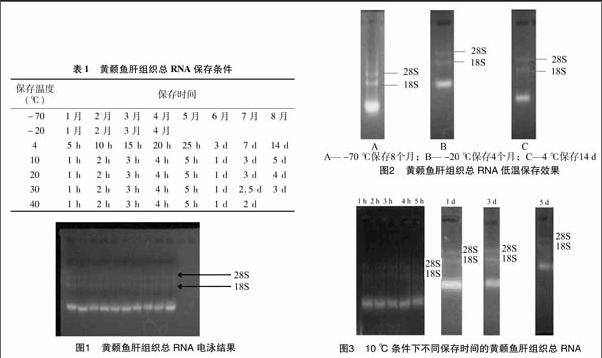
黄颡鱼肝组织总RNA保存条件见表1。
2 结果与分析
2.1 RNA的提取
所提RNA通过琼脂糖凝胶电泳后于凝胶成像分析仪下观察,图1显示,所提RNA均出现28S、18S条带,条带清晰无拖尾,且28S灰度值 ∶18S灰度值>1 ∶1,接近2 ∶1,说明所提RNA的完整性好。
2.2 不同保存温度对RNA质量的影响
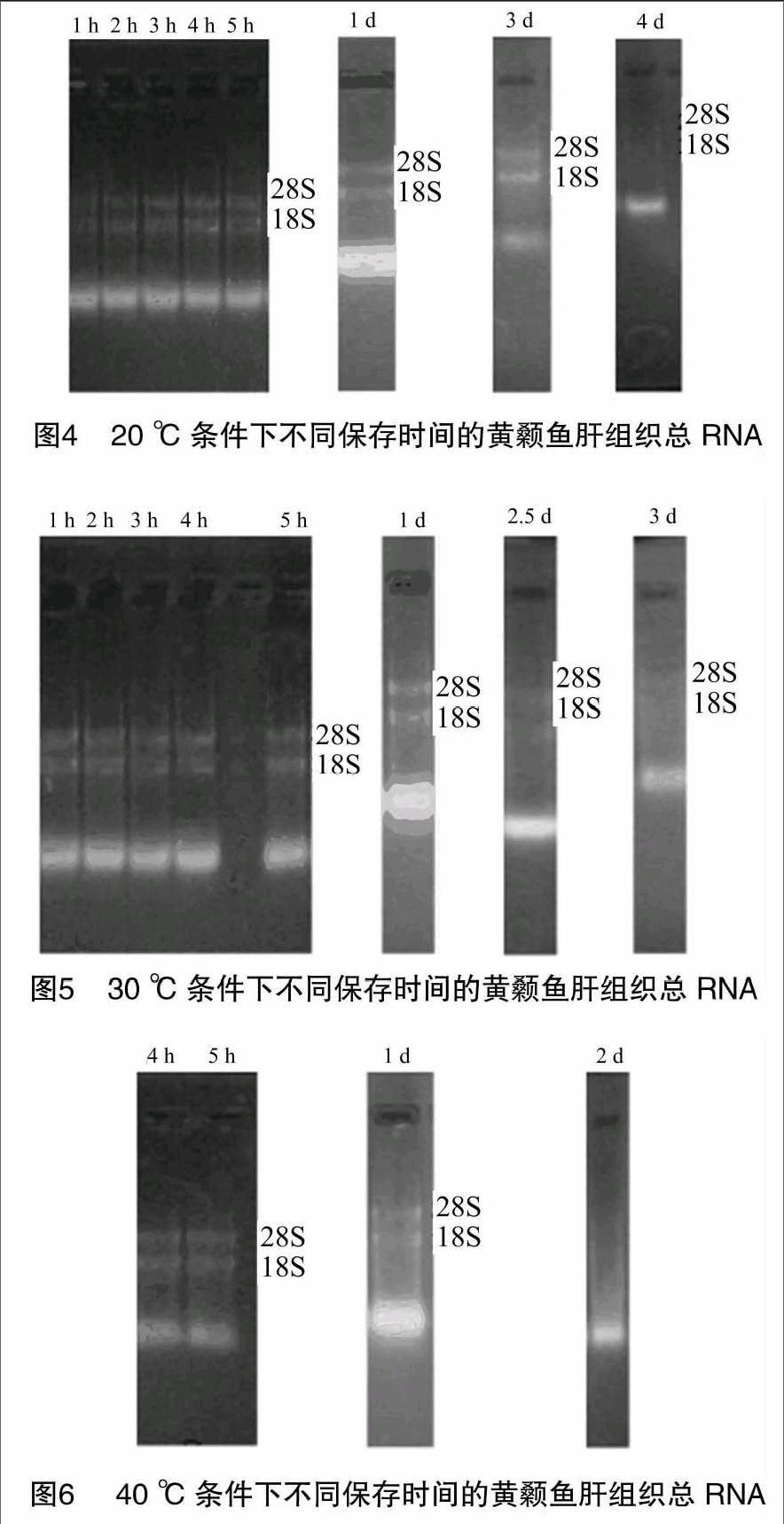
将不同温度下保存的RNA样品通过琼脂糖凝胶电泳进行完整性检测,电泳结果显示:储存在-70 ℃且未放入消毒袋中保存的RNA,8个月后,RNA样品具有清晰的18S、28S条带,且28S灰度值 ∶18S灰度值>1 ∶1,说明RNA的完整性良好,降解程度低(图2-A)。储存于-20 ℃且未放置于消毒袋中的RNA,即直接与周围环境接触,4个月后,RNA样品具有较为清晰的18S、28S条带,且28S灰度值 ∶18S灰度值>1 ∶1,证明RNA较完整(图2-B)。保存于4 ℃下的RNA样品如果直接与空气接触,储存5 h后,RNA18S、28S条带几乎完全消失;如果保存于消毒袋中,14 d后,从图2-C中可以看到18S、28S条带,证明RNA完整性较好。10 ℃下储存的RNA样品,如果没有放于消毒袋中,1 h后条带几乎全部降解;如果储存于消毒袋中,经过1、2、3、4、5 h的保存,条带没有发生明显变化,储存1 d的RNA样品具有清晰的18S、28S条带且28S灰度值 ∶18S灰度值>1 ∶1,储存 3 d 的18S、28S条带灰度值的比值减小,即已部分发生降解,当储存5 d时,条带变得非常模糊,说明RNA大部分已经降解(图3)。在20、30、40 ℃温度条件下,RNA如果暴露于空气之中,储存1 h后,几乎不能观察到条带,如果保存于消毒袋中,20 ℃保存的RNA在经历1、2、3、4、5 h后,条带没有发生变化,仍具有清晰的18S、28S条带,保存1、3 d后,条带仍较为清晰,保存4 d后,RNA条带开始模糊,即开始发生降解(图4)。30 ℃ 下保存的RNA在经过1、2、3、4、5 h时,条带没有发生明显变化,保存1 d后条带较为清晰,保存 2.5 d 时条带开始模糊,保存3 d时,18S、28S条带全部消失(图5)。在40 ℃条件下,RNA在保存1 d时,条带亮度明显低于其他温度下保存的RNA样品;保存2 d后,18S、28S条带全部消失(图6)。
3 讨论
3.1 RNA质量的评价标准
RNA的浓度、纯度、完整性是评价RNA质量的主要标准[5]。此外,通过比较RT-PCR产物也可以对RNA的质量进行评价,分子杂交放射自显影检测也可以对RNA质量进行评价[6],实时定量PCR法也是RNA质量检测的方法之一。可通过核酸蛋白测定仪检测RNA质量浓度及RNA的D260 nm/D280 nm值以确定RNA样品的纯度[7],如果D260 nm/D280 nm 值在1.8~2.0之间则说明RNA的纯度较高;采用RT-PCR法检验RNA的质量,因多糖等杂质的污染会在很大程度上抑制RNA的逆转录,当RNA不纯时,就会导致RNA逆转录的失败,如果RNA的完整性不高,即使有微量的降解也会使mRNA逆转录的cDNA长度大大减小,导致RT-PCR的失败[8]。RNA完整性的测定可通过琼脂糖凝胶电泳的方法,通过在凝胶成像分析仪下进行分析来完成对RNA完整性的分析鉴定,若RNA具有清晰的18S、28S条带,且条带均一无拖尾现象[9]、28S灰度值 ∶18S灰度值>1 ∶1,提示无明显降解[10],说明RNA完整性好。本试验采用琼脂糖凝胶电泳检测RNA完整性的方法来评价RNA的质量,如果电泳结果显示RNA样品具有18S、28S条带,且条带清晰无拖尾,此外28S灰度值 ∶18S灰度值>1 ∶1,则说明RNA的完整性好,即降解少。本试验所采取的琼脂糖凝胶电泳来检测RNA质量的方法基本上可以实现对RNA完整性的分析,但是由于试验过程中专门用于拍摄电泳图片的相机出现故障,为了记录试验结果,采取普通相机拍摄的方法,最终导致试验结果所显示的图片颜色不一致,出现一定的色差。
3.2 影响RNA质量的因素
影响RNA质量的最大因素是RNA本身的單链结构,导致其很容易被降解,另外RNA酶分布广泛,难以灭活,从而极易导致RNA的降解。所以在试验过程中提高RNA质量最重要的措施就是避免RNA酶的污染[11-12]。本试验显示,温度也是影响RNA质量的1个关键因素,不同温度下储存RNA的时间相同,温度越低,RNA的质量变化越缓慢。相同温度下RNA储存不同时间,时间越长,RNA的完整性也越低,即随着时间的增长,RNA也在逐步被降解。
3.3 对分子生物学试验者的建议
由本研究初步得出结论:储存RNA时,最重要的是选择能够降低RNA酶活性或者除去RNA酶的手段,如果对RNA需要进行长时间的储存,应选择-20、-70 ℃的温度进行保存,如果保存RNA在1周以内,且能够保证RNA得到良好的密封时,可以选择于4 ℃进行保存。
参考文献:
[1]李 萍,熊 凡,富 青,等. 一种简便的RNA完整性检测方法[J]. 湖北中医学院学报,2005,7(3):39-40.
[2]李维凯,霍韬光,畅 蓓,等. 保存条件对大鼠海马组织总RNA质量的影响[J]. 化学研究,2012,23(5):93-96.
[3]李冬民,任吴超,王 璇,等. 利用TRIzol试剂和液氮提取大鼠胰腺高质量总RNA[J]. 西安交通大学学报:医学版,2009,30(5):639-642.
[4]梁婧娴,陈志成,贺庆华,等. 检测总RNA质量的两种方法比较研究[J]. 西南民族大学学报:自然科学版,2012,38(1):69-72.
[5]史红鸽,戚元成,申进文. 一种从平菇菌丝中提取总RNA的方法[J]. 江西农业学报,2014(8):68-70.
[6]洪 敏,周晓萍,刘剑凯. 冷酚法提取RNA及质量鉴定[J]. 吉林大学学报:医学版,1992,18(2):105-107.
[7]张 杰,武晶晶,赵飞飞,等. 不同温度和不同放置时间对总RNA提取浓度和纯度的影响[J]. 实验技术与管理,2013(11):79-82,86.
[8]江 莎,孟 凡,周振雷,等. 荧光Real-time PCR鉴定鸡胸骨总RNA质量[J]. 生物学杂志,2012,29(5):92-95.
[9]徐 航,刘仁祥,徐如宏,等. 烟草RNA提取方法的优化及冰盒储存时间的探讨[J]. 江西农业大学学报,2014(3):495-500.
[10]路俊锋,陈 宏,吴劲松,等. 不同保存方法对脑胶质瘤和其周边组织RNA保存的研究[J]. 中国临床神经科学,2010,18(2):199-202.
[11]吴旭东,侯玉霞,张文吉. 黄河鲇不同组织中RNA提取纯化方法研究[J]. 淡水渔业,2006,36(2):24-26.
[12]杨 佳,吴诗杰,王淑萍,等. 发菜总RNA提取方法的比较与优化[J]. 江苏农业科学,2015,43(9):58-60.

