响应面法优化具有抑菌活性的大麦乳酸菌发酵工艺
姚芳+肖香+董英
摘要:通过单因素试验探讨了乳酸菌添加量、发酵温度、发酵时间、料液比、提取液对大麦乳酸菌发酵物抑菌效果的影响;并以大肠杆菌为指标菌,进一步通过响应面分析对大麦乳酸菌发酵液抑菌效果的发酵条件进行优化。结果表明,大麦乳酸菌发酵液最佳抑菌效果出现在料液比1 ∶7(g ∶mL)、发酵温度30.5 ℃、菌种添加量27.5 g/kg、发酵时间25.5 h。在此条件下,抑菌圈直径为17.52 mm,与模型预测值17.56 mm基本一致。
关键词:大麦;乳酸菌;抑菌活性;发酵条件
中图分类号: TS201.1 文献标志码: A
文章编号:1002-1302(2016)11-0296-06
微生物污染导致的食品腐败变质,是食品贮藏保鲜过程中的关键问题。目前延长食品保藏期的主要方法是添加化学防腐剂或一些物理方法,如干燥、冷藏、热处理等[1]。而物理的保藏方法强度过大会降低食品品质,已知的化学防腐剂具有一定危害,因此生物防腐成为研究热点。近年来,乳酸菌的生物转化功能越来越受到人们关注,尤其是其代谢产物的抑菌功能[2-3]。
大麦是我国传统的药食兼用作物,产量位居世界粮食作物第4位,但我国大麦的主要用途是啤酒釀造和饲料工业,仅有10%左右的大麦用于食用,利用率十分低下[4]。已有研究表明,大麦含有β-葡聚糖、黄酮、多酚类化合物、大麦芽碱等多种活性成分,具有清除自由基、抗衰老、抑菌、降血糖、降血脂、抗癌等功能[4-6]。但是,目前有关大麦微生物转化利用的研究较少,其活性功能尚不明确。大麦是乳酸菌发酵的良好基质[7],经乳酸菌发酵后大麦中叶酸、γ-氨基丁酸、可溶性膳食纤维等营养活性成分含量显著升高[8];大麦中含有的多酚类物质[9]经乳酸菌发酵后,由结合态转化为游离态,从而发酵产物的多酚明显增加[10]。Funamoto等发现,大麦烧酒蒸馏后的残留物具有抗肿瘤和免疫活性[11-12];Baek等发现,用2株乳酸菌发酵大米粉制作的年糕,其发酵产物对霉菌具有抑制作用[13],Ross等认为,乳酸菌发酵碳水化合物能够产生丰富的有机酸类(如乳酸、乙酸、丙酸、苯甲酸、香草酸等),能够抑制部分致病菌及腐败菌的生长[14-15]。这些酸的抑菌效果是通过降低体系pH值、抑制菌体生长和代谢而实现的[16]。此外,乳酸菌抑菌蛋白及其衍生物的抑菌能力的研究也有不少报道[17-18]。然而,利用植物乳杆菌发酵大麦,研究其发酵产物抑菌活性,国内外未见报道。本研究以抑菌圈直径为追踪指标,对影响大麦乳酸菌发酵液抑菌活性的各因素进行研究,采用响应面法优化具有抑菌活性的乳酸菌发酵大麦的最佳工艺,旨在提升大麦的生理活性功能,为大麦的高效利用和天然抑菌产品的开发开辟新途径。
1 材料与方法
1.1 试验材料
大麦:新鲜脱壳大麦,购自江苏省盐城市双增农化科技有限公司。
乳酸菌:植物乳杆菌(Lactobacillus plantarum Dy-1,CGMCC No.6016),由江苏大学食品与生物工程学院实验室分离贮藏。
菌种:金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、青霉菌(Penicillium expansum),均为江苏农牧科技职业学院食品科技学院实验室保藏菌种。
1.2 培养基
MRS培养基:1.0%牛肉膏、0.5%酵母膏、1.0% 蛋白胨、2.0%葡萄糖、0.5%乙酸钠、0.2%柠檬酸铵、0.2% K2HPO4、0.058% MgSO4·7H2O、0.025% MnSO4·H2O、0.1%吐温80、1 L蒸馏水,pH值6.2~6.4,琼脂1.5%,115 ℃灭菌 25 min,用于培养乳酸菌。
牛肉膏蛋白胨培养基:0.3%牛肉膏、1.0%蛋白胨、0.5% NaCl、1.5%琼脂、1 L水,pH值7.0~7.2,115 ℃灭菌25 min,用于培养大肠杆菌和金黄色葡萄球菌。
PDA培养基:马铃薯20%(去皮切块后煮沸30 min,取滤液),葡萄糖2.0%,琼脂1.5%,蒸馏水定容至1 L,115 ℃灭菌25 min,用于培养霉菌。
牛肉膏、酵母膏、蛋白胨、琼脂为生化试剂,其他为分析纯,均购自中国医药(集团)上海化学试剂有限公司,马铃薯购自市场。
1.3 试验仪器
高速万能粉碎机,天津市华鑫仪器厂;SPX-250S-Ⅱ型生化培养箱,上海新苗医疗器械制造有限公司;SW-CJ-2FD型双人单面垂直净化工作台,吴江市亚泰净化设备有限公司;台式冷冻干燥机,美国LABCONCO公司;PRIMOR型高速冷冻离心机,美国Thermo Fisher公司;BS-IE型振荡培养箱;上海一恒科技有限公司;AUTOCLAVE·G154DWS型高压蒸汽灭菌锅,上海申胜生物技术有限公司;AL204型电子天平,上海跃进医疗器械厂;EL3002型电子天平,上海申胜生物技术有限公司;0~150 mm游标卡尺,无锡锡工量具有限公司。
1.4 试验方法
1.4.1 大麦乳酸菌发酵物的制备
将新鲜的大麦脱壳磨粉过筛,按料液比1 ∶7(g ∶mL)混合均匀,添加2%的乳酸菌冻干粉,搅拌均匀,30 ℃发酵1 d,8 000 r/min离心 20 min,收集上清液,冷冻干燥后,即为大麦乳酸菌发酵物。
1.4.2 样品抑菌液的制备
将大麦乳酸菌发酵物冻干粉用蒸馏水配制成50 mg/mL的溶液,在超净台中过0.22 μm的膜,即得样品抑菌液。
1.4.3 供试菌悬液的制备
无菌条件下,用划线法将供试菌种(大肠杆菌、金黄色葡萄球菌、青霉菌)分别接种到相应培养基上,将大肠杆菌、金黄色葡萄球菌用牛肉膏蛋白胨培养基置36 ℃恒温培养箱中培养1 d,将青霉菌用PDA培养基置 30 ℃ 恒温培养箱中培养2 d,用接种环挑取适宜的菌落,用无菌生理盐水梯度稀释,获得1×105~1×106 CUF/mL的菌悬液。
1.4.4 抑菌效果的测定
采用打孔法[19]测定抑菌效果,具体方法:在直径9 cm的培养皿中倒入灭菌后的培养基,凝固后加入200 μL相应的供试菌悬液,涂布均匀,用直径6 mm的打孔器在涂布好菌液的平板上打4个分布均匀的小孔,对3个孔中加入100 μL的样品抑菌液,对另1个孔加空白对照液。将细菌于37 ℃恒温培养1 d,将真菌于28 ℃恒温培养 2 d,采用十字交叉法测定抑菌圈2个垂直方向的直径,取其平均值为测定结果,抑菌圈直径越大说明抑菌效果越好。每项抑菌试验重复3次。以上操作均在无菌超净台上完成。
1.4.5 单因素试验
以大肠杆菌、金黄色葡萄球菌、青霉菌为供试菌,以抑菌圈直径为指标,研究提取溶剂、料液比、菌种添加量、发酵时间、发酵温度对大麦乳酸菌发酵液抑菌活性的影响,每组试验重复3次。
1.4.6 响应面试验
根据单因素试验结果设定因素水平,采用Design-Expert 8.05b软件中的Box-Behnken法设计试验方案,选取影响抑菌效果的4个主要因素(料液比、发酵时间、菌种添加量、发酵温度)进行4因素3水平的响应面试验,以对大肠杆菌的抑菌圈直径为响应值,因素水平见表1。
1.5 数据分析
采用Design-Expert 8.05b軟件对数据进行二次多元回归拟合,利用F检验对数据进行方差分析以评价模型的统计意义。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取剂的选择
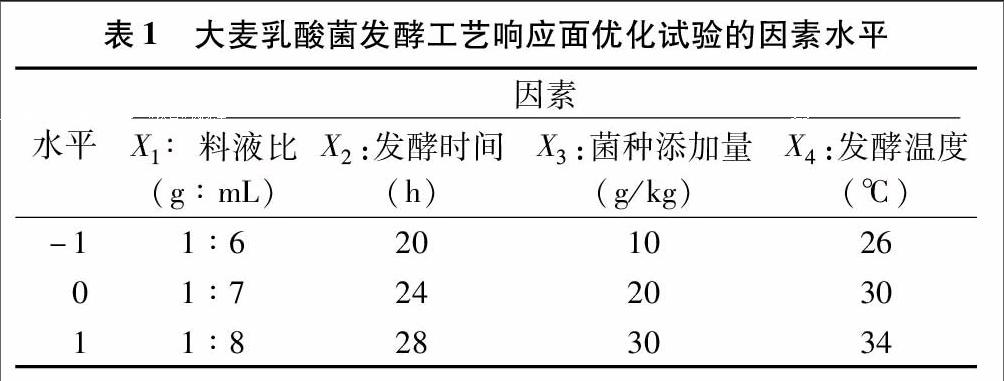
采用蒸馏水、甲醇、乙醇、丙酮、乙酸乙酯等5种提取剂对大麦乳酸菌发酵物中的抑菌活性物质进行提取,制成50 mg/mL的溶液,以大肠杆菌、金黄色葡萄球菌、青霉菌为供试菌,分别以相应的提取剂为空白溶液,研究不同大麦乳酸菌发酵提取液的抑菌性能,扣除空白溶液抑菌圈后的结果见表2。
由表2可知,不同大麦乳酸菌发酵提取液对供试菌的抑菌效果顺序为大肠杆菌>金黄色葡萄球菌>青霉菌,水提取液对3种供试菌的抑菌效果最好,且与其他溶剂提取液相比有显著差异。说明水提取液中有效抑菌物质较多,且水提取液能代表大麦乳酸菌发酵液中所有成分,因此后续试验直接用大麦乳酸菌发酵液为样品。
2.1.2 料液比对大麦乳酸菌发酵液抑菌活性的影响
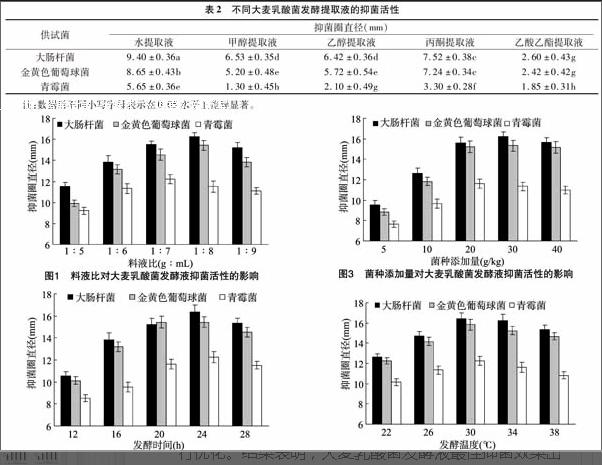
设定20 g/kg的乳酸菌接种量,30 ℃发酵1 d,以大肠杆菌、金黄色葡萄球菌、青霉菌为供试菌,研究不同料液比对大麦乳酸菌发酵液抑菌活性的影响。由图1可知,随料液比增加,大麦乳酸菌发酵液对3种供试菌的抑菌活性呈先增强后减弱的趋势,料液比为1 g ∶7 mL时对青霉菌的抑菌效果最好,在料液比为1 g ∶8 mL时对大肠杆菌和金黄色葡萄球菌的抑菌效果最好,这可能是因为含水量少不利于乳酸菌对大麦的充分发酵,含水量太多会导致大麦乳酸菌发酵液中的抑菌活性物质的相对含量减少,从而减弱了抑菌效果。因此,选择料液比 1 g ∶6 mL、1 g ∶7 mL、1 g ∶8 mL进一步优化。
2.1.3 发酵时间对大麦乳酸菌发酵液抑菌活性的影响
设定料液比为1 g ∶7 mL,乳酸菌接种量为20 g/kg,30 ℃发酵,以大肠杆菌、金黄色葡萄球菌、青霉菌为供试菌,研究不同发酵时间对大麦乳酸菌发酵液抑菌活性的影响。由图2可知,随着发酵时间延长,大麦乳酸菌发酵液对3种供试菌的抑菌活性呈先增强后缓慢减弱的趋势,发酵时间在20 h时对金黄色葡萄球菌的抑菌效果最好,在24 h时对大肠杆菌、青霉菌的抑菌效果最好,这可能是因为发酵时间短时产生的抑菌活性成分少,发酵时间太长会导致一些抑菌活性成分又被代谢利用,因此选择发酵时间为20、24、28 h进一步优化。
2.1.4 菌种添加量对大麦乳酸菌发酵液抑菌活性的影响
设定料液比为1 g ∶7 mL,30 ℃发酵1 d,以大肠杆菌、金黄色葡萄球菌、青霉菌为供试菌,研究不同菌种添加量对大麦乳酸菌发酵液抑菌活性的影响。由图3可知,随着乳酸菌接种量增加,大麦乳酸菌发酵液对3种供试菌的抑菌活性呈先增强后平缓的趋势,在菌种添加量为20 g/kg时,对3种供试菌的抑菌活性达到较大;随着接种量继续增加,抑菌效果并未有明显变化。乳酸菌接种量是影响大麦发酵产抑菌物质的关键因素,乳酸菌接种量小,产生的代谢产物少;乳酸菌接种量大时,发酵产物迅速积累,酸度也迅速上升,当酸度上升至一定水平时,乳酸菌生长受到影响[20],抑菌物质的量也会趋于平稳。因此,选择乳酸菌接种量为10、20、30 g/kg进一步优化。
2.1.5 发酵温度对大麦乳酸菌发酵液抑菌活性的影响
设定料液比为1 g ∶7 mL,乳酸菌接种量为20 g/kg,发酵1 d,以大肠杆菌、金黄色葡萄球菌、青霉菌为供试菌,研究不同发酵温度对大麦乳酸菌发酵液抑菌活性的影响。
由图4可知,随着发酵温度升高,大麦乳酸菌发酵液对3种供试菌的抑菌活性呈先增强后减弱的趋势。在发酵温度为30 ℃时,对3种供试菌的抑菌活性达到最大;但发酵温度为26~38 ℃时抑菌圈直径变化不显著,可能是因为乳酸菌在此温度范围内都能生长。温度偏低时,乳酸菌生长缓慢,发酵时间延长;温度偏高时,会影响发酵过程中某些酶的活性,降低抑菌物质的产生。因此,选择发酵温度为26、30、34 ℃进一步优化。
2.2 大麦乳酸菌发酵工艺的响应面试验分析
2.2.1 响应面分析方案及结果
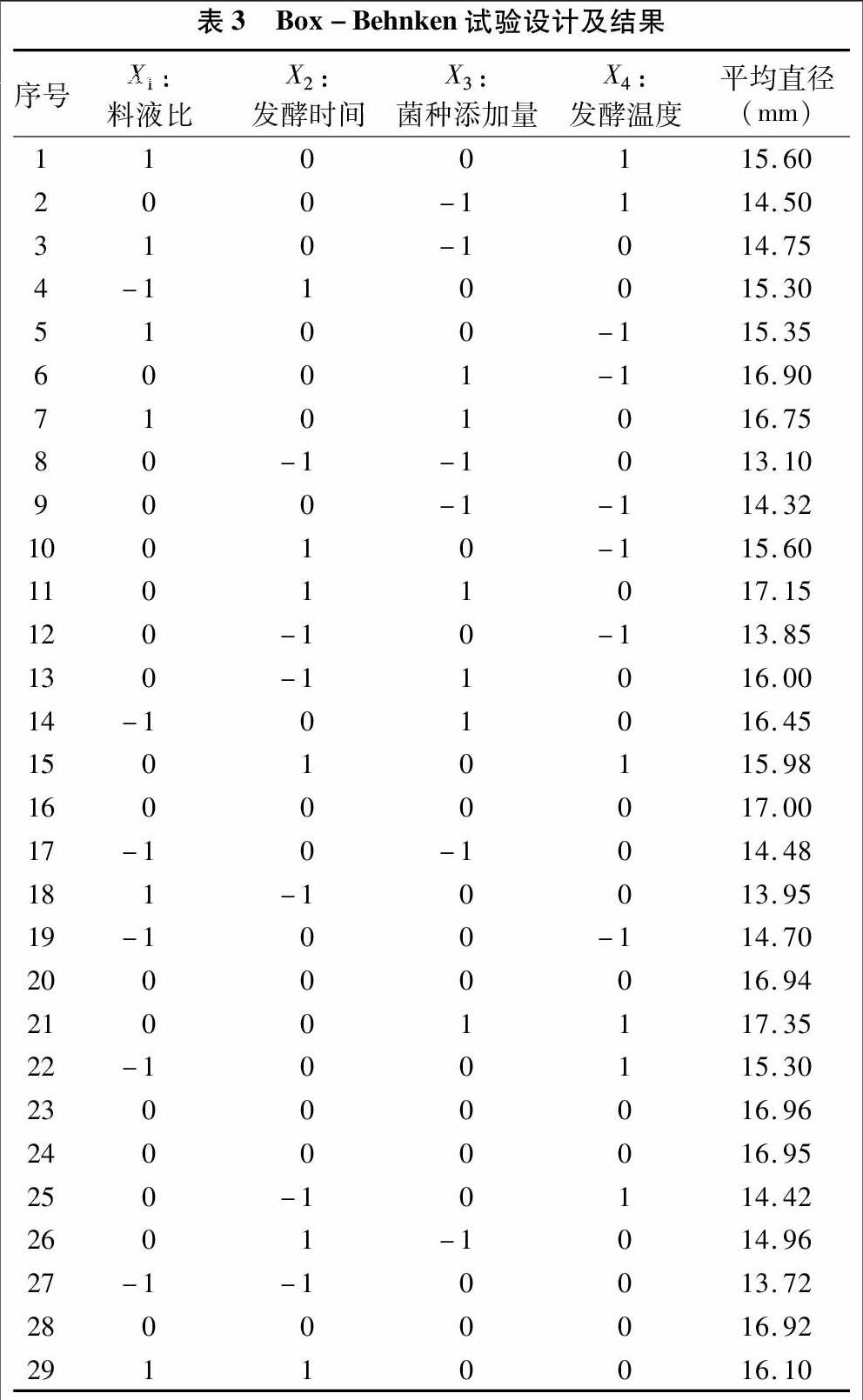
大麦乳酸菌发酵工艺条件的响应面分析试验根据Box-Behnken设计进行了29组试验,其中5组中心点重复试验,结果见表3,回归模型的方差分析见表4。
从表4可知,该模型的F值为102.85,P值小于0.000 1,显著性检验结果表明二次回归模型对抑菌圈直径的影响高度显著。试验中一次项X1、X2、X3、X4和二次项X12、X22、X32、X42对抑菌圈直径的影响极显著,说明各试验因素对响应值的影响不是简单的线性关系,料液比、发酵时间、菌种添加量、发酵温度对大麦乳酸菌发酵液的抑菌效果有极显著影响。由统计学计算出的模型相关系数R2值为0.990 4,说明模型有很好的精密度;模型校正决定系数R2Adj为0.980 7,说明该模型能解释98.07%响应值的变化,仅有总变异的1.93%不能用此模型来解释,说明该模型与实际试验的拟合程度好,用该模型对具有抑菌活性的大麦乳酸菌发酵工艺条件进行优化是合适的。R2Pred为0.944 9,说明该模型预测性良好,能很好地预测影响大麦乳酸菌发酵液抑菌效果的各因素对抑菌圈直径的影响。
2.2.2 響应面因素间的交互作用分析
根据回归模型,将任意2个因素固定在零水平, 可以得到体现另外2个因素及其交互作用影响的响应面曲线图及对应的等高线图(图5)。
曲面图的形状可反映出单因素对响应值的影响,曲面越陡峭,影响越显著,拟合的响应面图和等高线图比较直观地反映了各因素间的交互作用。由图5可知,以对大肠杆菌的抑菌圈直径为响应值,各因素对大麦乳酸菌发酵液抑菌效果的影响顺序为菌种添加量>发酵时间>料液比>发酵温度,与表4中F值分析结果一致。菌种添加量、料液比、发酵温度过高或过低和发酵时间过长或过短,都不能使大麦乳酸菌发酵液的抑菌效果达到最大,只有其取某个适中值时,才可使抑菌圈直径达到最大值。沿菌种添加量轴线等高线相对密集,表明菌种添加量对抑菌效果的影响最大。图5-a、图5-d中等高线密度分布不均匀,呈椭圆形,说明发酵时间和料液比、发酵时间和菌种添加量的交互作用较强,影响较显著。
2.3 验证试验
根据Box-Behnken试验所得的大麦乳酸菌发酵工艺参数结果和二次多项回归方程,利用Design Expert 8.05b软件中的“Optimization”模块分析得出优化结果,即获得较好抑菌效果的工艺参数为料液比1 g ∶7 mL,发酵时间25.5 h,菌种添加量27.5 g/kg,发酵温度30.53 ℃,大麦乳酸菌发酵液对大肠杆菌的抑菌圈直径预测可达到17.56 mm。考虑实际操作便利,将发酵工艺参数修正为料液比1 g ∶7 mL,发酵时间25.5 h,菌种添加量27.5 g/kg,发酵温度30.5 ℃。采用修正后的发酵工艺参数进行3次平行验证试验,结果测得抑菌圈直径为17.52 mm,可见该模型能较好地预测具有抑菌活性的大麦乳酸菌发酵工艺参数,具有实用价值。
3 结论
本研究在单因素试验基础上,以大肠杆菌为指标菌,以抑菌圈直径为响应指标,通过四因素三水平的响应分析对大麦乳酸菌发酵工艺进行了优化,建立了大麦乳酸菌发酵工艺的二次多项式回归模型。经方差分析和响应面图得知,各因素对抑菌效果影响的大小顺序为菌种添加量>发酵时间>料液比>发酵温度,料液比、发酵时间、菌种添加量、发酵温度对大麦乳酸菌发酵液的抑菌效果有极显著影响。经回归分析并结合实际操作便利性,确定大麦乳酸菌发酵的最佳工艺为料液比1 g ∶7 mL,发酵时间25.5 h,菌种添加量27.5 g/kg,发酵温度30.5 ℃。在此条件下,抑菌圈直径为17.52 mm,与模型预测值17.56 mm基本一致,说明该模型可靠性较高,对乳酸菌发酵大麦的生产实践有一定的指导意义。大麦乳酸菌发酵液可作为一种天然的抑菌产品添加到其他食品中,提升了大麦的使用价值。
参考文献:
[1]Schnürer J,Magnusson J. Antifungal lactic acid bacteria as biopreservatives[J]. Trend Food Sci Technol,2005,16(1/2/3): 70-78.
[2]De Vuyst L,Leroy F. Bacteriocins from lactic acid bacteria: production,purification,and food applications[J]. Journal of Molecular Microbiology and Biotechnology,2007,13(4): 194-199.
[3]Oliveira R P,Oliveira A L,Glória M A. Screening of lactic acid bacteria from vacuum packaged beef for antimicrobial activity[J]. Brazilian Journal of Microbiology,2008,39(2): 368-374.
[4]Yang Q M,Pan X H,Kong W B,et al. Antioxidant activities of malt extract from barley (Hordeum vulgare L.) toward various oxidative stress in vitro and in vivo[J]. Food Chemistry,2010,118(1): 84-89.
[5]Briggs D E. Barley[M]. London: Chapman and Hall,1978: 89-173.
[6]Pins J J,Kaur H. A review of the effects of barley β-glucan on cardiovascular and diabetic risk[J]. Cereal Foods World,2006,51(1): 8-11.
[7]Hole A S,Rud Ida,Grimmer S,et al. Improved bioavailability of dietary phenolic acids in whole grain barley and oat groat following fermentation with probiotic Lactobacillus acidophilus,Lactobacillus johnsonii,and Lactobacillus reuteri[J]. Journal of Agricultural and Food Chemistry,2012,60(25): 6369-6375.
[8]Kariluoto S,Edelmann M,Nystrm L,et al. In situ enrichment of folate by microorganisms in beta-glucan rich oat and barley matrices[J]. International Journal of Food Microbiology,2014,176(4):38-48.
[9]Thondre P S,Ryan L,Henry C K. Barley β-glucan extracts as rich sources of polyphenols and antioxidants[J]. Food Chemistry,2011,126(1): 72-77.
[10]Tijana M,Slavica S,Suzana I. Effect of fermentation on antioxidant properties of some cereals and pseudo cereals[J]. Food Chemistry,2010,119(3): 957-963.
[11]Funamoto K,Komizu Y,Ichihara H,et al. Antitumor and immunostimulatory effects of residual powder from barley-Shochu distillation remnants[J]. Journal of Health Science,2008,54(3): 287-293.
[12]Ohgidani M,Ichihara H,Goto K,et al. Anticancer effects of residual powder from barley-Shochu distillation remnants against the orthotropic xenograft mouse models of hepatocellular carcinoma in vivo[J]. Biological & Pharmaceutical Bulletin,2012,35(6):984-987.
[13]Baek E,Kim H,Choi H,et al. Antifungal activity of Leuconostoc citreum and Weissella confusa in rice cakes[J]. Journal of Microbiology,2012,50(5): 842-848.
[14] Ross R P,Morgan S,Hill C. Preservation and fermentation:past,present and future[J]. International Journal of Food Microbiology,2002,79(1): 3-16.
[15]Brosnan B,Coffey A,Arendt E K,et al. Rapid identification,by use of the LTQ orbitrap hybrid FT mass spectrometer,of antifungal compounds produced by lactic acid bacteria[J]. Analytical and Bioanalytical Chemistry,2012,403(10): 2983-2995.
[16]Batish V K,Roy U,Lal R,et al. Antifungal attributes of lactic acid bacteria—a review[J]. Critical Reviews in Biotechnology,1997,17(3): 209-225.
[17]Coda R,Rizzello C G,Nigro F,et al. Long-term fungal inhibitory activity of water-soluble extracts of Phaseolus vulgaris cv. Pinto and sourdough lactic acid bacteria during bread storage[J]. Applied and Environmental Microbiology,2008,74(23): 7391-7398.
[18]Rizzello C G,Cassone A,Coda R,et al. Antifungal activity of sourdough fermented wheat germ used as an ingredient for bread making[J]. Food Chemistry,2011,127(3): 952-959.
[19]胡 筱,李春陽,周 涛. 响应面法优化蓝莓叶抑菌物质的提取工艺[J]. 食品工业科技,2012,33(6):309-312,316.
[20]韩 磊,殷文政,岳智慧. 响应面法优化马奶酒对沙门氏菌抑菌效果发酵条件的研究[J]. 食品工业科技,2015,36(23):214-218.

