高效液相色谱法测定环境样品中稻瘟酰胺残留
吴文铸+郭敏+孔德洋
摘要:采用高效液相色谱法,建立了环境样品中稻瘟酰胺残留分析方法。用乙酸乙酯萃取环境水样品;土壤样品用丙酮提取,乙酸乙酯萃取;鱼体样品用乙腈直接萃取;用高效液相色谱法测定环境样品中稻瘟酰胺残留。结果表明,该方法在0.5~10.0 mg/L范围内线性良好,土壤、水、鱼体中稻瘟酰胺的最小检测浓度分别为0.05、0.01、0.05 mg/kg。空白土壤、水和鱼体样品中的加标回收率为76.5%~101.7%,RSD为0.4%~10.5%。该方法分析速度快、灵敏度高、重现性好,适用于稻瘟酰胺在环境样品中的快速检测。
关键词:稻瘟酰胺;高效液相色谱分析;残留检测;环境样品
中图分类号: X592;TQ450.2+63 文献标志码: A
文章编号:1002-1302(2016)11-0326-03
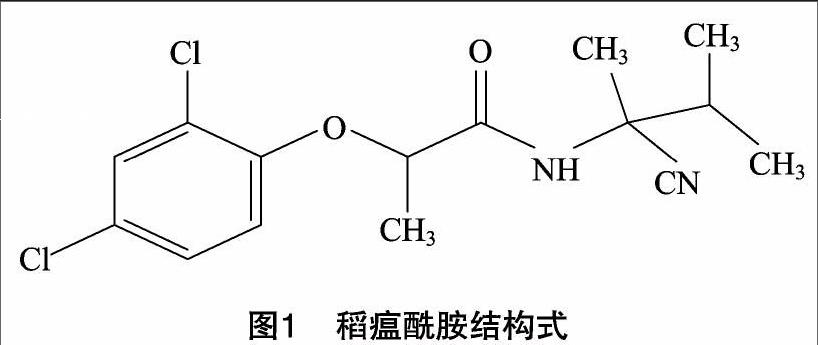
稻瘟酰胺(fenoxanil),是由Shell公司研制,经巴斯夫和日本农药公司共同开发的酰胺类杀菌剂[1-2],化学名称为 N-(1-氰基-1,2-二甲基丙基)-2-(2,4-二氯苯氧基)丙酰胺,分子式C15H18Cl2N2O2,相对分子质量为329.22,结构式如下:
原药为白色粉末,熔点为69.5~71.5 ℃,在pH值=5、7、9时,对酸、碱、热稳定,易溶于乙酸乙酯、乙腈和丙酮等有机溶剂。稻瘟酰胺具有良好的内吸性,持效期较长,具有治疗和抑制孢子形成等作用,可单独使用也可与保护性杀菌剂混用,是目前防治稻瘟病的最佳药剂之一[3-5]。
目前针对稻瘟酰胺的检测方法国内主要集中在气相色谱法的测定[6-10],运用液相色谱法[11-12]测定环境样品中稻瘟酰胺的分析方法鲜有报道。本研究通过优化样品前处理方法和液相色谱相关条件,测定土壤、水和鱼体等环境样品中稻瘟酰胺残留,为深入评价稻瘟酰胺的安全合理使用及环境监测提供相应的科学依据。
1 材料与方法
1.1 仪器与试剂
仪器:WATERS 2695/2998液相色谱仪,PDA检测器(WATERS,美国);Excella E24R全温度振荡器(New Brunsuick Scientific,美国);CR 22GⅡ离心机(HITACHI,日本);Rotavapor R-210旋转蒸发仪(BUCHI,瑞士);MG-2200 氮吹仪(EYELA,日本)。
试剂与材料:乙酸乙酯、丙酮、乙腈、氯化钠、无水硫酸钠、磷酸等,均为分析纯(南京化學试剂有限公司);乙腈,色谱/光谱纯(MERCK,德国)。
稻瘟酰胺标准品纯度为98.2%,江苏丰登农药有限公司提供。
1.2 溶液配制
准确称取0.050 9 g稻瘟酰胺标准品于50 mL容量瓶中,用乙腈稀释至刻度,得到1 000 mg/L的农药标准储备液备用。农药标准工作溶液由上述标准溶液用乙腈稀释制得。
1.3 空白样品采集与保存
空白土壤样品:选择未施用稻瘟酰胺的稻田土样,采集 0~10 cm 深土壤,过筛后混匀,用四分法分取200 g样品,贴好标签,-20 ℃低温中贮存。
空白水样:选择未检测出稻瘟酰胺的环境水样,采集 500 mL 水样,充分混匀,装入样品瓶中,贴好标签,-20 ℃低温中贮存。
空白鱼体样品:选择空白未含有稻瘟酰胺的斑马鱼转入样品袋中,贴好标签,-20 ℃低温中贮存。
1.4 样品前处理
土壤样品提取:向待测土壤样品中加入30 mL丙酮,混匀后25 ℃振荡处理0.5 h,6 000 r/min离心5 min留取上清液。土样重复提取1次,合并上清液,于旋转蒸发仪上蒸发除去丙酮后转入250 mL分液漏斗中,再加入30 mL乙酸乙酯,振荡提取,静置分层后,收集上层有机相;下层溶液再用30 mL乙酸乙酯萃取1次。合并有机相,旋蒸至近干,N2吹干后用乙腈定容,过0.45 μm滤膜,待液相色谱测定。
水样提取:取20 mL水样,加入适量氯化钠摇匀,倒入250 mL分液漏斗中,分别用20 mL 乙酸乙酯提取2次,合并乙酸乙酯相,蒸干,用乙腈定容后,过0.45 μm滤膜,待液相色谱仪测定。
鱼体提取:取2 g左右鱼样置于玛瑙研钵中,加入10 g无水硫酸钠,充分研磨后,将样品转入150 mL三角瓶中,并加入50 mL乙腈,置于恒温振荡器以200 r/min 的速率振摇1 h,过滤后,鱼样再用乙腈振荡提取1次,合并提取液。提取液经旋转蒸发至近干,用乙腈溶解后,于-20 ℃冰冻10 min去脂,过0.45 μm滤膜待高效液相色谱测定。
1.5 HPLC测定条件
色谱柱250 mm×4.6 mm,5 μm ODS-2 HYPERSIL柱,柱温30 ℃;流动相 ∶V乙腈 ∶V水=80 ∶20,流速1 mL/min;进样量 20 μL,检测波长228 nm。上述条件下,稻瘟酰胺的保留时间为4.2 min。采用外标法进行定量分析。
2 结果与分析
2.1 样品前处理方法优化
对空白稻田土壤做加标回收试验( 稻瘟酰胺加标量为1.0 mg/kg),分别考察乙酸乙酯、正己烷、二氯甲烷对目标物的萃取效果。试验表明:乙酸乙酯作萃取剂时,稻瘟酰胺的加标回收率可达85%,样品杂质峰干扰较小;以正己烷作萃取剂时,回收率不到70%;二氯甲烷作萃取剂时,稻瘟酰胺的加标回收率可达85%,但是样品杂质峰干扰较多,且萃取液容易存在乳化现象,对稳定性具有较大影响。故选择乙酸乙酯为土壤样品的萃取剂。
对空白环境水样做加标回收试验( 稻瘟酰胺的加标量为0.5 mg/L),分别考察乙酸乙酯、正己烷、二氯甲烷对目标物的萃取效果。结果表明,与土壤加标回收结果类似,乙酸乙酯的综合效果比正己烷和二氯甲烷要好,故选用乙酸乙酯萃取稻田水样品中的目标物。
对空白鱼体样品做加标回收试验( 稻瘟酰胺的加标量为1.0 mg/kg),分别考察丙酮、乙腈、乙腈 (冷冻去脂) 混合溶液作萃取剂时的萃取效率。试验表明:用丙酮作萃取剂时,稻瘟酰胺的加标回收率能达到90%,但杂质干扰较多;乙腈作萃取剂(不冷冻)时,样品中的脂肪杂质较多,干扰较大,影响出峰效果;乙腈作萃取剂时,且经过冷冻去脂后,回收率均达到75%,且杂质干扰较少。故选用乙腈-冷冻去脂法萃取鱼体样品。
2.2 色谱方法选择
色谱柱选择常规的250 mm×4.6 mm,5 μm ODS-2 HYPERSIL反相柱。依据稻瘟酰胺物化性质,用乙腈作为溶剂溶解样品,并选择乙腈和水作为流动相。将流动相按不同比例在色谱柱上进行试验,最终确定流动相为V乙腈 ∶V水=80 ∶20,在流速1.0 mL/min时,有效成分与杂质能很好地分离,峰形对称,基线平稳,能在短时间得到满意的分析结果,提高了工作效率。
2.3 标准曲线绘制
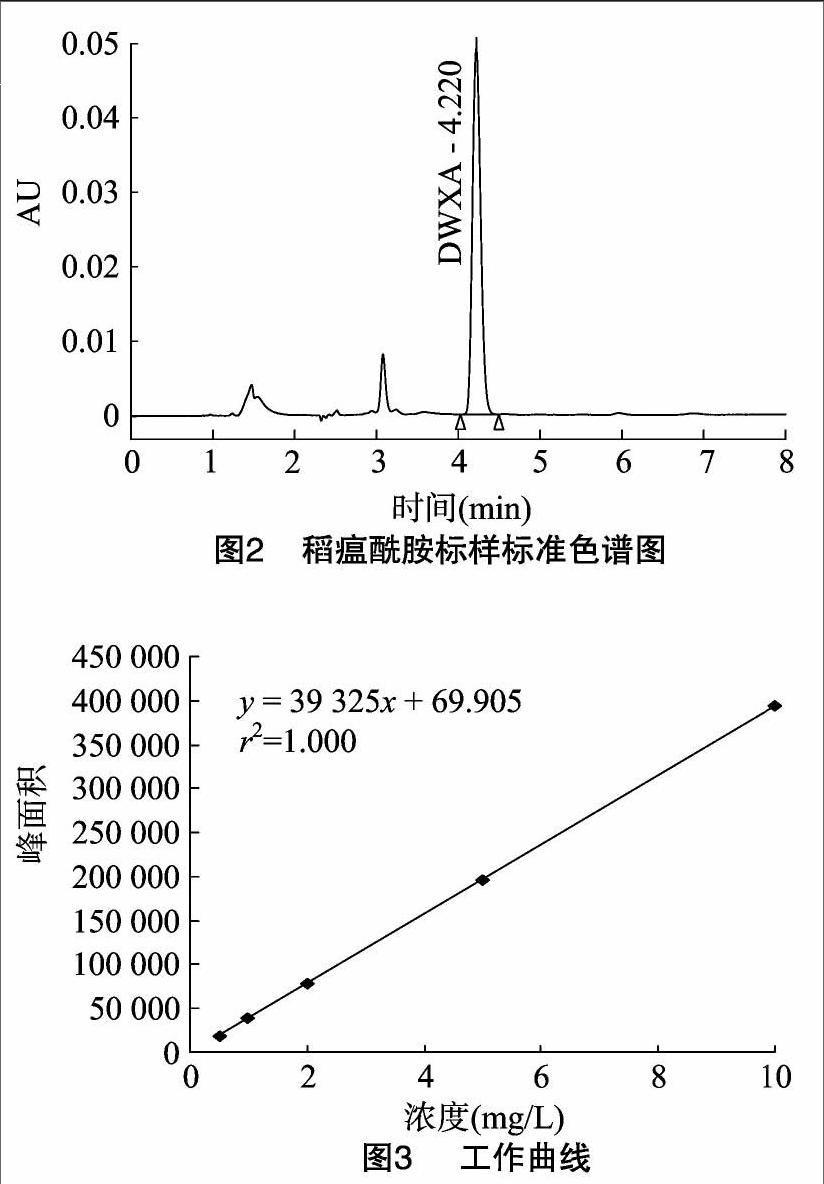
用乙腈依次稀释稻瘟酰胺标准溶液,配制质量浓度分别为0.5、1.0、2.0、5.0、10.0 mg/L的工作溶液,在“1.5”节条件下进行测定,标准溶液色谱图见图2。
以质量浓度为横坐标,对应的峰面积为纵坐标,绘制标准曲线,标准工作曲线见图3。结果表明,在0.5~10.0 mg/L范围内,不同组分的色谱峰面积(y)与稻瘟酰胺质量浓度(x,mg/L)呈现良好的线性关系。回归方程为y=39 325x+69.905(r2=1.000)。
2.3 方法回收率与最低检测浓度
在上述色谱条件下,稻瘟酰胺仪器最小检出量为1.0×10-11 g,土壤最小检测浓度为0.05 mg/kg,水中最小检测浓度为0.01 mg/L,鱼体中最小检测浓度为0.05 mg/kg。
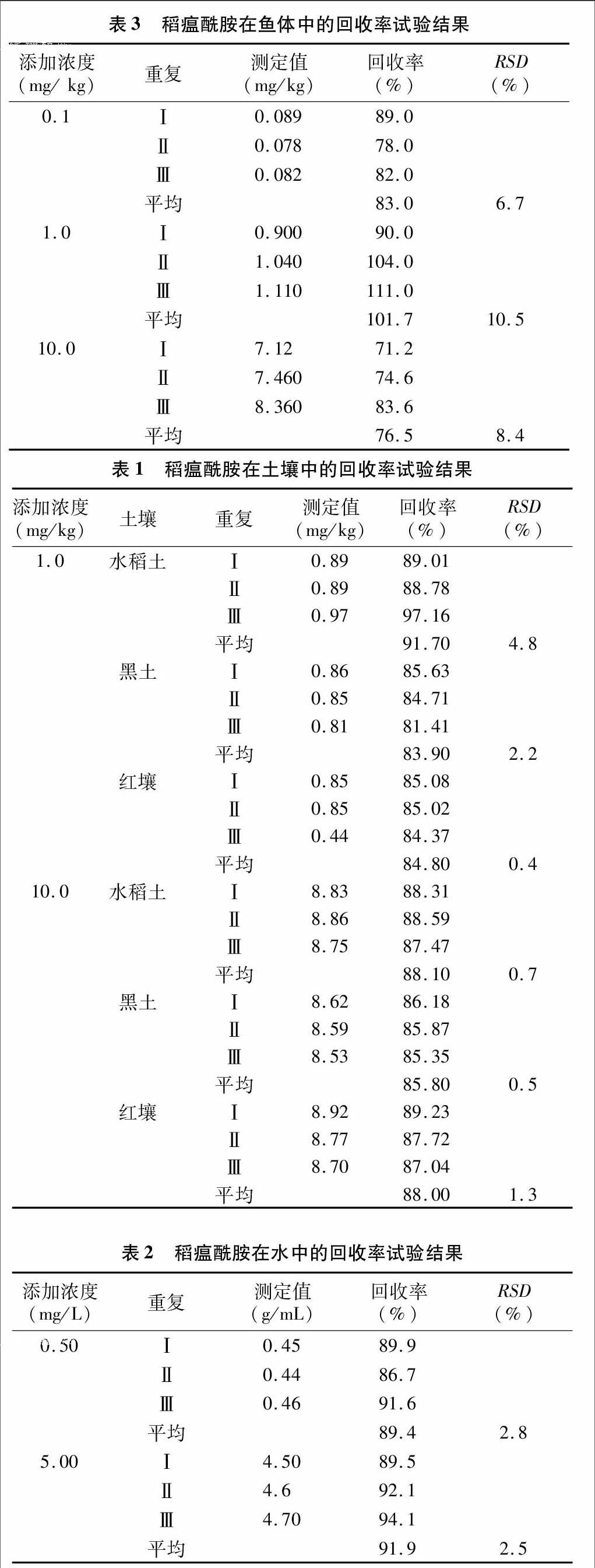
按上述方法对空白土壤、水样和鱼体中进行加标回收试验,土壤回收率结果见表1,水中回收率结果见表2,鱼体中回收率结果见表3。从表1、表2、表3可以看出,当土壤中添加水平为1.0~10.0 mg/kg时,稻瘟酰胺在红壤、黑土和水稻土中的平均回收率在83.9%~91.7%范围内,相对标准偏差为0.4%~4.8%,该方法对不同土壤均具有较高的回收率;当水中添加水平为0.5~5.0 mg/L时,平均回收率在89.4%~91.9%范围内,相对标准偏差为2.5%~2.8%;当鱼体中添加水平为0.10~10.0 mg/kg时,平均回收率在76.5%~101.7%范围内,相对标准偏差为6.7%~10.5%。上述结果表明,该方法具有较好的准确度和精确度,其准确度及精确度均满足农药残留分析試验的要求[13-14]。
3 结论
采用液相色谱法同时测定环境样品土壤、水和鱼体中的稻瘟酰胺残留量,优化后的前处理方法简便、高效,且不受样品中的杂质干扰。在所确定的提取、净化及检测条件下得到的结果表明,土壤中稻瘟酰胺的平均回收率为83.9%~91.7%,相对标准偏差为0.4%~4.8%;水中稻瘟酰胺的平均回收率为89.4%~91.9%,相对标准偏差为2.5%~2.8%;鱼体中稻瘟酰胺的平均回收率为76.5%~101.7%,相对标准偏差为6.7%~10.5%。该方法简便,准确度、灵敏度较高,能够满足稻瘟酰胺在环境中残留分析的要求。
参考文献:
[1]Sasson Y. New trends in chemical structure and mechanisms of action of fungicides[J]. Phytoparasitica,2002,30( 2):199-217.
[2]李 林,关爱莹,刘长令.防治稻瘟病的新型内吸性杀菌剂氰菌胺[J]. 农药,2003,42(7):36-38.
[3]Kawasaki S. Rice blast:interaction with rice and control[M]. 3rd. Ed,IRBC:Kluwer Academic Publishers,2004:1-13.
[4]乔 依.防治稻瘟病的新颖内吸杀菌剂——氰菌胺[J]. 世界农药,2004,26(2):46-48.
[5]Singh R,Sunder S,Dodan D S,et al. Sources of resistance to blast and its management through chemicals[J]. Journal of Mycology and Plant Pathology,2011,41(3):422-425.
[6]彭小悦,龚道新,张 欢,等. 稻瘟酰胺在水稻中的残留及消解动态[J]. 农药,2010,49(11):822-824.
[7]秦 丽,吴慧明,刘福光,等. 稻瘟酰胺在水稻植株及稻田水、土壤中的消解动态研究[J]. 农药学学报,2010,12 (4):494-498.
[8]张昌朋,赵 华,吴 珉,等. 稻瘟酰胺在水稻中的残留分析方法及消解动态研究[J]. 浙江农业学报,2012,24(5):860-864.
[9]谭 红,郭正元,周验旭,等. 气相色谱法同时测定稻田中稻瘟酰胺和咪酰胺残留[J]. 环境监测管理与技术,2015,27(1):42-45.
[10]许 磊,龚道新,刘 博,等. 运用气相色谱法同时测定稻田稻瘟酰胺和醚菌酯残留量[J]. 作物研究,2013,27(2):151-154.
[11]吴琴燕,马圣洲,张文文,等. 柱前衍生高效液相色谱法检测红茶中γ-氨基丁酸含量[J]. 江苏农业学报,2014,30(6):1534-1536.
[12]严 娟,蔡志翔,马瑞娟,等. 高效液相色谱搭载可变波长检测器测定桃果肉中糖组分[J]. 江苏农业学报,2015,31(4):887-892.
[13]农业部农药检定所.农药残留量实用检测方法手册[M]. 北京:中国农业科技出版社,1995:28-31.
[14]中华人民共和国农业部.NY/T 788—2004 农药残留试验准则[S]. 北京:中国农业出版社,2004.

