解钾菌的分离、鉴定及解钾能力
吕睿+李博+宋凤敏

摘要:为了开发高效微生物解鉀肥,利用解钾菌选择培养基,从陕西省周至县猕猴桃园农田土壤中分离出具有解钾能力的菌株共计12株,通过纯化培养,筛选出1株高效解钾菌JK3。利用16S rDNA基因序列分析方法对该菌株的分类信息进行鉴定,鉴定结果表明该菌株为胶质芽孢杆菌(Paenibacillus mucilaginosus),并通过试验确定该菌株的最适培养条件:初始接种量1.5%,摇床转速200 r/min,培养温度30 ℃,初始pH值为7,最佳碳源为糖蜜,最佳氮源为麸皮。试验结果可为解钾菌JK3的大规模工业化生产提供数据支持。
关键词:解钾菌;分离;筛选;鉴定;最适条件
中图分类号: S182 文献标志码: A
文章编号:1002-1302(2016)11-0471-04
钾是植物生长所必需的三大营养元素之一,一般植物体内含钾量占干物质质量的0.3%~0.5%[1]。钾的营养功能主要表现于钾能激活多种酶的活性,目前已知的多种酶需要一价阳离子活化,其中钾离子是植物体内最有效的激活剂;钾能促进光合作用,提高二氧化碳的同化率;钾可促进作物体内物质的合成与转运[2];钾能维持细胞膨压,促进植物生长,植物各种正常代谢过程都需要细胞维持正常的结构和形态,而细胞的正常结构和形态的维持又需要一定的渗透压,钾离子和氯离子正是维持植物细胞渗透压的主要离子;钾能增强植物抗逆性[3],钾也能增强作物抗寒、抗旱、抗高温、抗病、抗盐、抗倒伏等的能力,从而提高其抵抗外界环境的忍耐能力。
然而,随着种植业结构的调整,农作物产量和复种指数的不断提高,土壤中的耗钾量不断增加,全国耕地土壤速效钾含量以2 mg/kg速度下降,南方各地土壤缺钾情况更为严重[4-5]。一方面,我国可溶性钾矿资源严重匾乏,国家每年花巨额外汇进口钾肥仍难以满足农业上对钾肥的需要[6-7]。另一方面,土壤自身含有大量的含钾矿物,只是它们主要以稳定的硅铝酸盐形式存在,其钾不能为作物吸收利用[8]。土壤中的含钾硅酸盐矿物只有在理化因素和微生物的作用下,通过分化和分解逐步释放出钾,供作物生长利用。因此,利用微生物降解含钾矿物就显得尤为重要[9]。国内外的研究表明,目前发现的解钾菌株多为胶质芽孢杆菌(Paenibacillus mucilaginosus)[10-11],其在生物菌肥、生物冶金及污水处理方面有着广泛的应用前景[12],因此,胶质芽孢杆菌的研究受到广泛关注。
本试验以钾长石粉作为唯一钾源,通过选择性培养,从猕猴桃大田土壤中分离出12株解钾细菌,并通过分离、纯化、复筛,得到1株解钾能力较强的细菌JK3,研究该菌株的生理生化特征及它对钾长石粉的降解特性,确定菌株的最适接种量、最适pH值、最适生长温度及溶氧量对解钾能力的影响,旨在确定该菌株的生长情况及解钾能力,为开发新的成本低、效果好且不污染环境的解钾菌,充分利用土壤中的钾素资源提供科学依据,对发展绿色农业具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1 土样 土样采自陕西省西安市周至县猕猴桃园土壤,土样采集方法为5点采样法,去除表层土壤,用土钻取深度为0~20 cm的土壤,将5个不同点的土样混合为1份,装入无菌样品采集袋,标签注明采样信息,放入4 ℃冰箱保存。
1.1.2 矿样 钾长石粉过100目筛,然后用无菌水浸泡3 d,除去水溶性钾[13]。
1.1.3 培养基 分离培养基[14]:蔗糖5.0 g,KH2PO4 0.5 g,MgSO4·7H2O 0.5 g,CaCO3 5 g,琼脂20 g,去离子水1.0 L,pH值7.2~7.5,121 ℃灭菌20 min。
选择培养基:蔗糖5.0 g,MgSO4·7H2O 0.5 g,CaCl2 0.1 g,FeCl3 0.005 g,钾长石粉1.0 g,琼脂20 g,去离子水 1.0 L,pH值7.2~7.5,121 ℃灭菌20 min。
1.2 方法
1.2.1 解钾菌的富集 取3支250 mL锥形瓶,各装入含无机盐液体培养基100 mL,向锥形瓶中分别加入1 g土壤样品,摇床培养3 d(温度30 ℃,转速180 r/min),吸取锥形瓶底部菌液进行转接,富集解钾菌,每次转接前将菌液涂布到平板上计数。
1.2.2 解钾菌的初筛 将富集培养基中的菌种转接到含钾长石无机盐培养基的平板上,置于30 ℃恒温培养箱中,出现菌落后,挑取单菌落转接至新的固体培养基上,重复上述操作3次,将单菌落放入冰箱保存备用。
1.2.3 解钾菌的复筛 将初筛出的菌株转接到装有100 mL钾长石液体培养基中,恒温培养3 d,涂布,记录菌数,同时检测钾长石的降解,在菌液中加入4 mL H2O2,121 ℃消解 30 min,4 000 r/min离心5 min[1],取上清液,定容至100 mL,以不接菌处理为对照,用火焰分光光度计测量速效钾含量,筛选出1株生长旺盛、降解能力强的菌株。
1.2.4 菌株形态学及生理生化特征 将分离纯化得到的菌株在固体平板上进行划线培养,在温度为30 ℃的条件下培养2 d,观察菌株生长状况及菌落特征。
1.2.5 菌株16S rDNA序列分析及比对 选用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1 492R(5′-GGTTACCTTGTTACGACTT-3′)建立PCR扩增体系进行扩增。PCR反应体系(50 μL):5×One Taq Standard Reaction Buffer 10 μL,10 mmol/L dNTPs 1 μL,10 μmol/L Forward Primer 1 μL,10 μmol/L Reverse Primer 1 μL,One Taq DNA Polymerase 1 μL,Template DNA 2.0 μL,Nuclease-Free Water 34 μL。扩增程序:94 ℃预变性10 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃后延伸 10 min。产物经纯化后测定基因序列,利用BLAST将菌株的基因序列与GenBank数据库中的序列进行比较,选取相似性较高的模式菌株序列,用MEGA5.1中Neighbor-Joining法比较同源性,构建系统发育树。
1.2.6 菌株解钾能力测定 配制解钾培养基(无钾)按 100 mL 每瓶分装于250 mL锥形瓶中,各加入0.1 g准确称取的钾长石粉,在121 ℃条件下灭菌20 min,每个锥形瓶接入2%待测菌悬液,30 ℃条件下摇床培养5 d,菌液中加入 4 mL H2O2,121 ℃消解30 min,然后4 000 r/min离心5 min,取上清液,定容至100 mL,利用火焰分光光度计测定上清液中速效钾含量。
1.2.6.1 最适生长温度的测定 按2%接种量将菌株接入培养液中,调节pH值为7,将菌种接于解钾液体培养基中,分别置于温度为26、28、30、32、34 ℃的摇床中培养5 d,菌液中加入4 mL H2O2,121 ℃消解30 min,然后4 000 r/min离心 5 min,取上清液,定容至100 mL,以不接菌处理为对照,检测速效钾含量。
1.2.6.2 最适生长转速的测定 按试验得出的最适接种量将菌液接种到解钾液体培养基中,调节pH值为7,温度设置为 30 ℃,调节摇床转速分别为140、180、200、220 r/min,培养5 d后,菌液中加入4 mL H2O2,121 ℃消解30 min,然后 4 000 r/min 離心5 min,取上清液,定容至100 mL,以不接菌处理为对照,检测速效钾含量。
1.2.6.3 最适初始pH值的测定 配制解钾液体培养基,分组调节pH值为6、7、8、9,按最适初始接种量和最适生长转速将菌液接种到解钾菌筛选培养基中,在30 ℃条件下摇瓶培养 5 d,菌液中加入4 mL H2O2,121 ℃消解30 min,然后 4 000 r/min 离心5 min,取上清液,定容至100 mL,以不接菌处理为对照,检测速效钾含量。
1.2.6.4 最适初始接种量测定 配制液体培养基,将菌液进行稀释,按0.1%、0.5%、1%、1.5%、2%等5个接种量接入到解钾培养基中,在30 ℃条件下摇瓶培养5 d,菌液中加入 4 mL H2O2,121 ℃消解30 min,然后4 000 r/min离心5 min,取上清液,定容至100 mL,以不接菌处理为对照,检测速效钾含量。
1.2.6.5 碳源利用试验 被测碳源为蔗糖、玉米淀粉、马铃薯淀粉、糖蜜、葡萄糖,浓度为1%,在配好的液体培养基中接入菌种,按前述试验确定的最适培养条件将各样品摇瓶培养 5 d,菌液经消解,离心处理,取上清液测定速效钾含量。
1.2.6.6 氮源利用试验 被测氮源为酪蛋白胨、马铃薯汁[1]、硫酸铵、大豆蛋白胨、麸皮,氮源浓度为1%。接入菌种,按前述试验确定的最适培养条件将各样品摇瓶培养5 d,菌液经消解,离心处理,取上清液测定速效钾含量。
1.2.7 数据处理 数据采用Excel 2010和SPSS 19统计软件进行方差分析和多重比较。
2 结果与分析
2.1 解钾菌的筛选
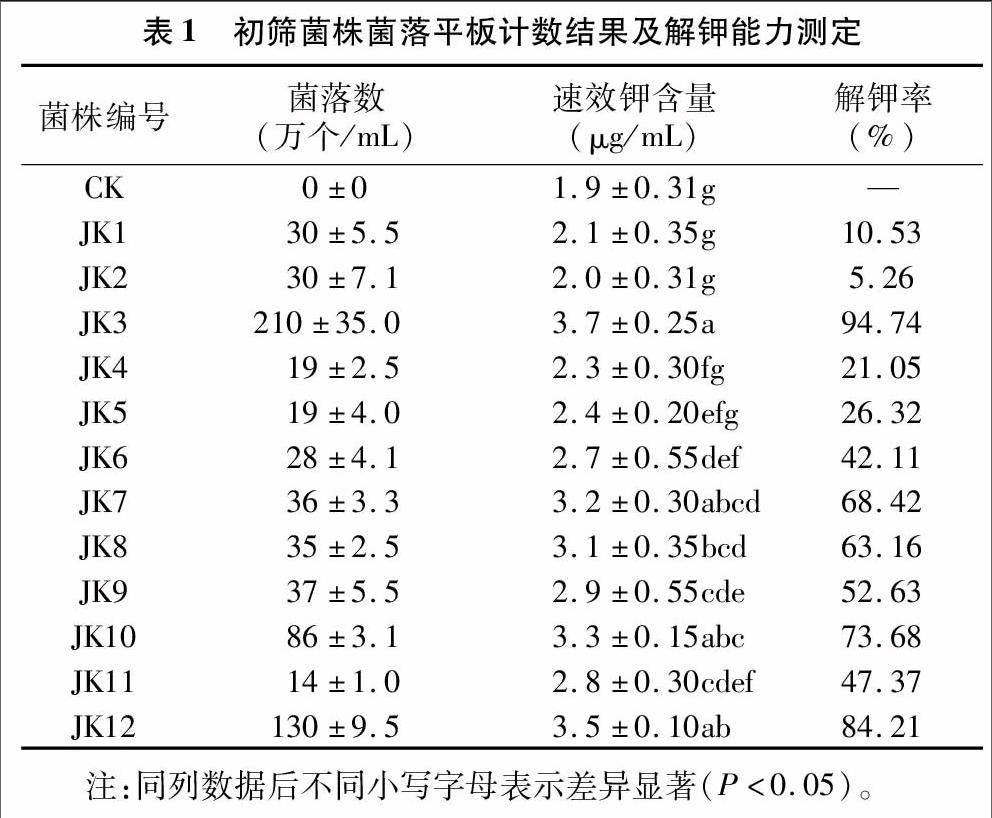
对土壤样品进行涂布处理,初步得到菌株56株,经复筛,得到具有高效解钾能力的菌株12株,通过火焰原子吸收分光光度计测量解钾量。由表1可知,12株解钾菌的解钾能力均较强,相比于对照组均明显增强。其中,JK2解钾效果最弱,菌液中速效钾含量为2 mg/L,比空白对照增加 5.26%;而菌株JK3培养液中速效钾含量最高,达到 3.7 mg/L,比空白对照增加了94.74%,其解钾能力最强。菌株JK12解钾量为3.5 mg/L,与菌株JK3差异不显著,菌株JK3的解钾率明显高于其他菌株,本试验以JK3菌株为研究对象,对其菌落特征和解钾特性作进一步研究。
2.2 菌落形态及生理生化特征
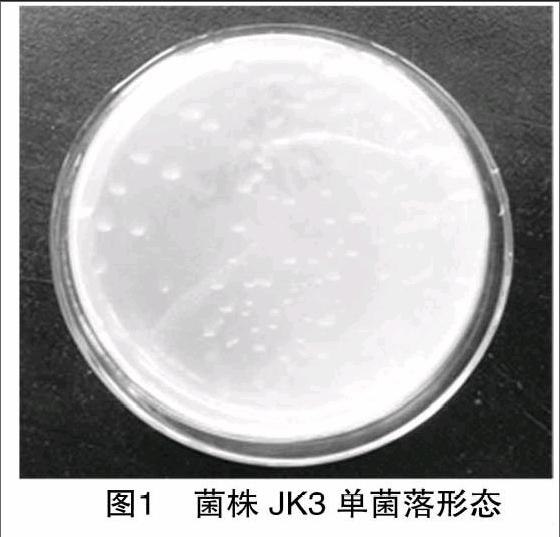
采用平板划线法将JK3菌株进行纯化,并转接至固体培养基上,培养2 d后,观察菌株形态。如图1所示,菌株单菌落呈水滴状,菌落无色透明,边缘光滑,表面湿润且黏稠,菌落直径约为0.5 cm。2.3 16S rDNA测序分析
菌株JK3经16S rDNA测序获得1 400 bp的基因片段,将序列信息提交到GenBank数据库中,利用BLAST将菌株的基因序列进行相似性比较,结果表明,菌株JK3与胶质芽孢杆菌属同源性很高,从16S rDNA序列相似性比较结果看,菌株JK3与胶质芽孢杆菌相似性达到100%, 选取21株同源性较高的胶质芽孢杆菌菌株序列与待测菌株序列构建系统发育树,如图2所示。从系统发育树可以看出,菌株JK3与胶质芽孢杆菌相似性达到100%,且处于同一分支,距离最近,鉴定菌株JK3为胶质芽孢杆菌。
2.4 菌株解钾能力研究
2.4.1 最适培养温度 温度的变化对菌株的生长有显著影响,由图3可看出,随着温度的升高,菌株解钾能力逐渐增强,当温度达到30 ℃时,解钾量达到最高,菌液中的速效钾含量达到5.82 mg/L,比28 ℃时增加了0.7 mg/L,而温度为32 ℃时,解钾量为5.13 mg/L,与28 ℃时差异不显著,可能是温度升高导致菌株生长受到抑制,使解钾能力降低,因此确定菌株JK3的最适生长温度为30 ℃。
2.4.2 最适培养转速 由图4可看出,不同摇床转速对解钾率有明显影响,当摇床转速增加时,菌株解钾能力逐渐增强,当转速达到200 r/min时,菌液中速效钾含量最高,菌液中的速效钾含量达到5.36 mg/L;当转速达到220 r/min时,解钾能力降低,菌液中速效钾含量为4.70 mg/L,比200 r/min时显著降低0.66 mg/L。其原因可能是转速过高,产生的剪切力对菌体造成机械损伤,降低了菌株的解钾能力[15],说明菌株JK3的最适培养转速为200 r/min。
2.4.3 最适培养pH值 不同pH值对菌株生长及解钾能力有显著影响。由图5可看出,当pH值达到7时,解钾量达到最大,菌液中的速效钾含量达到6.1 mg/L,与其他pH值时有显著差异;当pH值达到9时,解钾能力为4.8 mg/L,与pH值为6时无显著差异,而比pH值为8时低了0.6 mg/L,有显著差异。由此确定菌株JK3的最适生长pH值为7,且菌株适合生长于中性或偏碱性的环境中,这对于菌株的大规模生产具有重要的指导意义。
2.4.4 最适初始接种量 由图6可以看出,随接种量的增加,速效钾含量呈逐渐上升的趋势;当接种量为1.5%时,菌液中速效钾含量达到最大,为5.82 mg/L,比接种量为1.0%時高了 1.5 mg/L,且有显著性差异;而当接种量达到2%时,解钾量为5.83 mg/L,与1.5%时无显著性差异。因此,从经济角度考虑,选取1.5%为最适接种量。
2.4.5 最佳初始碳源 不同碳源对菌株JK3的解钾能力有显著影响,以糖蜜为碳源时,菌液速效钾含量最高,达到了 5.6 mg/L,其解钾能力最强;以淀粉为碳源时,解钾能力次之,菌液中速效钾含量达到5.1 mg/L,比糖蜜低了0.5 mg/L,有显著性差异;而以葡萄糖为碳源时,解钾能力最弱,速效钾含量为4.2 mg/L,与其他碳源相比,均存在显著性差异。结果表明,该解钾菌株对碳源的利用以双糖和多糖为主,利用效率优于单糖,其最适生长碳源为糖蜜。
2.4.6 最佳初始氮源 不同氮源对菌株JK3的解钾能力有显著影响,以麸皮(麸皮加水煮沸后过滤,取滤液)为氮源时,菌液速效钾含量最高,达6.1 mg/L,其解钾能力最强;以大豆蛋白胨为氮源时,解钾能力次之,菌液中速效钾含量达到5.4 mg/L,比麸皮低0.7 mg/L,且存在显著性差异;而以硫酸铵为氮源时,解钾能力最弱,速效钾含量为4.3 mg/L,与其他氮源相比,均有显著性差异。结果表明,菌株对有机氮的利用率高于无机氮,菌株最适生长氮源为麸皮滤液。
3 讨论
随着种植业结构的调整,农作物产量和复种指数的不断提高,土壤中耗钾量的不断增加,全国耕地土壤速效钾含量逐年下降,南方各地土壤缺钾情况更为严重。土壤中的含钾硅酸盐矿物只有在理化因素和微生物的作用下,才会通过分化和分解逐步释放出钾,供作物生长利用。土壤中含有大量的解钾菌株[16],李海龙等从秦岭周至县土壤中筛选出1株高效解钾菌,解钾率达到25.1%[17];袁文功等从云南昆明白泥山土壤样品中分离获得1株硅酸盐细菌,其解钾量比空白组高出1.79倍[18]。研究表明,目前发现的解钾菌株多为胶质芽孢杆菌,其在生物菌肥、生物冶金及污水处理方面有着广泛的应用前景,因此,胶质芽孢杆菌的研究受到广泛关注[12]。本研究从周至县猕猴桃园土壤中筛选出1株高效解钾菌株,通过16S rDNA测序,并对序列进行比对确定其为胶质芽孢杆菌,命名为JK3。
不同菌株解钾能力也不相同,秦文旺等从钾页岩矿区分离筛选得到1株解钾能力强的野生型胶质芽孢杆菌,解钾能力达到2.8 mg/L[19];麻瑞阳从不同作物的土壤中筛选出12株解钾菌株,解钾能力最高达到9.61 mg/L[20]。研究表明,菌株JK3在最适培养条件下培养,解钾量可达到6.1 mg/L,具有较强的解钾能力。而不同的菌株培养条件对菌株解钾能力也有显著影响,试验表明,菌株JK3在初始pH值为7、转速 200 r/min、培养温度30 ℃的条件下解钾能力最强。接种量的选择,综合了菌株解钾能力及经济效益等因素,确定最适接种量为1.5%,解钾能力达到5.82 mg/L,与2%接种量时的5.83 mg/L无显著差异。本试验中,菌株JK3以糖蜜为唯一碳源时解钾能力最强,而以葡萄糖为唯一碳源时解钾能力最弱,分别是5.86、4.31 mg/L,说明菌株对多糖的利用优于单糖。而对氮源的利用则表现为有机氮优于无机氮,其解钾能力分别为6.1、4.26 mg/L。
4 结论
本研究从猕猴桃园采集土样,筛选到12株高效解钾菌,通过鉴定和解钾能力的测定,复筛出1株解钾能力最强的菌株,利用16S rDNA基因序列分析方法对该菌株的分类信息进行鉴定,鉴定结果表明该菌株为胶质芽孢杆菌,命名为菌株JK3,其解钾量达 6.1 mg/L,具有较高的解钾能力。通过试验确定该菌株的最适培养条件为:初始接种量1.5%,摇床转速200 r/min,培养温度30 ℃,初始pH值7,最佳碳源为糖蜜,最佳氮源为麸皮,为菌株的开发利用提供数据支持和理论基础。
参考文献:
[1]刘五星. 胶质芽孢杆菌解钾作用与发酵条件研究及在烟草上的应用[D]. 南京:南京师范大学,2003.
[2]郝艳淑,姜存仓,夏 颖,等. 植物钾的吸收及其调控机制研究进展[J]. 中国农学通报,2011,27(1):6-10.
[3]刘晓燕,何 萍,金继运. 钾在植物抗病性中的作用及机理的研究进展[J]. 植物营养与肥料学报,2006,12(3):445-450.
[4]吴振芳. 内切葡聚糖酶基因在毕赤酵母中高效表达及其结构域重构研究[D]. 成都:四川农业大学,2009.
[5]季鹏章. 生物钾肥及其在农业上的应用[J]. 云南热作科技,1999,22(1):45-46.
[6]赵晨曦,刘前刚,张志元. 磷钾细菌解磷解钾能力的研究[J]. 湖南农业大学学报:自然科学版,2005,30(6):519-521.
[7]唐 勇,陆 玲. 解磷微生物及其应用的研究进展[J]. 天津农业科学,2001,7(2):1-5.
[8]朱向东,王宏庭. 土壤钾素管理研究进展[J]. 山西农业科学,2013,41(11):1274-1281.
[9]麻瑞阳,张爱民,惠小双,等. 高效解磷解钾菌 NX-11 菌株的分离筛选,鉴定及最佳培养条件的确定[J]. 华北农学报,2013,28(2):202-208.
[10]Sugumaran P,Janarthanam B. Solubilization of potassium containing minerals by bacteria and their effect on plant growth[J]. World journal of agricultural sciences,2007,3(3):350-355.
[11]Calvaruso C,Turpault M-P,Frey-klett P. Root-associated bacteria contribute to mineral weathering and to mineral nutrition in trees:a budgeting analysis[J]. Applied and Environmental Microbiology,2006,72(2):1258-1266.
[12]馮雅丽,王宏杰,李浩然,等. 一株产絮凝剂硅酸盐细菌的筛选及其絮凝特性[J]. 中南大学学报:自然科学版,2008,39(5):934-939.
[13]何齐庄,金 迪,彭清静. 一株钾长石分解菌的分离、鉴定及系统发育[J]. 安徽农业科学,2010,38(1):23-25.
[14]党 雯,郜春花,张 强,等. 解钾菌的研究进展及其在农业生产中的应用[J]. 山西农业科学,2014,42(8):921-924.
[15]王 雪,袁晓凡,赵 兵,等. 胶质芽孢杆菌培养条件及发酵工艺的研究进展[J]. 过程工程学报,2010,10(2):409-416.
[16]Friedrich S,Platonova N,Karavaiko G,et al. Chemical and microbiological solubilization of silicates[J]. Acta biotechnologica,1991,11(3):187-196.
[17]李海龙,谷 洁,张宏斌,等. 秦岭山区硅酸盐细菌的分离,筛选以及初步鉴定[J]. 西北农业学报,2011,20(4):194-199.
[18]袁文功,季秀玲,邓 伟,等. 一株硅酸盐细菌的分离及解钾活性研究[J]. 中国微生态杂志,2012,24(3):38-41.
[19]秦文旺,牧耀贵,吕利华,等. 一株解钾高活性胶质芽孢杆菌的筛选与育种[J]. 山西农业科学,2015,43(4):434-439.
[20]麻瑞阳. 高效解磷解钾菌株 NX-11 的分离筛选鉴定及作用效果分析[D]. 保定:河北农业大学,2013.

