太子参玉米黄质环氧化酶基因的克隆与表达分析
郑伟+周涛+李军+龙登凯+江维克+丁铃


[摘要] 玉米黄质环氧化酶(zeaxanthin epoxidase,ZEP)在植物脱落酸(abscisic acid,ABA)生物合成间接途径中发挥着重要调节作用。该研究根据太子参转录组数据,克隆获得太子参的Pseudostellaria heterophylla玉米黄质环氧化酶基因,命名PhZEP。对其序列进行生物信息学分析,结果表明PhZEP的开放阅读框(open reading frame,ORF)为1 263 bp,编码420个氨基酸,预测其蛋白的相对分子质量为47.34 kDa,等电点(theoretical pI)为6.64;具有脂质蛋白附着点和黄素蛋白单加氧酶的特征性结构域,且在N端含有分泌信号肽。实时荧光PCR分析发现,PhZEP在叶片中表达量最高,其次是茎和须根;PhZEP在盛花期后10,40 d块根中的表达量较高;ABA处理后PhZEP表达量与对照组相当,经氟啶酮处理后PhZEP的表达量显著高于对照组。该研究从太子参中分离鉴定了ZEP基因,对后续研究其基因的功能特点和解析ABA在太子参生长发育过程的遗传调控提供研究基础。
[关键词] 太子参; 玉米黄质环氧化酶; 克隆; 表达分析
[Abstract] Zeaxanthin epoxidase plays an important role in indirect pathway of plant abscisic acid biosynthesis. According to the data of Pseudostellaria heterophylla transcriptome, zeaxanthin epoxidase gene was isolated and named as PhZEP. The results of bioinformatics analysis showed that the coding sequence of PhZEP was 1 263 bp long and encoded 420 amino acids. The putative protein molecular weight was 47.34 kDa and its theoretical isoelectric point was 6.64. The characteristic structure domains were predicted, including binding site of lipoprotein and flavoprotein monooxyenase. A signal peptide was discovered at the N-terminal of amino acids. The Real-time PCR revealed that PhZEP had a higher expression level in leaves than other tissues of P.heterophylla. Highly expressed PhZEP was also observed at 10 d and 40 d tuberous root after flowering. PhZEP presented a different expression after treatment with ABA, fluridone and ABA +fluridone compared to the control. The expression of PhZEP in tuberous root after ABA treatment was close to that in control group, while PhZEP showed significant up-regulation in the fluridone treatment group. In this study, the PhZEP gene from P. heterophylla was cloned and this result has important significance for its functional identification. This research provides a basis for the further analysis on functional mechanism of ABA during development of P. heterophylla.
[Key words] Pseudostellaria heterophylla; zeaxanthin epoxidase; cloning; expression analysis
太子參为石竹科植物孩儿参Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm.的干燥块根,是我国传统的常用补益中药,具有益气健脾、生津润肺的功效。近年来,太子参的开发利用从临床药品不断延伸到功能性食品和化妆品。太子参块根的生长发育情况是直接影响药材的产量与品质的关键因素[1],植物块根的形成和发育受多种因素影响,其中内源激素的调控是主要因素之一[2-3]。研究认为,脱落酸(abscisic acid,ABA)、细胞分裂素(cytokinin,CTK)、生长素(indole-3-acetic acid,IAA)等激素均有利于块根的膨大[4-6]。
ABA不仅在植物根的生长、块根类作物的物质运输以及种子休眠、果实成熟等生长发育过程中具有关键的调节作用,同时对植物干旱、低温等胁迫环境下的生理活动同样起着重要作用[7-8]。植物体内ABA的生物合成途径一般包括2种:C15直接途径和C40间接途径,高等植物主要以C40间接途径为主。在C40间接途径合成ABA的过程中,首先是C40类胡萝卜素的玉米黄素经过2次环氧化作用形成紫黄质,参与该步反应的关键调控酶基因是玉米黄素环氧化酶(zeaxanthin epoxidase,ZEP)基因[9]。ZEP基因除了在ABA生物合成途径中发挥着重要作用外,还在叶片、茎等叶绿体含量比较丰富的组织中参与植物的叶黄素循环[10]。Audran等[11]研究发现ZEP基因在植物的各组织均存在表达,但在不同组织中的表达具有显著性差异,当受到干旱胁迫诱导时,叶片和根中的ABA含量出现同时增加,对应的ZEP基因的转录水平只在根中增加,而叶片中转录水平受昼夜节律的调控呈周期性变化。因此,陶均等[12]认为ZEP基因可能不是参与ABA生物合成途径中的关键酶基因。
本研究根据课题组前期构建的太子参转录组数据结合生物信息学分析,检索ABA合成相关的ZEP基因,采用PCR方法扩增ZEP基因的全长CDS序列,对所获得基因序列进行生物信息学分析,同时对ZEP基因在太子参的不同组织、不同生长发育时期以及ABA和氟啶酮(fluridone)处理后块根中的表达模式进行检测。为研究ZEP基因在药用植物太子参中ABA的合成途径中扮演着怎样的功能对进一步研究太子参块根发育过程的调控机制奠定研究基础。
1 材料与方法
1.1 样品 研究所用材料有2类,一是贵州施秉本地种源采收期的太子参的茎、叶、块根和须根,样品采集后存于自封袋中带回实验室,将样品表面泥土冲洗干净,及时将块根分成韧皮部和木质部,分别置于10 mL离心管中,液氮速冻后置于-80 ℃冰箱保存备用。二是选取长势健壮一致的太子参幼苗采挖后带回实验室,盆栽置混合土中(普通土-营养土-珍珠岩-蛭石 3∶3∶1∶1),实验组分别采用200 mL的15 mg·L-1ABA,30 mg·L-1氟啶酮和ABA+氟啶酮溶液(等体积混合溶液)对不同盆栽太子参进行灌根,对照组喷施等量的清水,其中对照组分别采收盛花期后10,20,30,40,50,60 d(成熟期)的太子参块根,实验组则在60 d(成熟期)采收太子参块根。每次取大小均匀的块根经液氮速冻后置于-80 ℃冰箱保存备用。
1.2 太子参总RNA提取、纯化与cDNA合成 取-80 ℃保存的太子参样品适量,于预冷的研钵中,加液氮,迅速研磨成粉末状,按RNAiso Plus试剂盒(TaKaRa,大连)操作说明提取总RNA。经DNase I(TaKaRa,大连)纯化后,用50 μL DEPC水溶解RNA,通过1.5%琼脂糖凝胶电泳检测RNA完整性,Nanodrop 2000核酸定量仪检测RNA的浓度和纯度。再按反转录酶M-MLV试剂盒(TaKaRa,大连)操作,将已纯化的总RNA分别反转录合成第一链cDNA,-20 ℃保存备用。
1.3 PhZEP基因的分离鉴定与克隆 从美国国立生物技术信息中心(NCBI)下载拟南芥Arabidopsis thaliana、水稻Oryza sativa等模式植物的玉米黄质环氧化酶基因,构建本地Blast检索太子参转录组数据库,期望值为E-20。将获得的候选基因在NCBI中进行比对分析,得到1条太子参的玉米黄质环氧化酶基因。通过NCBI数据库中ORF Finder查找太子参ZEP基因的开放阅读框(open readingframe,ORF),根据所得ZEP基因的CDS序列的信息,利用Primer Premier 5软件设计CDS序列的全长引物PhZEP-F:5′-ATAGTAGGAGGGAGTATAGCTGGTG-3′,PhZEP-R:5′-TTAACTCATCAGCAACTCGGGTTTG-3′。以太子参块根木质部总RNA的反转录第一链cDNA为模板,进行PCR扩增,扩增体系为0.125 μL TaKaRa Ex Taq (5 U·μL-1),2.5 μL 10×Ex Taq Buffer (Mg2+Plus),2 μL dNTP Mixture (2.5 mmol·L-1),PhZEP-F/R (10 μmol·L-1)各1 μL,1 μL cDNA模板,ddH2O补足至25 μL。反应程序为95 ℃ 4 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 7 min,4 ℃保温。
PCR产物经1.2%琼脂糖凝胶電泳检测后,切胶目的条带,采用Omega胶回收试剂盒回收。取4 μL回收的PCR产物,5 μL连接缓冲液,与1 μL克隆载体pMD19-T(TaKaRa,大连)进行连接,转化大肠杆菌DH5α感受态细胞中,挑选阳性克隆送至南京金斯瑞生物科技有限公司测序。
1.4 PhZEP编码蛋白的生物信息学分析测序结果 用Genetyx version 7软件去掉载体序列,通过Sequencher 4.2软件与PhZEP的预测序列进行比对分析后采用DNAman软件翻译为氨基酸序列。使用在线工具ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)查找ORF。用NCBI中Blastp工具对所获得的编码区序列进行初步同源比对分析,并通过Conserved Domains (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和InterProScan (http://www.ebi.ac.uk/Tools/pfa/iprscan/)对结构域进行预测分析。运用在线工具Protparam (http://www.expasy.ch/tools/protparam.html),SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/),TMHMM Server v2.0 (http://www.Cbs.dtu.dk/services/TMHMM/),TargetP1.1 server (http://www.cbs.dtu.dk/services/TargetP/)依次对PhZEP蛋白的理化性质、信号肽、跨膜区域和亚细胞定位进行预测分析。采用Muscle 3.6软件对PhZEP与其他13种植物的ZEP氨基酸进行序列比对分析,比对结果通过MEGA 6.0软件采用邻接法(neighbor-joining method,NJ)构建系统发育树。
1.5 实时荧光定量PCR(real-time PCR) 根据获得的PhZEP基因的全长CDS序列,利用软件Primer Premier 5设计荧光定量PCR特异性引物PhqZEP-F:5′-AGCACATTGACAAGGGATGA-3′,PhqZEP-R:5′-TGATGAGCCCACATGAAGAT-3′,以1.2项下获得的cDNA为模板,太子参PhACT2 (gi: KT363848)为内参基因,在ABI 7500 实时荧光定量PCR仪进行扩增,对PhZEP基因在太子参的不同组织、不同生长发育时期以及ABA和氟啶酮处理后块根中的表达模式进行检测。实时荧光定量分析试剂盒为GoTaq qPCRMaster Mix(TaKaRa,大连)。PCR扩增体系为2 × GoTaq qPCR Master Mix 10 μL,PhqZEP-F/R (5 μmol·L-1)各0.8 μL,cDNA模板2 μL,加Nuclease-Free Water 补足至终体积20 μL。每个反应重复3次。扩增程序为95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,40个循环,溶解曲线为95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s。根据ABI 7500 Real Time PCR System自带软件的分析方法,用2–ΔΔCt法对PhZEP基因的表达情况进行分析。
2 结果与分析
2.1 太子参PhZEP基因的克隆 通过太子参转录组数据库得到1条ZEP基因的转录本序列,长1 833 bp,包含1个1 263 bp的ORF,编码420个氨基酸,1~104 bp为5′非编码序列(5′UTR),1 368~1 833 bp为3′UTR。利用其全长CDS序列的特异引物PhZEP-F与PhZEP-R,以太子参块根木质部cDNA为模板,经RT-PCR扩增、克隆和测序分析得到1条大小为1 263 bp的片段,与预测结果一致,见图1。
2.2 太子参PhZEP基因的序列分析 通过Protparam预测结果显示PhZEP蛋白的分子式为C2107H3305N581O624S18,相对分子质量为47.34 kDa,等电点pI 6.64。不稳定系数为44.87,脂肪系数为84.95,平均亲水性系数为0.329,说明PhZEP基因编码蛋白是亲水性蛋白。同源性比对分析发现,该基因与甜菜(Beta vulgaris subsp. vulgaris,XP_010670730.1)的ZEP序列相似性最高,达73%。PhZEP基因的结构域属于NADB_Rossmann超家族成员,含有玉米黄质环氧化酶的特征性结构域,分别是1个脂质蛋白附着点区域(prokaryotic membrane lipoprotein lipid attachment site profile,PS51257)位于1~19个氨基酸,4个黄素蛋白单加氧酶区域(flavoprotein monooxyenase,PR00420)位于6~28,158~173,307~338,357~373个氨基酸,FAD结合区域(FAD binding domain,PF01494)位于6~373个氨基酸,见图2。
黑色框.脂质蛋白附着点区域;红色框.起始密码子和终止密码子;黑色线.黄素蛋白单加氧酶区域;红色线.FAD结合区域。
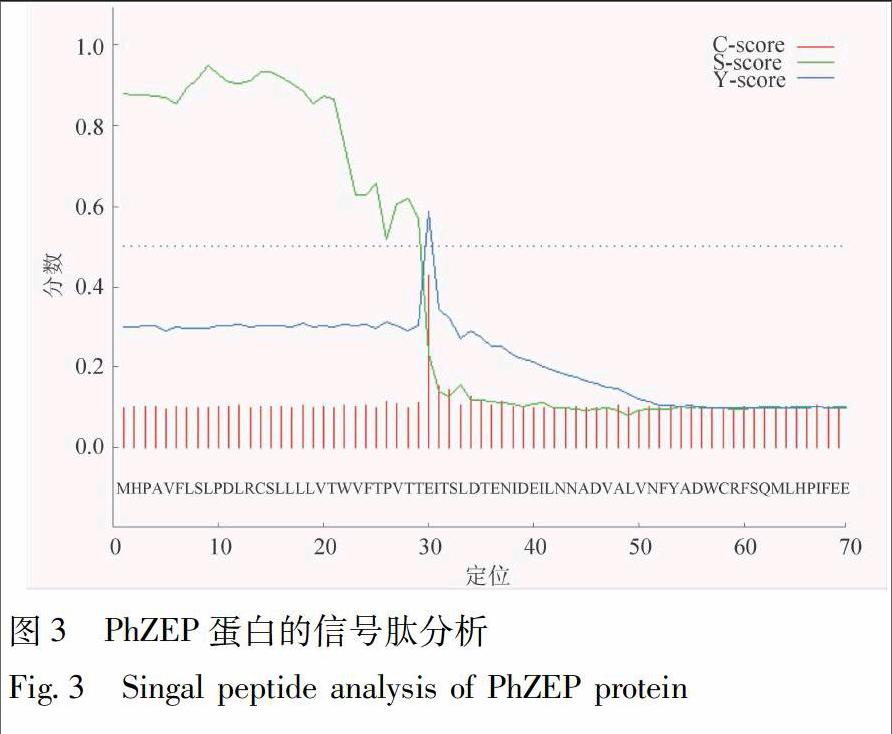
运用SignalP4.1检测到第1~29个氨基酸存在1段信号肽,序列为MKREKKAIIVGGSIAGVSCAHALTTAGWQ,且S平均值大于0.5,推测PhZEP蛋白为分泌蛋白,这与TargetP1.1的亚细胞定位预测结果一致,见图3。SOPMA预测显示,PhZEP蛋白的二级结构中,无规则卷曲(random coil)占36.67%,α-螺旋(alpha helix)占30%,延伸链(extended strand)占23.33%,β-转角(beta turn)占10%,可见无规则卷曲和α-螺旋为二级结构的主要元件,散布于整个PhZEP蛋白中,见图4。
2.3 太子参PhZEP基因的系统进化分析 为分析PhZEP蛋白的进化情况,从NCBI中下载具有代表性的拟南芥A. thaliana、玉米Zea mays、烟草N. plumbaginifaolia、水稻O. sativa、甜菜B. vulgaris subsp. vulgaris等13种植物的ZEP氨基酸序列。将以上ZEP蛋白序列与PhZEP蛋白的氨基酸序列应用Clustal W软件比对分析,再采用MEGA 6.0软件中的邻接法构建ZEP进化树,进行聚类分析。结果
显示,太子参PhZEP只与甜菜ZEP聚为一类,同时在NCBI Blastp同源比对分析中亲缘关系也最近。可能是太子参與甜菜均为石竹目植物,说明石竹目植物的ZEP与其他物种类群的ZEP可能存在功能差异,见图5。
2.4 太子参PhZEP基因在不同组织、不同生长发育时期以及ABA和氟啶酮(fluridone)处理后块根中的表达分析 实时荧光定量PCR分析结果表明,PhZEP基因在太子参5个组织中的表达存在差异,叶片中表达水平最高,茎与须根的表达量次之,块根的木质部和韧皮部最低,见图6;PhZEP基因在太子参不同生长发育的表达量呈现先下降后上升,再下降,其中盛花期后10,40 d的表达量较高,见图7;外源ABA、氟啶酮和ABA+氟啶酮处理后,太子参PhZEP基因的表达量为氟啶酮组>ABA+氟啶酮组>ABA组>对照组,见图8。
3 讨论
ABA合成途径中存在3个关键调节位点,对应3个调控酶,其中的ZEP是ABA合成途径中第一步反应的调控酶,也是一种双功能单加氧酶,属于脂质运载蛋白家族,定位于叶绿体内囊体膜上,具有保护叶绿体的作用[9,13]。本研究从太子参中成功克隆的1个PhZEP基因,编码420个
氨基酸的蛋白质,其中1~19个氨基酸是脂质蛋白附着点,表明PhZEP蛋白也是脂质运载蛋白家族的成员,并且具有4个单加氧酶的结构域,该结构域是ZEP特有,是重要的催化位点[13],因此推测太子参PhZEP基因属于ZEP基因家族的成员。
植物的基因表达具有组织特异性,这种特性与基因的功能特点等密切相关。本研究表明,太子参PhZEP基因在叶片、茎、须根、块根木质部和韧皮部均有表达,并具有特异性,与烟草ABA2[11]、番茄NpZEP[14]的表达模式相似,均在叶片中的表达水平最高,在茎次之,根等部位的表达量较少。叶片和茎是含叶绿体比较丰富的部位,ZEP基因在这2个部分的表达量显著高于其他部位,可能与ZEP定位于叶绿体中有关,也可能是ZEP基因具有保护叶绿体免受光氧化破坏的作用。蛋白质N端的转运肽序列有助于蛋白质从细胞质基质转运到叶绿体[15]。但本研究显示太子参ZEP蛋白N端不具有转运肽序列,而是分泌通路信号肽序列,与PhZEP基因在叶片等器官中高量表达矛盾,说明PhZEP基因可能并未参与太子参叶黄素循环,叶黄素循环可能由ZEP基因家族的其他成员完成。
ABA是调控植物块根或块茎生长发育的关键激素,在不定根的形成、块根的膨大等过程具有重要作用[16]。本研究表明PhZEP基因在太子参生长过程的盛花期后10,40 d的表达量较高,与大黄块根中ABA生物合成相关基因9-顺式-环氧加氧酶基因、醛氧化醜基因和ABA 8'羟化酶基因的表达情况相似[17],即在块根生长过程的初期和中后期的表达上调。说明PhZEP基因可能对太子参块根生长发育的初期和中后期发挥着重要的促进作用。此外,经外源ABA处理后太子参块根中PhZEP的表达量与对照组相当,表明外源ABA可能不影响PhZEP的转录表达。生物合成抑制剂氟啶酮可通过抑制参与ABA合成的八氢番茄红素脱氢酶(phytoene desaturase,PDS)的活性来阻断内源ABA的生物合成,但氟啶酮处理后PhZEP的表达量显著高于对照组,类似结果在桑树研究中也有出现[18],表明PhZEP的表达可能还受其他因素的影响。
大米ZEP基因的突变,导致ABA的含量比较低[19],在拟南芥处于盐和干旱的逆境时,ZEP基因的过量表达,不仅增加了ABA含量,还上调了ABA与逆境响应相关的基因的表达水平[20]。此外,在植物的特定生长发育阶段以及种子等非光合器官中,ZEP基因的表达水平同样限制着ABA的合成[11,21]。本研究表明PhZEP基因在太子参不同组织中的转录表达以叶片最高,块根最低,但在块根生长发育过程中,PhZEP基因的高表达又主要在初期和中后期。因此,作者推测PhZEP基因的表达特性可能对太子参中ABA的生物合成起着关键性的作用。
[参考文献]
[1] 熊厚溪,周涛,江维克,等.基于表型性状和药材品质的8个贵州太子参品系的筛选与评价[J].中国中药杂志, 2014, 39 (21): 4197.
[2] Sarkar D. Photoperiodic inhibition of potato tuberization: an update[J]. Plant Growth Regul, 2010, 62(2): 117.
[3] Mcdavid C R, Alamu S. The effect of growth regulators on tuber initiation and growth in rooted leaves of two sweet potato cultivars[J]. Ann Bot, 1980, 45 (3): 363.
[4] Melis R J M, Staden J V. Tuberization in cassava (manihot esculenta): cytokinin and abscisic acid activity in Tuberous roots[J]. J Plant Physiol, 1985, 118(4):357.
[5] Sakakibara H. Cytokinins: activity, biosynthesis, and translocation[J]. Annu Rev Plant Biol, 2006, 57: 431.
[6] Tuominen H, Puech L, Fink S, et al. A radial concentration gradient of indole-3-acetic acid is related to secondary xylem development in hybrid aspen[J]. Plant Physiol, 1997, 115 (2): 577.
[7] Grossmann K, Scheltrup F, Kwiatkowski J, et al. Induction of abscisic acid is a common effect of auxin herbicides in susceptible plants[J]. J Plant Physiol, 1996, 149 (s 3/4): 475.
[8] Chemys J, Zeevaart J A.Characterization of the 9-cis-epoxyearotenoid dioxygenase gene family and the regulation of abscisic biosynthesis in avocado[J]. Plant Physiol, 2000, 124 (1): 345.
[9] Xiong L M, Zhu J K. Regulation of abscisic acid biosynthesis[J]. J Biol Chem, 2003, 133 (1): 29.
[10] Havaux M, Dall′Osto L, Cuiné S, et al.The effect of zeaxanthin as the only xanthophyll on the structure and function of the photosynthetic apparatus in Arabidopsis thaliana[J]. J Biol Chem, 2004, 279 (14): 13878.
[11] Audran C, Borel C, Frey A, et al. Expression studies of the zeaxanthin epoxidase gene in Nicotiana plumbaginifolia[J]. Plant Physiol, 1998, 118 (3): 1021.
[12] 陶均,李玲.高等植物脫落酸生物合成的酶调控[J].植物学通报, 2002, 19 (6): 675.
[13] Bugos R C, Hieber A D, Yamamoto H Y. Xanthophyll cycle enzymes are members of the lipcolin finity, the first identified from plants[J]. J Biol Chem, 1998, 273 (25): 15321.
[14] 房玮.番茄玉米黄质环氧化酶基因的克隆与功能分析[D].泰安:山东农业大学, 2007.
[15] Rodriguez-Concepci M, Boronat A. Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids. A metabolic milestone achieved through genomics[J]. Plant Physiol, 2002, 130 (3): 1079.
[16] 王庆美,张立明,王振林.甘薯内源激素变化与块根形成膨大的关系[J].中国农业科学, 2005, 38(12):2414.
[17] 王鹏飞,李鑫宇,李明杰,等.地黄块根膨大发生和驱动的组织观察及激素相关基因的调控分析[J].中国中药杂志, 2014, 39(17):3245.
[18] 朱攀攀,刘长英,赵爱春,等.桑树脱落酸生物合成相关基因的鉴定及转录表达分析[J].中国农业科学, 2015(5):1011.
[19] Agrawal G K, Yamazaki M, Kobayashi M, et al. Screening of the rice viviparous mutants generated by endogenous retrotransposon Tos17 insertion. Tagging of a zeaxanthin epoxidase gene and a novel OsTATC gene[J]. Plant Physiol, 2001, 125 (3): 1248.
[20] Park H Y, Seok H Y, Park B K, et al. Overexpression of arabidopsis ZEP enhances tolerance to osmotic stress[J]. Biochem Bioph Res Co, 2008, 375 (1): 80.
[21] Frey A, Audran C, Marin E, et al. Engineering seed dormancy by the modification of zeaxanthin epoxidase gene expression[J]. Plant Mol Biol, 1999, 39(6): 1267.

