瑞士乳杆菌LH-G51冻干菌粉生产工艺研究
雷 丹,韩 迪,蒋德意,甘 聃
(润盈生物(上海)有限公司,上海 201700)
瑞士乳杆菌LH-G51冻干菌粉生产工艺研究
雷 丹,韩 迪,蒋德意,甘 聃
(润盈生物(上海)有限公司,上海 201700)
目的:对瑞士乳杆菌LH-G51菌粉生产工艺进行优化。方法:通过单因素及正交试验设计,确定适合LH-G51生长的发酵培养基、冻干保护剂配方及生产工艺。结果:发酵时间、碳氮源及微量元素添加量均对LH-G51生长有明显影响。最终确定LH-G51培养基碳氮源及微量元素为葡萄糖20 g/L、大豆蛋白胨10 g/L、酵母膏15 g/L、MgSO4·7H2O为250 mg/L、MnSO4·H2O为50 mg/L、发酵时间10 h、保护剂为B。结论:根据优化工艺,LH-G51冻干菌粉活菌数可达到4.21×1011CFU/g。
瑞士乳杆菌;生产工艺;保护剂;冻干菌粉
瑞士乳杆菌是人体肠道内的一种益生菌,也是干酪制品中常用的乳酸菌发酵剂[1],因其能产生多种活性肽以及胞外蛋白酶能优先水解α-CN 和β-CN,故其发酵乳有降血压、抑制肿瘤、降胆固醇等作用[2-5]。食用此菌发酵酸乳能促进钙的吸收,增加骨密度和骨矿物质含量减少骨质流失[6-7]。由于瑞士乳杆菌具有这些益生保健功能,使得此菌具有较好的应用市场,因此提高其产量以及菌粉活菌含量比较具有研究意义。
有研究表明,瑞士乳杆菌在发酵过程中极易自溶,不适于冷冻干燥制备发酵剂[8-9],本研究针对分离自内蒙古传统酸奶酪中的一株瑞士乳杆菌LH-G51,对其发酵培养基、保护剂进行筛选,并进行小试验证及工艺优化,来提高其冻干菌粉活菌数,再进行中试放大,为后续瑞士乳杆菌的生产应用提供重要的研究基础。
1 材料与方法
1.1 材料
1.1.1 菌种 瑞士乳杆菌LH-G51,由润盈生物工程(上海)有限公司菌种保藏中心提供。
1.1.2 基础培养基 MRS:葡萄糖 20 g/L、蛋白胨10 g/L、牛肉浸粉10 g/L、酵母膏5 g/L、磷酸氢二钾2 g/L、柠檬酸氢二胺2 g/L、乙酸钠5 g/L、硫酸镁0.58 g/L、硫酸锰0.19 g/L、吐温-80 1 g/L。
1.1.3 计数培养基 MRS,0.8 g/L琼脂粉。
1.1.4 冷冻干燥保护剂 选取工厂生产所用5种乳杆菌冷冻干燥保护剂A、B、C、D、E(表1)。

表1 瑞士乳杆菌LH-G51冻干保护剂主要成分 单位:g/L
1.2 仪器与设备
15 L、100 L全自动机械搅拌发酵罐,上海佰仑公司;UV-2102C型紫外可见分光光度计,上海菁华科技仪器有限公司;FD8-6型真空冷冻干燥机,上海颖汉化工;冷冻离心机,上海卢湘仪离心机仪器有限公司。
1.3 试验方法
1.3.1 菌种活化与接种发酵 将真空冷冻保藏的LH-G51菌株接种于MRS培养基中于37℃培养12 h,并传代2次。按照3%的接种量接种,接种后的发酵培养基放置于37℃恒温培养箱中培养12 h后检测菌体生长情况。
1.3.2 菌浓度测定 取1 mL发酵液稀释至一定浓度,于600 nm下用紫外分光光度计测定吸光值。
1.3.3 活菌检测 采用平板倾注法,取0.5 mL(或0.5 g)待测样品溶解于4.5 mL无菌生理盐水中震荡均匀,梯度稀释至一定浓度后倾注平板,每个梯度取3个平行样,37℃培养48h后统计菌落总数。
1.3.4 冻干粉制备 发酵结束后,采用冷冻离心机对发酵液进行离心,离心条件:温度4℃、转速7 000 r/min、时间10 min,离心后菌泥和保护剂按照1∶2进行乳化及真空冷冻干燥,冻干机参数为:冷阱温度-80℃,真空度1 mTorr。
2 结果与分析
2.1 菌株鉴定
将分离得到的乳杆菌LH-G51进行培养以及生理生化鉴定,观察菌落形态和菌体形态,初步确定LH-G51为瑞士乳杆菌。
取LH-G51培养液提取细菌总DNA,扩增16S rRNA基因,测定PCR 产物全序列,测得序列进行Blast比对,图1结果显示,该菌株与GenBank中的瑞士乳杆菌CNRZ32相似性为99%,确定乳酸菌LH-G51为瑞士乳杆菌。

图1 LH-G51和瑞士乳杆菌CNRZ32的BLAST比对
2.2 培养基优化
2.2.1 不同碳氮源对LH-G51的影响 碳源及氮源对乳酸菌有着重要作用,是构成细胞物质的基础,为乳酸菌生长繁殖提供能量来源,氮源也是组成乳酸菌蛋白质和核酸的核心元素[10]。本研究在基础培养基MRS的基础上,碳氮源添加量不变,改变碳源及氮源的种类进行发酵。由图2(A)可知,以葡萄糖为单一碳源时生长效果优于其他3种碳源,因此选用葡萄糖为LH-G51培养的最优碳源。由图2(B)可知,不同氮源对LH-G51的生长影响显著,酵母膏及大豆蛋白胨对促进LH-G51的生长效果最明显,其原因可能是这两种氮源物质中的氮是以氨基酸、肽小分子形式存在,因此在菌体生长过程中更容易被利用吸收[11]。A.Amrane的研究[12]也证明,培养基中提高酵母膏的添加量能促进瑞士乳杆菌的生长。

注:(A)图中,a-乳糖、b-葡萄糖、c-蔗糖、d-低聚半乳糖;(B)图中,A-酵母膏、B-蛋白胨、C-牛肉浸粉、D-胰蛋白胨、E-大豆蛋白胨、F-MRS对照图2 不同碳氮源培养基对LH-G51生长的影响

图3 不同微量元素对LH-G51生长的影响
2.2.2 碳氮源添加量正交试验 以对LH-G51生长促进作用较大的葡萄糖、大豆蛋白胨和酵母膏为因素,采用L9(33)正交试验,优化此三种成分的添加量,以活菌数为判断指标,因素水平表见表2。从表3中的极差分析结果可知:根据试验结果所得到的优化复合碳氮源配比为A2B3C1,即大豆蛋白胨10、酵母膏15 g/L、葡萄糖20 g/L。

表2 正交试验因素水平 单位:g/L
2.2.3 微量元素对LH-G51的影响 Mg、Mn、Fe、Cu、Zn等某些微量元素是微生物活性物质构成的重要成分之一,在其代谢过程中这些微量元素还能够激活微生物菌体内的酶类物质,且不同菌株对微量元素的需求不同[13-14],因此需对其添加种类及添加量进行优化。由图3可以看出,添加不同量不同种的无机盐对LH-G51发酵液的活菌数有不同影响,Cu2+对LH-G51有抑制作用,Fe2+、Zn2+促进作用不明显,Mg2+、Mn2+对LH-G51的生长具有较明显促进作用,其中,MgSO4·7H2O和MnSO4·H2O的最适添加量分别为 250、50mg/L。

表3 正交试验结果
2.3 LH-G51冻干保护剂筛选
发酵结束后发酵液离心所得到菌泥,按照表1中的5种保护剂进行乳化及冻干,由表4、表5可知,采用保护剂B乳化冻干的LH-G51菌粉活菌数最高,通过方差分析及Dun-can新复极差法进行多重比较可知,保护剂B与其他4种保护剂差异极显著,因此,选用保护剂B配方为LH-G51的较优保护剂。
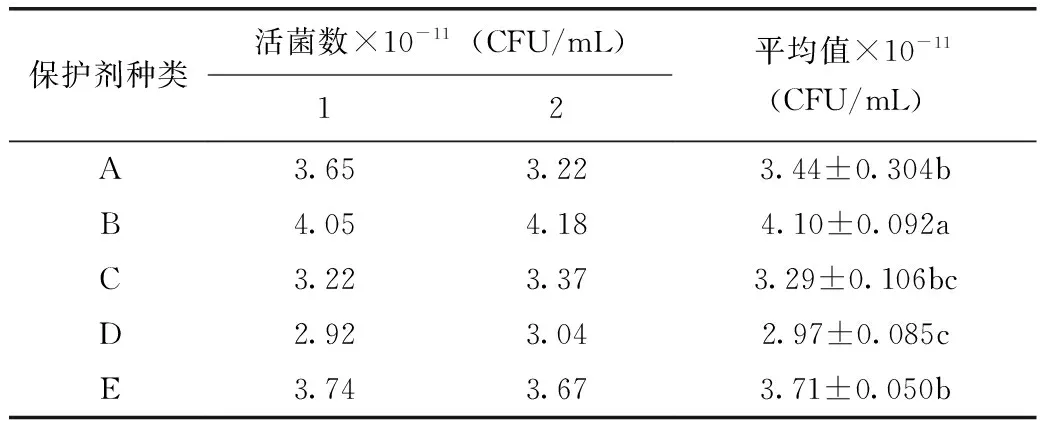
表4 5种冻干保护剂冻干LH-G51菌粉检测结果
注:标有同一字母的数据间差异不显著;方差分析采用Dun-can新复极差法
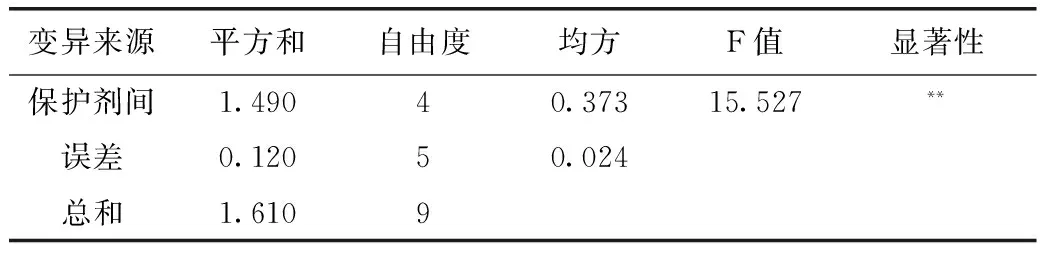
表5 5种冻干保护剂冻干LH-G51菌粉方差分析
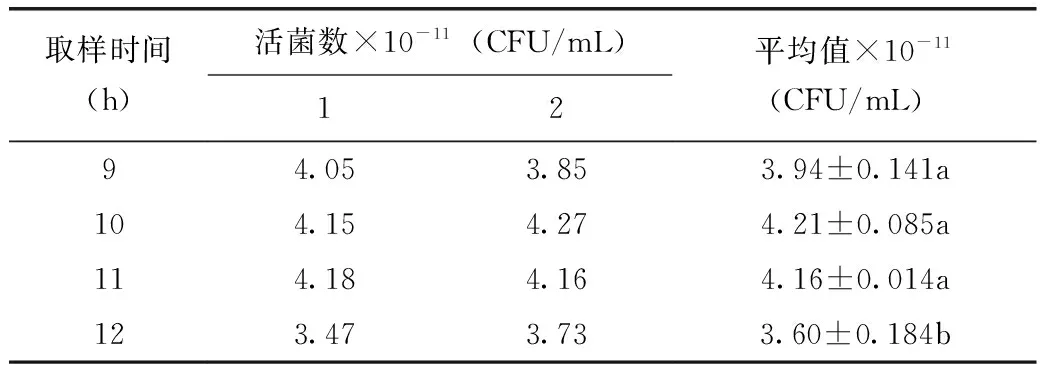
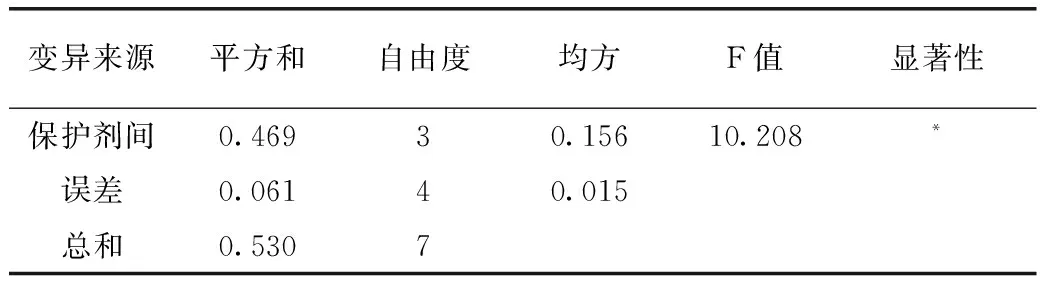
注:F0.05(3,4)=5.192 2.4 LH-G51生产工艺研究 2.4.1 LH-G51在优化的培养基中的生长特性 采用优化的培养基对LH-G51进行15L发酵罐小试试验验证以及发酵工艺优化,选择合适的发酵参数;再进行100L发酵罐中试放大,发酵过程中恒控pH 5.8±0.1。发酵参数为:罐温37±1℃,通氮气保压,罐压0.02~0.05MPa,接种后每隔1 h取样检测LH-G51生长情况及发酵液活菌数,绘制LH-G51的生长曲线。由图4可以看出,LH-G51在优化的培养基及工艺条件下发酵,菌浓度在10 h达到最大值,此时OD600值为10.18,发酵液活菌数达到4.36×109CFU/mL,之后进入稳定期。 图4 瑞士乳杆菌LH-G51在发酵罐中的生长曲线 2.4.2 LH-G51放罐时间的选择 为了保证得到活性最高的冻干菌粉,从发酵9 h开始,每隔1 h取发酵液样品进行离心、乳化及冻干,得到瑞士乳杆菌LH-G51的冻干菌粉,对菌粉进行活菌计数,由表6、表7检测结果及方差分析数据可知,9~11 h所得菌粉样品的活菌数相当,12 h后活菌数下降,考虑到生产成本以及菌泥产量,选择10 h即对数生长期末期进行放罐收获比较合适,提前放罐收率减低,推迟放罐菌会老化从而导致菌粉活力及稳定性下降。 表6 瑞士乳杆菌LH-G51不同取样时间冻干菌粉活菌数 表7 5种冻干保护剂冻干LH-G51菌粉方差分析 注:F0.05(3,4)=6.591 单因素及正交试验确定LH-G51最适培养基(/L):葡萄糖20 g、大豆蛋白胨10 g、酵母膏15 g、无水乙酸钠5 g、K2HPO42 g、柠檬酸氢二铵2 g、MgSO4·7H2O 250 mg、MnSO4·5H2O 50 mg、Tween-80 1 g。LH-G51在此培养基中,经过小试15 L发酵罐优化工艺后,于100 L发酵罐中进行中试,通氮气保压,罐压0.02~0.05 MPa,罐温37±1℃,恒控 pH5.8±0.1,培养10 h后培养基活菌数可达到4.36×109CFU/mL。此时放罐所得的菌泥采用优化的保护剂B进行乳化冻干,得到冻干菌粉活菌数为4.21×1011CFU/g,比在MRS中培养所得的菌粉(8.6×1010CFU/g)提高了近5倍,为瑞士乳杆菌冻干菌粉进一步应用奠定了基础。◇ [1]张莹,陈庆森.瑞士乳杆菌高活力蛋白酶发酵条件的优化[J]. 食品科学,2007,28(9):356-359. [2]Fatah Ahtesh,Lily Stojanovska,Nagendra Shah,and Vijay Kumar Mishra.Effect of Flavourzyme On Angiotensin-Converting Enzyme Inhibitory Peptides Formed in Skim Milk and Whey Protein Concentrate during Fermentation by Lactobacillus helveticus[J]. Journal of Food Science,2016,81(1):135-143. [3]Yamanmoto N,Akino A,Takano T.Antihypertensive effect of the peptides derived from casein by an extracelluar proteinase from Lactobacillus helveticus CP790[J]. Journal of Dairy Science,1994,77(4):917-922. [4]Shuangquan,Harutoshi Tsuda and Taku Miyamoto.Angiotensin I-converting enzyme inhibitory peptides in skim milk fermented with Lactobacillus helveticus 130B4 from camel milk in Inner Mongolia,China[J]. Journal of the Science of Food and Agriculture,2008,88(15):2688-2692. [5]Jayesh J Ahire,Anuja A Bhat,et al.Cholesterol assimilation and biotransformation by Lactobacillus helveticus[J]. Biotechnology Letters,2012,34(1):103-107. [6]Jian-xin HUO,Xiang LI,Xu-juan WEN and Zheng ZHAO.Effects of Lactobacillus helveticus TUST005 fermented milk on bone parameters in rats[J]. International Journal of Dairy Technology,2008,62(1):100-106. [7]Nava M,Halleen J,Vaananen K.Effects of Lactobacillus Helveticus Fermented Milk on Bone Cells in Vitro[J]. Life Sciences,2004,75(14):1727-1734. [8]Carvalho AS,Silva J,Hob P,et al.Relevantfactorsforthe preparationoffreeze driedlacticacidbacteria[J]. Inter.Dairy J.,2004(14):835 -847. [9]郭本恒.干酪[M]. 北京:化学工业出版社,2004:31-32. [10]曾子丹,姚朔影.益生菌的研究前景及国内外发展状况[J]. 食品工业科技,2007,28(8):251-254. [11]岳佳,张青,等.一株瑞士乳杆菌增值培养基的优化分析[J]. 中国乳品工业,2011,39(9):8-13. [12]A.Amrane and Y.Prigent.Influence of yeast extract concentration on batch cultures of Lactobacillus helveticus:growth and production coupling [J]. World Journal of Microbiology & Biotechnology,1998,14(4):529-534. [13]李寅,高海军,陈坚.高细胞密度发酵技术[M]. 北京:化学工业出版社,2006:50-51. [14]张兴昌,陈霞,高鹏飞,等.Lactobacillus fermentum F6的增殖培养基优化及高密度发酵的研究[J]. 乳业科学,2010,3(142):101-107. (责任编辑 李婷婷) Production Process of Lyophilized Powder forLactobacillushelveticusLH-G51 LEI Dan,HAN Di,JIANG De-yi,GAN Dan (BIOGROWING (SHANGHAI)CO.,LTD,Shanghai 201700,China) ObjectiveTo optimize the production process of freeze-dried powder ofLactobacillushelveticusLH-G51.Method Optimized conditions for fermentation medium formula,freeze-drying protective agents and production processing were screened by using single factor and orthogonal experimental design.ResultAmong different factors,carbon sources,nitrogen sources and micro-elements were the key factors during the cell culture stage.The optimal culture medium for LH-G51 was glucose 20 g/L,soy peptone 10 g/L,yeast extract 15 g/L,MgSO4·7H2O 250 mg/L,MnSO4·H2O 50mg/L,the best protective agents was B.ConclusionUnder the optical conditions,the cell number of lyophilized powder of LH-G51 reached up to 4.21×1011CFU/g。 Lactobacillushelveticus;production process;protective agents;lyophilized powder 雷丹(1983— ),女,硕士,研发工程师,研究方向:益生菌制备工艺。 甘聃(1981— ),男,博士,技术研发总监,研究方向:食品营养与健康。
3 结论

