不同品种香蕉抗枯萎病效果及抗性生理研究
剧虹伶, 张 曼, 阮云泽, 赵 艳, 邓 燕,尹黎燕, 何朝族, 王蓓蓓*
(1.海南大学农学院, 海口 570228; 2. 海南省热带生物资源可持续利用重点实验室, 海口 570228)
不同品种香蕉抗枯萎病效果及抗性生理研究
剧虹伶1, 张 曼1, 阮云泽1, 赵 艳1, 邓 燕1,尹黎燕1, 何朝族2, 王蓓蓓1*
(1.海南大学农学院, 海口 570228; 2. 海南省热带生物资源可持续利用重点实验室, 海口 570228)
通过盆栽试验研究了向土壤中接种尖孢镰刀菌古巴专化型4号生理小种(FocTR4)后不同抗枯萎病香蕉品种发病率、根际可培养微生物及防御酶活性的变化。结果表明:试验处理中香蕉枯萎病发病率随着FocTR4接种浓度的增加而上升,但在相同浓度处理下,抗病品种发病率显著低于感病品种;各品种香蕉发病率与根际土壤可培养镰刀菌数量均呈显著正相关关系。抗病品种过氧化物酶(POD)、几丁质酶和β-1,3-葡聚糖酶活性高于感病品种,而与多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)活性存在一定的相关性。说明香蕉抗病性与香蕉根际土壤微生物群落结构及香蕉本身防御酶活性有关。
枯萎病; 尖孢镰刀菌古巴专化型; 发病率; 根际微生物; 防御酶
香蕉枯萎病,又名巴拿马病,是一种毁灭性土传维管束病害。其病原菌为尖孢镰刀菌古巴专化型Fusariumoxysporumf.sp.cubense,属半知菌亚门瘤座孢目镰孢霉属。依据病菌对不同类型香蕉品系或者不同属种的致病程度可将其划分为4个生理小种,其中4号小种Tropical race 4(简称FocTR4)危害最大[1]。培育抗病品种和生产无病组培苗被认为是最有效的防控香蕉枯萎病的手段,该技术最成功的例子是20世纪卡文迪许系列香牙蕉品种(Cavendish subgroup AAA)成功取代被1号生理小种严重危害的‘Gros Michel’ (大米歇尔AAA)大蕉。目前在中国大面积推广种植的‘巴西蕉’、‘威廉斯’等均属于卡文迪许系列香牙蕉[2]。然而,侵染能力更强的4号生理小种的出现正在逐渐摧毁全球的香蕉产业[3]。筛选和种植抗性更强的香蕉品种再次成为挽救香蕉产业的关键手段。‘台蕉1号’(Cavendish, GCTCV-215)、‘宝岛蕉’(Cavendish, GCTCV-218)、‘南天黄’等品种在田间均表现出很好的抗性。同时,我们也发现,在不同土壤上种植的同一个品种香蕉枯萎病的发病率差异很大,在同一地块种植不同品种,香蕉枯萎病的发病率差异也很大。即使是抗病品种,连续多年种植之后枯萎病发病率也会逐年提高。为探究不同品种香蕉与枯萎病4号小种之间的关系以及不同品种香蕉受到病菌侵染后的防御机制,本试验通过向种植有不同品种香蕉的盆栽土壤中加入病原菌孢子悬浮液,研究抗病品种发病率与香蕉枯萎病病菌数量、根际土壤可培养微生物及根系防御性酶活性变化之间的关系,旨在为生产上合理应用抗性品种及品种选育提供参考。
1 材料与方法
1.1 材料
香蕉枯萎病菌Fusariumoxysporumf.sp.cubense(FocTR4),由江苏省固体有机废弃物资源化利用高技术研究重点实验室沈其荣教授提供。将保存的具有强致病性的FocTR4菌种活化,28℃条件下培养3 d后挑取菌丝接种于新的PDA平板,置于28℃培养箱至菌丝覆满整个平板。用无菌水洗脱孢子,两层灭菌纱布过滤,血球计数法确定其浓度后保存备用。
试验土壤采自海南省乐东县尖峰镇尖峰岭下未经农业种植的地块(东经108°46′,北纬18°39′),基本性质为:有机质 5.89 g/kg,碱解氮 25.20 mg/kg,速效磷 39.75 mg/kg,速效钾89.00 mg/kg,pH 5.55,经检测土壤中不含香蕉枯萎病致病菌。
试验共有3个供试香蕉品种,其中‘巴西蕉’(感病香牙蕉品种,‘Brazil’)和‘宝岛218’(抗病香牙蕉品种,‘Formosana’)由海南万钟实业有限公司组培中心提供;‘南天黄’(抗病香牙蕉品种,‘Nantian-huang’)由中国热带农业科学院组培中心提供。
PDA培养基:马铃薯200 g/L、蔗糖20 g/L、琼脂粉18 g/L,pH自然。LB培养基:蛋白胨10 g/L、酵母膏5 g/L、NaCl 10 g/L、琼脂粉18 g/L,pH 7.0。K2培养基:K2HPO41 g/L、KCl 0.5 g/L、MgSO40.5 g/L、Fe-Na-EDTA 0.01 g/L、L-ASP 2 g/L、D-半乳糖10 g/L、琼脂粉18 g/L。高氏培养基:可溶性淀粉20 g/L、KNO31 g/L、K2HPO40.5 g/L、NaCl 0.5 g/L、MgSO40.5 g/L、FeSO40.01 g/L、琼脂粉18 g/L,pH 7.2~7.4。配制时先将淀粉煮熟,再加其他成分溶解定容。马丁氏培养基:采用孟加拉红培养基。上述培养基使用前均经过121℃高温高压灭菌20 min[4-5]。
1.2 试验方法
1.2.1 香蕉抗枯萎病效果试验
选取长有3~4片真叶、健康、长势一致的不同品种香蕉杯苗移栽至盆钵中,每盆装有5 kg无病土。待香蕉长至6~9片真叶时,采用伤根淋菌法接种香蕉枯萎病菌,对照加等量无菌水。孢子悬浮液用血球计数法稀释至1×106cfu/mL,每个品种设4个处理:500 mL无菌水 (CK),5 mL孢子悬浮液+495 mL无菌水(记为103cfu/g土),50 mL孢子悬浮液+450 mL无菌水(记为104cfu/g土),500 mL孢子悬浮液(记为105cfu/g土)。每处理30盆,重复2次。根据参考文献[6]中记载的枯萎病典型症状判断植株发病与否,用该处理发病株数与总株数的比例表示发病率。根际土壤可培养微生物计数采用10倍平板稀释法,将土壤样品用灭菌的去离子水稀释成一定梯度浓度的土壤悬液,均匀涂布在相应的固体培养基上(总细菌采用LB培养基;真菌采用马丁氏培养基;放线菌采用改良高氏培养基;镰刀菌采用K2培养基),细菌30℃培养2 d,真菌28℃培养3 d,放线菌30℃培养7 d,统计菌落数。
1.2.2 香蕉抗枯萎病生理机制试验
香蕉苗同1.2.1,将备用孢子悬浮液稀释至1×106cfu/mL,淋灌在香蕉根系附近基质中,每株15 mL孢子悬浮液[7],每处理30株,3个重复。接种后0、3、6、9、12 d进行取样,将洗净的香蕉根部剪下,尽量保证取样部位及大小一致,样品立即放于液氮中急冻,后放入-80℃冰箱中备用。过氧化物酶(POD)活性测定采用愈创木酚法[7],以每克鲜样每分钟A470变化0.01为一个酶活力单位(U),单位为U/mg FW。多酚氧化酶(PPO)活性测定照韩树全[8]的方法,以每克鲜样每分钟A420变化0.01为一个酶活力单位(U),单位为U/mg FW。苯丙氨酸解氨酶(PAL)参考李合生[9]的方法,以每克鲜样每小时A290变化0.01为一个酶活力单位(U),单位为U/mg FW。几丁质酶(chitinase)参考Fink[10]的方法,绘制N-乙酰葡萄糖胺在420 nm波长下吸光度值的标准曲线,根据A420确定产生N-乙酰葡萄糖胺的量,以每小时分解胶体几丁质产生1 μg N-乙酰葡萄糖胺所需几丁质酶的量为一个酶活单位(U),单位为U/mg FW。β-1,3-葡聚糖酶(β-1,3-glucanase)参考Fink等[10]的方法,绘制葡萄糖在420 nm波长下吸光度值的标准曲线,根据A420确定产生葡萄糖的量,以每小时分解昆布多糖产生1 μg葡萄糖所需的β-1,3-葡聚糖酶的量为一个酶活单位(U),单位为U/mg FW。
1.2.3 数据统计与分析
数据使用Excel 2007和SPSS 17.0通过Duncan新复极差法检验处理间差异显著性水平(P<0.05),通过Pearson相关分析比较不同处理间相关性显著水平(t<0.05)。
2 结果与分析
2.1 接种不同浓度枯萎病菌孢子悬浮液对香蕉枯萎病发病率的影响
接种不同浓度FocTR4孢子悬浮液后,不同品种香蕉发病率均随孢子液浓度的增加而增大,当孢子悬浮液浓度为103cfu/g土时,感病品种‘巴西蕉’发病率达40%,而抗病品种‘宝岛218’和‘南天黄’发病率仅为5%。当孢子悬浮液浓度为104cfu/g土时,‘巴西蕉’的发病率升高至90%,而‘宝岛218’发病率为25%,‘南天黄’发病率仅为20%。当接种的孢子液浓度为105cfu/g土时,感病品种‘巴西蕉’发病率达到95%,而‘宝岛218’和‘南天黄’的发病率分别达55%和45%(表1)。
表1 不同浓度枯萎病菌孢子悬浮液
对香蕉枯萎病发病率的影响1)
Table 1 Effects of different spore concentration on
incidences of different banana varieties

品种Variety发病率/% DiseaseincidenceCK103104105巴西蕉Brazil(0±0.00)a(40±5.77)a(90±5.00)a(95±3.33)a宝岛218Formosana(0±0.00)a(5±0.00)b(25±3.33)b(55±5.77)b南天黄Nantian-huang(0±0.00)a(5±0.00)b(20±3.33)b(45±0.00)b
1) CK:对照; 103: 103cfu/g土; 104: 104cfu/g土; 105: 105cfu/g土。表中数据为平均值±标准误,同列数据后不同字母表示在5%水平上差异显著。 CK: Control group; 103: 103cfu/g soil; 104: 104cfu/g soil; 105: 105cfu/g soil. Data in the table are mean±standard error and different letters in the same column indicate significant difference at 0.05 level.
2.2 接种不同浓度枯萎病菌孢子悬浮液对香蕉根际土壤可培养微生物的影响
由图1可知,向土壤中接种FocTR4孢子悬浮液后,香蕉根际可培养微生物群落结构发生改变,各品种香蕉根际真菌和镰刀菌数量随着接种病原菌浓度的增加而增加,感病品种‘巴西蕉’根际真菌数量显著高于抗枯萎病品种,向土壤中接种浓度为105cfu/g土的病原菌孢子悬浮液时,两个抗病品种香蕉根际土壤真菌差异不显著,且不同品种间根际土壤镰刀菌数量差异不显著。随着FocTR4孢子液浓度增加,香蕉根际细菌和放线菌数量减少,感病品种‘巴西蕉’根际细菌、放线菌都明显低于抗枯萎病品种‘宝岛218’和‘南天黄’,当接种的FocTR4孢子液浓度为105cfu/g土时,‘巴西蕉’、‘宝岛218’和‘南天黄’根际细菌分别减少了55.7%、44.0%和38.1%;根际放线菌分别减少了58.1%、38.1%和28.6%,感病品种‘巴西蕉’根际细菌和放线菌数量减少的幅度显著大于抗病品种。

图1 FocTR4孢子悬浮液浓度对香蕉根际微生物的影响1)Fig.1 Effects of different spore concentration on the amount of microbe in rhizosphere soil
2.3 接种不同浓度枯萎病菌孢子悬浮液后香蕉枯萎病发病率与根际可培养微生物数量相关性分析
由表2可知,3个品种香蕉枯萎病的发病率与香蕉根际土壤镰刀菌数量均呈显著正相关关系,感病品种‘巴西蕉’发病率与其根际真菌数量呈显著正相关,相关系数为0.964,而抗病品种‘宝岛218’和‘南天黄’发病率与根际真菌数量的相关系数分别为0.854和0.697,未达到显著水平。‘巴西蕉’和‘宝岛218’发病率与根际土细菌数量及放线菌数量呈显著负相关,但‘南天黄’发病率与根际细菌、放线菌数量的相关系数分别为-0.900和-0.711,未达到显著水平。
表2 接种病原菌孢子悬浮液后各品种香蕉发病率与可培养微生物之间相关性分析1)
Table 2 Correlation analysis between disease incidence and the amount of culturable microbial after inoculated with FocTR4

细菌Bacteria真菌Fungi放线菌Actinomycetes镰刀菌Fusarium‘巴西蕉’发病率‘Brazil’incidence-0.963*0.964*-0.986*0.969*‘宝岛218’发病率‘Formosana’incidence-0.925*0.854-0.901*0.901*‘南天黄’发病率‘Nantianhuang’incidence-0.9000.697-0.7110.935*
1) 表中数值为Pearson相关系数,*表示在t<0.05下达显著水平。 Data in the table means Pearson correlation,*means significant level at 0.05.
该结果表明,香蕉抗病品种在防御香蕉枯萎病方面除了影响土壤的微生物群落组成,香蕉体内应该存在相应的防御机制。
2.4 接种枯萎病菌对香蕉根系防御酶活性的影响
2.4.1 过氧化物酶(POD)活性的变化
不同抗性香蕉品种受到FocTR4侵染后,POD活性变化情况如图2所示。接种FocTR4后第3天各品种POD活性略下降,第3天到第6天均呈上升趋势,在第9天到第12天上升明显,抗病品种峰值始终高于‘巴西蕉’,且第6天‘南天黄’POD活性显著高于‘巴西蕉’,其余时间点抗、感病品种差异不显著。
2.4.2 多酚氧化酶、苯丙氨酸解氨酶活性变化
由图3可知,未接种FocTR4时,‘巴西蕉’PPO、PAL活性显著高于‘宝岛218’和‘南天黄’。从接种FocTR4后第6天开始,抗病品种PPO、PAL活性均大幅上升并达到峰值,第9天后两个抗病品种‘宝岛218’和‘南天黄’PPO、PAL活性均显著高于‘巴西蕉’,且‘巴西蕉’PPO活性先上升后下降,PAL活性一直呈下降趋势。‘宝岛218’、‘南天黄’PPO活性在第12天出现第2个峰值,分别为同期‘巴西蕉’的2.2和2.0倍,且分别为抗病品种接种前的15.6倍和34.6倍。

图2 接种FocTR4后不同香蕉品种过氧化物酶活性的变化Fig.2 Changes of POD activity in different banana cultivars after inoculation with FocTR4
2.4.3 几丁质酶、β-1,3-葡聚糖酶活性变化
由图4可知,接种FocTR4之前,各品种香蕉几丁质酶、β-1,3-葡聚糖酶活性均比较低,接种FocTR4后‘巴西蕉’几丁质酶、β-1,3-葡聚糖酶活性先降低后升高,其中几丁质酶在第9天达到最大值,为未接种时的2.3倍,随后其活性再次降低,到试验结束时其活性为20.93 U/mg FW。‘南天黄’几丁质酶活性在接种后只出现1次下降,整体呈现上升趋势,并且在接种后第12天其酶活性达到最大,为42.87 U/mg FW,为同期‘巴西蕉’的1.7倍,‘南天黄’接种前的3.1倍。除第9天外‘巴西蕉’酶活性都显著低于‘南天黄’,两个抗病品种几丁质酶活性始终高于‘巴西蕉’。相比于两个抗病品种,‘巴西蕉’β-1,3-葡聚糖酶活性变化幅度最小,‘宝岛218’和‘南天黄’在第3天之后β-1,3-葡聚糖酶活性迅速增加,且两个抗病品种β-1,3-葡聚糖酶活性始终高于感病品种‘巴西蕉’。‘宝岛218’、‘南天黄’接种后的β-1,3-葡聚糖酶活性最大值分别为165.78和167.69 U/mg FW,分别是接种前的2.9和3.1倍,而‘巴西蕉’接种后最大值为63.04 U/mg FW仅为接种前的1.7倍。

图3 接种FocTR4后不同香蕉品种多酚氧化酶、苯丙氨酸解氨酶活性的变化Fig.3 Changes of PPO and PAL activity in different banana cultivars after inoculation with FocTR4
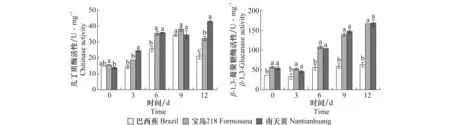
图4 接种FocTR4后不同香蕉品种几丁质酶、β-1,3-葡聚糖酶活性的变化Fig.4 Changes of chitinase and β-1,3-glucanase activity in different banana cultivars after inoculation with FocTR4
3 结论与讨论
香蕉枯萎病的发生受多种因素综合影响,植株本身的抗性、健康状况、土壤中病原菌数量及环境条件等都是影响香蕉枯萎病发病率高低的因素。本试验结果表明,虽然各品种香蕉发病率均随着试验处理中接种病原菌浓度的增加而升高,但在相同接种浓度下,抗病品种发病率显著低于感病品种‘巴西蕉’,并且各品种香蕉发病率均与根际土壤镰刀菌数量呈显著正相关关系。何欣等[11]的研究发现,致病菌孢子悬浮液浓度为103cfu/g土是香蕉枯萎病发病的临界浓度;当致病菌孢子悬浮液浓度不超过105cfu/g土时,香蕉枯萎病发病指数随着病原菌孢子悬浮液浓度的升高而增大;当致病菌孢子悬液浓度超过105cfu/g土时,香蕉枯萎病的病情指数不再显著变化。本试验中,105cfu/g土处理下,感病品种‘巴西蕉’几乎全部发病,已达到极端水平。为比较不同抗、感病香蕉品种在接种病原菌孢子悬浮液后的变化及试验相关性,采用0、103、104、105cfu/g土4个试验梯度进行比较,与何欣等人结论一致。Wang等[12]通过菠萝-香蕉两年轮作试验发现轮作在抑制香蕉枯萎病的同时显著降低了病原菌的丰度。Shen等[13-15]的研究发现,施用高浓度的微生物有机肥可以改变土壤的微生物区系结构,刺激有益微生物(如细菌,放线菌等)大量富集,从而显著提高细菌多样性,降低镰刀菌属的丰度,有效抑制枯萎病的发生。
过氧化物酶(POD)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)是植物体内重要的防御酶,几丁质酶和β-1,3-葡聚糖酶活性也与作物的抗性有一定的相关性。Akila等[16]的研究发现接种FocTR4后,香蕉发病率的降低与PPO、POD酶活性的增加正相关,Damodaran等[17]通过杂交育种选育出的抗性品种及其亲本的POD、PPO、PAL活性均高于感病品种,本试验中接种FocTR4后,抗病品种‘宝岛218’、‘南天黄’POD、PPO活性变化及数值均大于‘巴西蕉’,抗病品种在接种病原菌后期PAL酶活性显著高于感病品种;抗病品种的几丁质酶和β-1,3-葡聚糖酶活性增加量大于‘巴西蕉’,说明香蕉的抗性与植物体内这些防御酶的活性有密切关系。
本试验结果说明,与感病品种相比,抗性品种植物体内可能存在含有某种对抗病原菌的响应机制,例如:抗病分子机制、微生物区系群落结构改变及协同机制、生理机制等,以防御病原菌入侵。这些结果说明要解析抗病品种抗性机制,还要进行更深层次的研究,同时也提示我们,在生产上应用抗病品种时,要充分考虑土壤微生物的群落结构。
[1] 麦明晓, 黄惠琴, 鲍时翔. 香蕉镰刀菌枯萎病4号生理小种研究进展[J]. 中国生物防治, 2009, 25(S1): 73-77.
[2] Hwang S C, KO W H, Chao C P.GCTCV-215-1: A promising Cavendish clone resistant to race 4 ofFusariumoxysporumf.sp.cubense[J]. Plant Protection Bulletin Taibei,1994, 36(4):282-291.
[3] Butler D. Fungus threatens top banana[J]. Nature, 2013, 504: 195-196.
[4] 付琳, 阮云泽, 沈宗专, 等. 生物有机肥对连作香蕉根际土壤可培养细菌区系的影响[J]. 南京农业大学学报, 2012, 35(6): 82-88.
[5] Beibei Wang, Jun Yuan, Jian Zhang, et al. Effects of novel bioorganic fertilizer produced byBacillusamyloliquefaciensW19 on antagonism ofFusariumwilt of banana[J]. Biology and Fertility of Soils, 2012, 49: 435-446.
[6] Li W M, Dita M, Wu W, et al. Resistance sources toFusariumoxysporumf.sp.cubense, tropical race 4 in banana wild relatives [J]. Plant Pathology, 2015, 64(5):1061-1067.
[7] 胡莉莉. 香蕉抗枯萎病生理生化基础的研究[D]. 海口: 华南热带农业大学, 2006.
[8] 韩树全. 酚类物质抗香蕉枯萎病的作用机理[D]. 武汉: 华中农业大学, 2014.
[9] 李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 213-214.
[10]Fink W, Liefland M, Mendgen K. Chitinases and beta-1,3-glucanases in the apoplastic compartment of oat leaves (AvenasativaL.)[J]. Plant Physiology, 1988, 88(2):270-275.
[11]何欣, 黄启为, 杨兴明,等. 香蕉枯萎病致病菌筛选及致病菌浓度对香蕉枯萎病的影响[J]. 中国农业科学, 2010, 43(18):3809-3816.
[12]Wang Beibei, Li Rong, Ruan Yunze, et al. Pineapple-banana rotation reduced the amount ofFusariumoxysporum, more than maize-banana rotation mainly through modulating fungal communities [J]. Soil Biology & Biochemistry, 2015, 86: 77-86.
[13]Shen Zongzhuan, Wang Dongsheng, Ruan Yunze, et al. Deep 16S rRNA pyrosequencing reveals a bacterial community associated with bananaFusariumwilt disease suppression induced by bio-organic fertilizer application [J]. PLoS ONE, 2014, 9(5): 1-8.
[14]Shen Zongzhuan, Ruan Yunze, Chao Xue, et al. Rhizosphere microbial community manipulated by 2 years of consecutive biofertilizer application associated with bananaFusariumwilt disease suppression [J].Biology & Fertility of Soils,2015,51(5):553-562.
[15]Shen Zongzhuan, Ruan Yunze, Wang Beibei, et al. Effect of biofertilizer for suppressingFusarium, wilt disease of banana as well as enhancing microbial and chemical properties of soil under greenhouse trial[J]. Applied Soil Ecology, 2015, 93: 111-119.
[16]Akila R, Rajendran L, Harish S, et al. Combined application of botanical formulations and biocontrol agents for the management ofFusariumoxysporum, f.sp.cubense, (Foc) causingFusariumwilt in banana [J]. Biological Control, 2011, 57(3):175-183.
[17]Damodaran T, Kumar N, Kavino M. Breeding and evaluation of Musa hybrids resistant toFusariumoxysporumf.sp.cubenserace 1 [J]. Fruits, 2009, 64(1):3-12.
(责任编辑:田 喆)
The effects and mechanisms of different banana varieties toFusariumwilt disease
Ju Hongling1, Zhang Man1, Ruan Yunze1, Zhao Yan1, Deng Yan1, Yin Liyan1, He Chaozu2, Wang Beibei1
(1.CollegeofAgriculture,HainanUniversity,Haikou570228,China; 2.HainanKeyLaboratoryforSustainableUtilizationofTropicalBio-resources,Haikou570228,China)
In this study, three varieties of banana were used for investigate theFusariumwilt disease incidence, rhizospheric microorganism and defense enzymes activities after inoculated with FocTR4. The results showed that:Fusariumwilt disease incidence were increased when inoculated with high level of FocTR4, however, the disease incidence of disease-resistant varieties(RV) were lower than disease-sensitive variety(SV) significantly when inoculated with the same level of FocTR4. The amount ofFusariumin rhizospheric soil was significant positive correlated with disease incidence in all cultivated varieties. The defense enzymes activities such as POD, chitinase andβ-1,3-glucanase in RV were higher than SV, and certain correlation between disease resistance and PPO as well as PAL activity. All results showed that the mechanism of different resistance of banana varieties toFusariumwilt disease was related to the rhizospheric microorganisms and defense enzymes activities.
Fusariumwilt;Fusariumoxysporumf.sp.cubense; disease incidence; rhizospheric microorganisms; defense enzymes
2016-08-22
2016-09-27
国家重点基础研究发展计划(2015CB1505003);中央财政支持中西部高校提升综合实力专项(ZDZX2013023)
S 436.681
A
10.3969/j.issn.0529-1542.2017.02.013
* 通信作者 E-mail:wangbeiebi1987@163.com

