Wnt因子联合BMP-7诱导BMSCs向成骨分化的研究
阿勒泰别克·闹乎旦,张玉玲,白广超,金洪亮,李宽新*
(1新疆兵团医院关节脊柱外科,新疆 乌鲁木齐 832000;2新疆兵团医院教学科,新疆 乌鲁木齐 830000)
Wnt因子联合BMP-7诱导BMSCs向成骨分化的研究
阿勒泰别克·闹乎旦1,张玉玲2,白广超1,金洪亮1,李宽新1*
(1新疆兵团医院关节脊柱外科,新疆 乌鲁木齐 832000;2新疆兵团医院教学科,新疆 乌鲁木齐 830000)
为了观察Wnt联合BMP诱导骨髓间充质干细胞向成骨方向分化是否具有协同作用,本研究以密度梯度离心联合贴壁法分离培养骨髓间充质干细胞;实验分组为:对照组、Wnt组、BMP-7组、Wnt和BMP-7联合诱导组;以CCK-8法检测细胞的增殖活性;定量测定碱性磷酸酶(ALP)活性;以RT-PCR技术检测特异成骨转录因子的表达情况;使Von Kossa染色法观察细胞内矿化沉积程度。结果显示:以CKK-8法测培养第7天时联合组吸光度值为0.847,Wnt组为0.739,均明显高于对照组0.408,差异具有显著性(P<0.05);联合诱导组的ALP活性比值在培养第6天和第12天时分别为63.9和144.4,BMP-7组分别为40.9和104.2,均明显高于对照组的7.2和18.8,差异具有统计学意义(P<0.05);培养14 d后,OCN、β-Catenin的相对灰度值联合组高于对照组,差异具有统计学意义(P< 0.05),而Runx2及Osterix的表达量各组间差异无统计学意义;培养3周后,以Von Kossa染色后观察到钙结节在大小和数量上联合组均大于对照组。由此可知,Wnt3a因子和BMP-7联合可促进骨髓间充质干细胞的成骨分化,且两者具有协同作用。
Wnt3a;BMP-7;骨髓间充质干细胞;成骨分化
研究认为成骨细胞(Osteoblast)、破骨细胞(Osteoclasts)及多种生长因子共同参与完成了骨的形成、代谢及修复再生,而具有持续成骨能力的细胞是维持这一动态平衡的关键性因素[1]。骨髓间充质干细胞(bone mesenchymal stem cells)的增殖及定向分化是一复杂的过程,各种激素、生长因子都参与其中,Wnt/β-catenin及BMP信号通路在该过程中发挥了重要的作用。
在很多的生物学行为例如干细胞的增殖分化、胚胎发育、癌的发生中,Wnt和BMP信号通路的表达在空间和时间节奏上相互影响,这表明两种信号途径间存在交联关系(crosslinked relations)。骨形态发生蛋白(bone morphogenetic protein)是 TGF-β 超家族的一员。BMP-7是BMP家族中成骨作用最强的生长因子,其调节骨与软骨再生的方式为结合骨形成蛋白受体进而激活Smads/Runx2/Osterix和P38MAPKS通路途径。BMP-7信号下游序列中存在两个特异性的成骨转录因子,分别为Runx2与Osterix,前者在干细胞定向分化的起始阶段发挥重要作用,而后者则在终末阶段发挥作用,它们可调节碱性磷酸酶(alkaline phosphatase)、Ⅰ型胶原、骨桥素(Osteopontin)、骨钙素(Osteocalcin)等的表达,这些均为成骨细胞的标志物。
目前,大量的研究表明BMP和Wnt蛋白都可以通过各自的信号通路调节干细胞的分化[1],但作为单一的成骨诱导因子时,诱导效果并不理想,故我们考虑在本实验中把Wnt3a与BMP-7联合起来进行干细胞的诱导,以观察两种因子诱导BMSCs向成骨分化时是否具有协同作用,进而初步探讨两种通路之间的联系。
1 材料与方法
1.1 实验动物
SD大鼠15只,不限雌雄,体重(100± 20)g,由石河子大学医学院实验动物中心提供。
1.2 骨髓间充质干细胞 (BMSCs)的分离、纯化、培养
取大鼠,进行称重,记录完毕后以颈椎脱臼法处死大鼠,放入75%酒精中浸泡消毒5 min,分离出胫骨及腓骨,放入PBS内浸泡,移入超净台内。以组织剪去除股骨及胫骨两端,露出骨髓腔,以2.5 mL注射器抽取培养液(含10%FBS的DMEM/F12培养基)反复冲洗髓腔直至呈现透明。冲洗液以1200 r/min速度离心7 min后去上清,加入培养液重悬后 用计数板计数,调整密度为1×107/mL接种于25 cm2的培养瓶中,放入培养箱中,设置参数为37℃、5% CO2进行培养。每三天全换液,当瓶底被贴壁细胞爬满时,用0.25%胰蛋白酶按1∶2进行传代培养。
1.3 骨髓间充质干细胞(BMSCs)的体外诱导分化
取第3代细胞调整密度为1×107/mL种植于6 cm培养皿中,待培养皿底被贴壁细胞覆盖达80% -90%时,加入成骨诱导剂,继续在常规条件下培养。按诱导剂不同分为 4组:Wnt3a组(100 ng/mL)、BMP-7组(100ng/mL)、联合诱导组(Wnt3a100 ng/mL+BMP-7100 ng/mL)以及对照组(不加入任何诱导剂)。
1.4 CCK-8法检测细胞增殖
每组细胞诱导培养的第1、3、7、10天加入0.25%胰蛋白酶进行消化,把制成的单细胞悬液接种于96孔板中(每孔加入100 μL,细胞数量约为2×103),随后每孔加入CCK-8工作液10 μL进行2 h的孵育,使用酶标仪测定各组细胞悬液450 nm处的吸光度(OD值)。每个时间点设6个复孔,重复该实验3次,最后汇总每次测得的OD值,取其平均值。
1.5 定量测定ALP活性
调节各组细胞密度为3×104/mL接种于6孔板中进行诱导培养,分别于培养的第6天和第12天进行PBS漂洗 ,随后每孔加入0.5%Triton500 μL,置于4℃中12 h,期间于-20℃和20℃之间反复冻融3次,然后置于EP管中,随后把30 μL细胞裂解液、0.5 mL缓冲液和0.5 mL基质液依次加入到EP管中,混匀后进行37℃水浴15 min,每管中加入1.5 mL显色剂后使用分光光度仪测其在490 nm下的吸光度,再取2 μL细胞裂解液应用BCA试剂盒测各样品总蛋白浓度,使用下述公式计算ALP活性比值并与ALP标准曲线对比,作柱状图。
细胞碱性磷酸酶(ALP)活性(U/gprot)=测定管吸光度/标准管吸光度×标准管含酚量÷样品中蛋白克数
1.6 逆转录聚合酶链反应(RT-PCR)
(1)细胞总RNA的抽提:1)在各组细胞进行诱导培养的第14天时,把1 mL Trizol加入到每个培养瓶中以裂解细胞,随后移入1.5 mL EP管中,置于-20℃保存。2)两相分离 细胞裂解充分后放置冰上约5 min,把0.2 mL的氯仿加入EP管后剧烈振荡15 s,在室温下孵育3 min后放入离心机,4℃下12000 r/min离心15 min,去除沉淀后可见混合液体分三层:下层为红色,上层及中间层为无色水相,RNA全部分配于上层中。3)RNA沉淀 抽取0.3 mL的上层液体及等体积的异丙醇放入一离心管中,混匀后在室温下孵育10 min,随后放入离心机中在4℃下12000 r/min离心10 min,得到的沉淀物即为RNA。4)RNA清洗 移除上清液,加入1 mL的75%乙醇,放入离心机中在4℃下8000 r/min离心5 min后弃上清液。5)RNA干燥 多余液体去除后,放在室温空气中晾干RNA沉淀。6)加入30 μL消毒的DEPC水反复吹打直至沉淀完全溶解,置于-80℃保存。
(2)RNA样品的浓度检测:应用紫外分光光度仪(UV spectrophotometer)测定 A260/A280值并计算RNA浓度,其比值范围应为1.8-2.1。
(3)样品cDNA的合成:1)RNA的热变性:取1 μg总RNA,加入随机引物(Random primer)、Oligo(dT) 20、去离子水于65℃热变性5 min,随后置于冰上以进一步操作。2)逆转录:加入2 μL的dNTP Mixture、4 μL的5×Buffer、l μL的逆转录酶(RT-Ace)及1 μL的RNA酶抑制剂直至体积为20 μL。在42℃下反应20 min后瞬间离心即得到cDNA,混匀后置入PCR仪中,在37℃下孵育5 min。3)扩增:取各组cDNA 1 μL分别加入12.5 μL的2×PCR TaqMix、上/下游引物(10 μmol/L)各1 μL,最后加入超纯水直至体积为25 μL。第一步:94℃预变性3 min;第二步:94℃变性1 min;第三步:55℃退火30 s;第四步:72℃延伸30 s。重复第2-4步30次,最后进行72℃延伸10 min。以β-actin为内参。每组cDNA样本重复3次,各组PCR产物用2.0%琼脂糖凝胶进行电泳,应用凝胶成像系统分析软件(Gel imaging analysis system)照相并对各电泳条带吸光灰度值进行分析,引物见表1。

表 1 引物序列及产物大小Tab.1 Primer sequences and their product sizes
1.7 VonKossa染色
调节各组细胞密度至2×104/mL后接种于12孔板中,诱导培养3周后可见皿底形成半透明结节样物质。依次加入去离子水、4%多聚甲醛、1%硝酸银,室温下孵育2 min,去除多余液体后在紫外灯下暴露1 h,随后用去离子水清洗后在空气中晾干,5%硫代硫酸钠染色2 min,1%中性红复染10 min,去离子水漂洗后观察。
1.8 统计学分析
采用SPSS 13.0统计软件包对数据进行统计学分析,样本均数间的比较采用单因素方差分析,P< 0.05认为差异有统计学意义。
2 结果与分析
2.1 BMSCs形态学
使用倒置相差显微镜 (Inverted phase contrast microscope)观察培养不同时间点下骨髓间充质干细胞的形态:刚接种时BMSCs呈球形悬浮,培养12 h后部分贴壁,72 h后可完全贴壁,培养7 d左右细胞体积变大,布满瓶底,为长梭形。传代培养(Subculture)后细胞贴壁加速,细胞形态向多角形转化(图1)。

图1 倒置相差显微镜下观察BMSCs形态(×100)Fig.1 The BMSCs morphology observed by inverted phase contrast microscope
2.2 细胞增殖能力测定
以CCK-8法测定各组细胞各时间点的吸光度值可发现:BMSCs在接种后的第3天进入对数生长期(Logarithmic growth phase),第7天达高峰,随后进入平台期。第7天时联合组(0.847)>对照组(0.408),差异有统计学意义(P<0.05)(图2)。
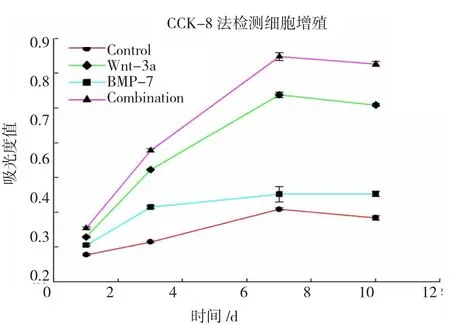
图2 各组BMSCs增殖曲线Fig.2 BMSCs proliferation curves of each group
2.3 细胞碱性磷酸酶活性测定
碱性磷酸酶(ALP)是早期成骨细胞的重要标志之一,分别在诱导培养的第6天和12天定量测定各组细胞的ALP活性。培养第6天时:联合组(63.9) >BMP-7组 (40.9)>对照组 (7.2),差异具有显著性(P<0.05);培养第12天时:联合组(144.4)>BMP-7组(104.2)>对照组 (18.8),差异具有显著性(P<0.05)(图3)。

图3 各组BMSCs碱性磷酸酶活性Fig.3 BMSCs alkaline phosphatase activities in each group
2.4 RT-PCR
诱导培养14 d后,用 RT-PCR技术检测OCN、 β-Catenin及Runx2、Osterix的表达情况。结果表明,OCN、β-Catenin的相对灰度值联合组高于对照组,差异具有显著性(P<0.05),而Runx2及Osterix的表达量各组间差异无统计学意义(图4)。

图4 各组细胞诱导培养14 d后检测成骨分化相关基因表达情况Fig.4 The expressions of osteogenic differentiation related genes detected after 14 days of induction of cells in each group
2.5 矿化沉积
诱导培养3周后对各组细胞进行Von Kossa染色,然后镜下观察钙结节形成情况:在钙结节大小及数量上联合组>BMP-7组>Wnt3a组>对照组(表2)。由图5可知:接种第3d细胞基本贴壁,部分伸出伪足;培养第7 d细胞体积增大,长梭形,部分呈集落样生长;加入成骨诱导培养基诱导3 d后细胞形态趋于一致,向多角形转化。
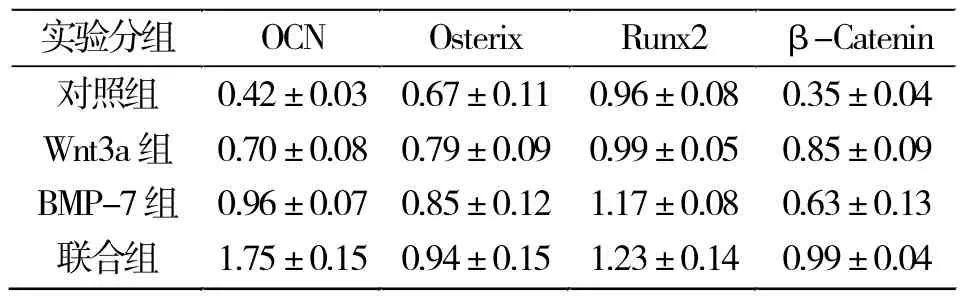
表2 各组电泳目标条带相对灰度值Tab.2 Relative gray value of electrophoresis target bands in each group

图5 各组BMSCs Von Kossa染色情况Fig.5 The observersion of BMSCs Von Kossa staining in each group
3 讨论
理想的种子细胞和成骨诱导剂(Osteogenic inducer)是构建组织工程最重要的两个因素。近年来的研究发现,骨髓间充质干细胞作为种子细胞具有诸多优势:扩增迅速、获取方便、多向分化潜能及免疫豁免(Immune privilege)等[2]。BMP及Wnt因子是目前研究较热门的两种成骨诱导剂,BMP信号通路在BMSCs的成骨诱导中发挥着重要的作用[3],除了目前已经用于临床治疗的BMP-2,BMP-7也被证实有较强的成骨活性。Wnt信号通路具有维持原始细胞和引导细胞成熟两方面的作用,有研究证实Wnt/β-catenin信号通路有诱导BMSCs向成骨细胞分化的能力[4]。本实验分别以BMP-7及Wnt3a作为诱导剂,结果同样证实了两种信号通路都具有诱导BMSCs的成骨分化能力。
研究证实BMP信号通路及Wnt/β-catenin信号通路均具有诱导BMSCs向成骨细胞分化的能力,故两种信号通路是否具有协同作用及进一步的机制是本实验的研究重点。研究中我们发现:联合诱导组ALP的表达量明显高于BMP-7单独诱导组,这表明Wnt3α增强了BMP-7诱导的早期成骨标志ALP的活性。Stewart S等[5]的研究发现BMP可以通过经典的Wnt信号通路调节ALP的表达,这与本实验的研究结果一致。但是,ALP是早期成骨的标志,并不能有力地证明BMSCs分化成为成熟的成骨细胞,所以我们又检测了反应成骨中晚期的指标:OCN及矿化沉积。结果发现:联合诱导组在OCN的表达量、钙结节数量及大小上均高于BMP-7诱导组。Liu D等[6]发现Wnt/β-catenin和BMP存在协同作用,可以上调OCN的表达及基质矿化的速度。另有研究表明,Wnt/β-catenin在间充质干细胞的成骨分化过程中主要起的是“稳定器”的作用,增强了间充质干细胞细胞膜对BMP的敏感性,保证干细胞分化过程的稳定进行[7]。以上这些研究都与本实验的研究结果相一致。但有些研究却得出Wnt3α与BMP联合后两种通路表现出相互抑制的结果[8-9],例如 Guerrero F等[10]在研究中发现BMP激活Smad 1后抑制dvl的表达,从而抑制了Wnt通路的成骨诱导作用。但是本实验的结果支持Wnt3α增强BMP-7成骨诱导分化能力,造成这种差异性,笔者做出以下推断:选择的实验细胞的差异;检测时间点的差异造成得出的结论相差甚至完全相反。在本实验中我们证实:Wnt3α联合BMP-7具有非凡的成骨诱导能力,这给干细胞移植治疗骨缺损等疾病提供了另一种思路。但是,Wnt3α与BMP-7涉及两种完全不同的通路,其协同机制还需进一步阐明。
为了进一步研究Wnt/β-catenin与BMP两种通路的相互交联机制,我们用RT-PCR技术检测了Runx2基因的表达量,Runx2是BMP-7信号下游序列中具有特异性的成骨转录因子,结果发现联合诱导组的表达量和单独诱导组并无差异。这和张晓等[11]的研究结果相反,其在研究中联合 Wnt3α 与BMP-9对BMSCs进行诱导,结果得到联合组Runx2的表达量明显高于单独诱导组,故其认为Runx2是Wnt/β-catenin和BMP通路的“交汇点”。本实验中结果表明联合诱导组和单独诱导组Runx2的表达量无明显差异,不能说明Runx2是两种通路的“交汇点”,这和 D’Alimonte I[12]及 Jing Jian[13]等人的研究结论相一致。对此,笔者认为:Wnt/β-catenin和BMP两种通路作用在BMSCs成骨分化的不同阶段,两种通路的相互影响具有时间特异性。有部分学者认为两种通路的相互影响还具有空间特异性,例如Su X[14]、Liou S F[15]、Li J[16]等人在研究中发现Wnt控制矢状轴部位的组织再生,而BMP主要控制中线轴部位的组织再生。因此,Wnt/β-catenin与BMP两种信号通路的相互作用机制十分复杂,这种复杂的分子机制还需要进一步实验阐明。
Wnt因子和 BMP均对骨髓间充质干细胞(BMSCs)的成骨分化具有促进作用,本实验尝试性的将Wnt3a与BMP-7联合进行干预并初步探索Wnt与BMP信号通路之间的联系。本研究结果表明:Wnt3a联合BMP-7诱导BMSCs的成骨分化优于单独诱导剂的诱导效果,为间充质干细胞的成骨诱导探索了一条新途径,但其复杂的机制尚未完全完全揭示,需要更进一步的研究。
[1]Rahman M S,Akhtar N,Jamil H M,et al.TGF-b/BMP signaling and other molecular events:regulation of osteoblastogenesis and bone formation[J].Bone Res,2015,3(1):11-30.
[2]Huang R L,Yuan Y,Tu J,et al.Opposing TNF-α/IL-1βand BMP-2-activated MAPK signaling pathways converge on Runx2 to regulate BMP-2-induced osteoblastic differentiation[J].Cell Death&Disease,2014,5(4):1187-1187.
[3]Dong M,Jiao G,Liu H,et al.Biological silicon stimulates collagen type 1 and osteocalcin synthesis in human osteoblast-Like cells through the BMP-2/Smad/RUNX2 signaling pathway[J].Biological Trace Element Research,2016,3(2): 1-10.
[4]Zhang F,Ren T,Wu J,et al.Small concentrations of TGF-β1 promote proliferation of bone marrow-derived mesenchymal stem cells via activation of Wnt/β-catenin pathway [J].Indian Journal of Experimental Biology,2015,53(8):508 -513.
[5]Stewart S,Gomez A,Armstrong B,et al.Sequential and opposing activities of wnt and BMP coordinate zebrafish bone regeneration[J].Cell Reports,2011,6(3):482-98.
[6]Liu D,Zhang J,Zhang Q,et al.TGF-β/BMP signaling pathway is involved in cerium-promoted osteogenic differentiation of mesenchymal stem cells[J].Journal of Cellular Biochemistry,2013,114(5):1105-1114.
[7]Tu X,Delgado Calle J,Condon K W,et al.Osteocytes mediate the anabolic actions of canonical Wnt/β-catenin signaling in bone.[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(5): 478-486.
[8]Tao K,Xiao D,Weng J,et al.Berberine promotes bone marrow-derived mesenchymal stem cells osteogenic differentiation via canonical Wnt/β-catenin signaling pathway[J]. Toxicology Letters,2015,240(1):68-80.
[9]Miao C G,Yang Y Y,He X,et al.Wnt signaling pathway in rheumatoid arthritis,with special emphasis on the different roles in synovial inflammation and bone remodeling [J].Cellular Signalling,2013,25(10):2069-2078.
[10]Guerrero F,Herencia C,Almadén Y,et al.TGF-β prevents phosphate-induced osteogenesis through inhibition of BMP and Wnt/β-catenin pathways.[J].Plos One,2014,9 (2):89179-89179.
[11]张晓,徐道晶,林良波,等.Wnt3a协同BMP9调控间充质干细胞成骨分化及机制研究[J].重庆医科大学学报,2012,37(7):565-569. Zhang X,Xu D J,Lin L B,et al.Mechanism of osteogentic differentiation for mesenchymal stem cells induced by BMP9 and Wnt3a in vitro[J].Journal of chongqing Medical University,2012,37(7):565-569.
[12]D’Alimonte I,Lannutti A,Pipino C,et al.Wnt signaling behaves as a‘Master regulator'in the osteogenic and adipogenic commitment of human amniotic fluid mesenchymal stem cells[J].Stem Cell Reviews,2013,9(5):642-654.
[13]Jing Jian,Lijuan Sun,Xun Cheng,et al.Calycosin-7-O-β -d-glucopyranoside stimulates osteoblast differentiation through regulating the BMP/WNT signaling pathways[J].Acta Pharmaceutica Sinica B,2015,5(5):454-460.
[14]Su X,Liao L,Shuai Y,et al.MiR-26a functions oppositely in osteogenic differentiation of BMSCs and ADSCs depending on distinct activation and roles of Wnt and BMP signaling pathway[J].Cell Death&Disease,2015,6(8):25-28.
[15]Liou S F,Hsu J H,Chu H C,et al.KMUP-1 promotes osteoblast differentiation through cAMP and cGMP pathways and signaling of BMP-2/Smad1/5/8 and Wnt/β-catenin[J]. Journal of Cellular Physiology,2014,230(9):2038-2048.
[16]Li J,Hao L,Wu J,et al.Linarin promotes osteogenic differentiation by activating the BMP-2/RUNX2 pathway via protein kinase A signaling[J].International Journal of Molecular Medicine,2016,37(4):901-910.
Study on induction of bone marrow mesenchymal stem cells into osteoblasts by combination of Wnt factor and BMP-7
Aletaibieke Naohudan1,Zhang Yuling2,Bai Guangchao1,Jin Hongliang1,Li Kuanxin1*
(1 Department of Joint and Spinal,Xinjiang Production and Construction Corps Hospital,Urumqi,Xinjiang 830000,China; 2 Department of Science and Education,Xinjiang Production and Construction Corps Hospital,
Urumqi,Xinjiang 830000,China)
To observe the synergistic effect of Wnt combined with BMP on osteogenic differentiation of bone marrow mesenchymal stem cells,isolated culture was performed on MSCs by density-gradient centrifugation combined with adherence method.The control group,Wnt group,BMP-7 group,Wnt-BMP-7 combined induction group were defined.The cell proliferative activity was detected by CCK-8 method.The ALP activity was detected quantitatively.The expression levels of the osteoblast-specific transcription factors were detected by RT-PCR.The degree of intracellular mineral deposition was observed by VonKossa staining method.The results showed that the light absorbance at 7 days of culture with CKK-8 method was 0.847 in the combined induction group and 0.739 in the Wnt group,both of which were significantly higher than 0.408 in the control group(P<0.05); the ALP activity ratios at 6 and 12 days of culture was 63.9 and 144.4,respectively in the combined induction group,and 40.9 and 104.2,respectively in the BMP-7 group,which were all significantly higher than 7.2 and 18.8,respectively in the control group (P<0.05);at 14 days,the relative gray values of OCN and β-Catenin were higher in the combined induction group than in the control group(P<0.05),while there was no statistically significant difference in the expression levels of Runx2 and Osterixacross the groups;at 3 weeks of culture,both the size and number of calcium nodules observed following VonKossa staining were greater in the combined induction group than in the control group.The conclusion is that combination of Wnt3a and BMP-7 has synergistic action in promoting differentiation of MSCs into osteoblasts.
Wnt3a;BMP-7;marrow mesenchymal stem cells;osteogenesis
R285
A
10.13880/j.cnki.65-1174/n.2017.01.019
1007-7383(2017)01-0113-06
2016-10-26
新疆兵团卫生科技计划项目(WSJ201406)
阿勒泰别克.闹乎旦(1968-),男,副主任医师,从事关节脊柱外科研究。
*通信作者:李宽新(1969-),男,主任医师,从事关节脊柱外科学研究,e-mail:likuanxin@sohu.com。

