单增李斯特菌与细胞自噬
管成康+管帅
摘 要:单增李斯特菌感染机体后在多种毒力因子的作用下可致李斯特病的发生。为了抵御LM的感染,在感染初期宿主细胞启动自噬系统抑制LM的增殖,细胞自噬的过程是在自噬相关蛋白的作用下完成的,LM诱导的自噬与LM的溶血素O和宿主细胞的NOD1有关。靶向LM的自噬至少有2种途径:一种是细菌成分LLO和Ub-p62-LC3,另一种是识别细菌的侵入过程路径NOD1-Atg16L-LC3。一旦LM在细胞质中开始增殖,在磷脂酶A和肌动蛋白A的作用下就可以逃脱自噬。
关键词:单增李斯特菌;细胞自噬;溶血素O;宿主细胞
中图分类号:R392 文献标识码:A DOI:10.15913/j.cnki.kjycx.2016.22.024
产单核细胞李斯特菌(Lisetria monocytogenes,LM)简称“单增李斯特菌”,是李斯特氏菌属的最重要病原菌, 人兽共患李斯特菌,属于细胞内寄生的革兰氏阳性杆菌,主要通过食用被LM污染的食品感染,比如未经高温消毒的乳制品和未煮熟的肉类,引发人的脑膜炎、发热性败血性胃肠炎、孕妇母婴和围产期感染。为了抵御LM的感染,宿主细胞启动先天免疫系统防御,细胞自噬就是其中的一道防线。
1 LM的致病过程和毒力因子
单增李斯特菌的致病过程是在多种毒力因子的作用下完成的,毒力因子主要包括内化素、溶血素O、磷脂酰肌醇特异性磷脂酶和肌动蛋白聚合蛋白A(Actin polymerzing protein A,ActA)等。致病过程可分为4个阶段:内化(入侵)、逃离吞噬泡、增殖和细胞间传播。在内化过程中,菌体表面蛋白内化素与宿主细胞膜受体结合并相互作用,引发细胞膜对菌体的渐进包裹陷入到细胞内,形成吞噬泡,从而完成入侵过程。为了避免被吞噬泡中的酶溶解,LM会通过李斯特菌溶血素O(Listerialisin O,LLO)和磷脂酰肌醇特异性磷脂酶的裂解作用,溶解吞噬体膜,逃逸吞噬泡进入到宿主细胞的细胞质中,并在细胞质中快速增殖,同时细菌依赖自身的ActA形成彗星式的尾巴推动菌体向细胞膜移动,使细胞膜形成突起,再被临近细胞内吞,从而完成细胞间的传播。图1为LM感染的过程。
2 细胞自噬
2.1 细胞自噬的概述
细胞自噬是细胞在外界环境因素(比如饥饿、低氧和微生物感染等)的影响下,对细胞内受损的细胞器、错误折叠的蛋白质或病原微生物进行降解的生物过程。细胞通过自噬可保护
其自身免受病原微生物的感染,重新获得所必需的氨基酸、脂肪酸和核酸等营养物质,维持细胞内环境稳定和代谢平衡,从而使细胞在不利的生存条件下得以生存。如果细胞自噬出现紊乱,就可能会导致疾病的发生。
2.2 细胞自噬的方式和过程
哺乳动物的细胞自噬可分为3种主要方式:大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)。大自噬是指由内质网来源的膜包绕待降解物形成自噬体,然后与溶酶体融合并降解其内容物;小自噬是指溶酶体的膜直接包裹长寿命蛋白等,并在溶酶体内降解;分子伴侣介导的自噬是指细胞质内蛋白与分子伴侣结合后被转运到溶酶体腔中,然后被溶酶体酶消化。
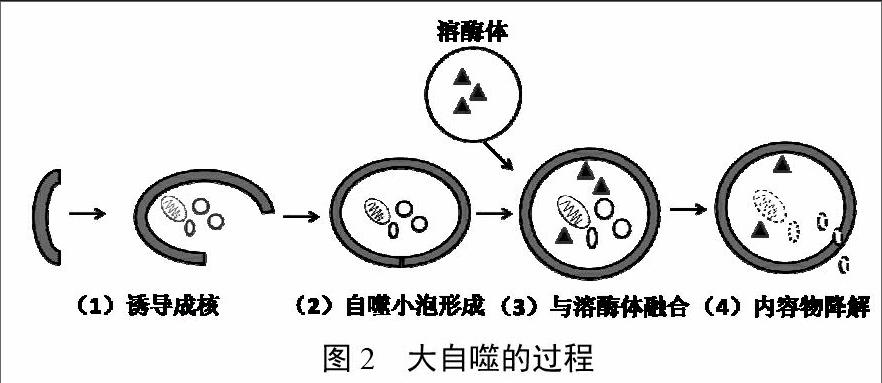
我们经常提到的自噬是指大自噬,其基本过程可分为4步:①诱导成核。在外界环境刺激下,内质网膜凹陷形成双层膜结构,把受损的细胞器或错误折叠的蛋白质包围。②自噬小泡形成。在自噬相关蛋白(Autophagy-related,Atg)5,8,12和磷脂酰乙醇胺/微管相关蛋白1轻链3(microtubule-associated Protein 1 light chain 3,LC3)II的参与下,双层膜结构不断延伸,最终完全包裹内容物,形成自噬小泡。③与溶酶体融合。成熟的自噬体在Atg2、Atg9及Atgl8的参与下与溶酶体融合形成自噬溶酶体。④内容物降解。在溶酶体的作用下,自噬性溶酶体中内容物被降解成小分子物质并释放到细胞质中被细胞重新利用。图2为大自噬的过程。
3 LM感染过程中的细胞自噬及逃避
3.1 LM诱导的自噬
自噬被认为是抵抗细胞内微生物免疫反应的一部分,被看作机体抵御病原入侵的第二道防线,主要是通过包裹病原微生物形成吞噬体后与溶酶体融合,利用溶酶体中的酶对病原体进行降解。但是,有一些病原体能够通过特定的机制阻止吞噬体和溶酶体的融合,从而逃避溶酶体中酶的溶解继续生存和增殖,其中,LM就被认为是可以逃离自体吞噬细胞的病原体。
最新研究表明,LM感染宿主细胞后可诱发自噬反应,抑制野生型和DactA突变株的生长,破坏LM在细胞与细胞间的传播,在自噬缺陷的细胞内,感染早期LM生长加剧。一旦在细胞溶质中开始增殖,细菌的增长率就不再改变,而且在感染早期伴随着自噬细胞内的细菌出现区域化。因此,在LM感染初期(包括细菌的内化、打孔溶解吞噬泡和细菌释放进入细胞质),靶向LM的自噬限制早期细菌的生长。
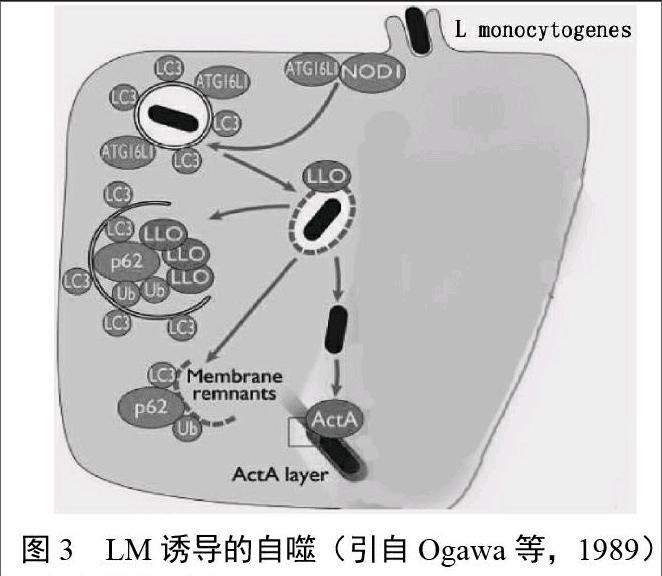
自噬对抗病原的路径包括Atg/LC3路径、Ub-NDP52-LC3路径、Ub-p62-LC3路径以及NOD1/NOD2-Atg16L-LC3路径。关于LM诱导细胞自噬路径的研究,Meyer-Morse 等证实,在LM诱导宿主细胞发生自噬的过程中,自噬的誘导依赖LLO的表达,LLO破坏的囊泡膜的残余物足以诱导自噬;Travassos等使用小鼠成纤维细胞证实,NOD1和ATG16招募到LM进入到质膜的位置,LC3的阳性水平在NOD-/-小鼠胚胎成纤维细胞中远低于在NOD+/+的成纤维细胞中,由于LLO缺陷的LM在NOD+/+和NOD-/-的细胞中都不能用LC3装饰,提示NOD1和自噬路径间存在着功能上的联系。在这个联系中,LLO破坏的质膜成为自噬的靶点。这些结果提示靶向LM的自噬至少有两2途径:一种是细菌成分LLO和Ub-p62-LC3,另一种是识别细菌的侵入过程路径NOD1-Atg16L-LC3。图3所示为LM诱导的自噬。
3.2 LM逃避自噬的路径
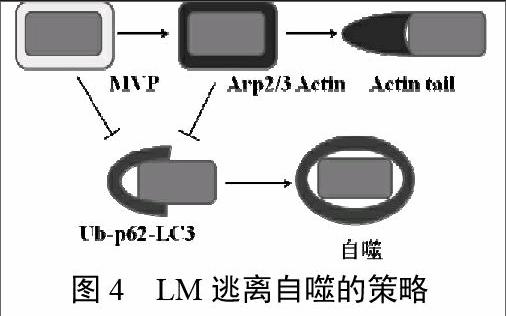
LM避免自噬主要涉及到PlcA和ActA,并且这些因子的每一个对于LM在巨噬细胞中生长都可能存在,PlcA阻止了LC3脂肪化,推测是通过阻止PI3P的形成来发挥作用的。ActA在自噬逃脱中起重要作用,内化蛋白Inlk与穹窿体主蛋白(major vault protein,MVP)一起装饰细菌表面来逃脱自噬的识别,Ink-MVP相互作用和肌动蛋白聚合是同一路径的两个过程:Inlk可招募MVP到细菌表面,随后ActA替代Inlk,actin替代MVP来装饰细菌阻止泛素蛋白(Ub)的招募/形成,p62的识别和LC3的招募。图4为LM逃离自噬的策略。
4 结束语
LM在感染宿主细胞过程中,其致病过程是由多种毒力因子共同发挥作用,同时在毒力因子LLO的作用下,宿主细胞通过不用路径在感染初期通过自噬对LM进行防御。一旦在细胞质中开始增殖,LM通过毒力因子PlcA和ActA的作用来逃脱自噬。虽然已经发现LM诱导的细胞自噬的2条路径和与LM逃脱自噬有关的2个毒力因子,但是LM诱导自噬的其他路径及逃脱自噬的机理目前还不十分清楚,这也是以后科研工作者努力的方向。
参考文献
[1]李文艳,董明倩,王亚光,等.单增李斯特菌感染过程中炎性体激活的研究进展[J].微生物学通报,2016(3):634-639.
[2]Tilney L G,Portnoy D A.Actin filaments and the growth,movement and spread of the intracellular bacterial parasite,Listeria monocytogenes.The Journal of cell biology,1989,109(4):1597-1608.
[3]叶青,郑民华.自噬的分子机制与病理生理意义[J].临床与病理杂志,2007,27(4):358-362.
[4]何耀东.对虾miR-71介导的自噬及白斑综合症病毒(WSSV)编码的miRNA在病毒感染中的作用[D].杭州:浙江大学,2014.
[5]Py B F,Lipinski M M,Yuan J.Autophagy limits Listeria monocytogenes intracellular growth in the early phase of primary infection.Autophagy,2007,3(2):117-125.
[6]Meyer-Morse N,Robbins J R,Rae C S,et al.Listeriolysin O is necessary and sufficient to induce autophagy during Listeria monocytogenes infection.Plos One,2010,5(1):8610.
[7]Travassos LH,Carneiro LA,Ramjeet M,et al.Nod1 and Nod2 direct autophagy by recruiting ATG16L1 to the plasma membrane at the site of bacterial entry.Natual Immunology,2010,11(11):55-62.
[8]Mitchell G,Ge L,Huang Q,et al.Avoidance of autophagy mediated by PlcA or ActA is required for Listeria monocytogenes growth in macrophages.Infection & Immunity,2015,83(5):2175-2184.
[9]Tattoli I,Sorbara M T,Yang C,et al.Listeria, phospholipases subvert host autophagic defenses by stalling pre-autophagosomal structures.Embo Journal,2013,32(23):3066-3078.
[10]Dortet L,Mostowy S,Cossart P.Listeria and autophagy escape:Involvement of InlK,an internalin-like protein.Autophagy,2012,8(1):132-134.
〔編辑:刘晓芳〕

