糖尿病大鼠表皮组织表皮干细胞的β-catenin、Cyclin D1、Wnt-1、K6表达变化
李亚蓉,毛红,赵湜,周玲
(华中科技大学同济医学院附属武汉中心医院,武汉430014)
糖尿病大鼠表皮组织表皮干细胞的β-catenin、Cyclin D1、Wnt-1、K6表达变化
李亚蓉,毛红,赵湜,周玲
(华中科技大学同济医学院附属武汉中心医院,武汉430014)
目的观察糖尿病(DM)大鼠表皮组织表皮干细胞(ESCs)中β-连环素(β-catenin)、周期蛋白D1(Cyclin D1)、Wnt通路蛋白1(Wnt-1)、细胞角蛋白K6表达变化,探讨DM大鼠ESCs结构和功能变化的机制。方法将30只大鼠随机分为观察组和对照组,各15例。观察组用链脲佐菌素法制作DM模型,对照组常规饲养。造模成功28 d后取两组大鼠表皮组织,分离ESCs,采用免疫组化SP法测算两组ESCs的β-catenin、Cyclin D1、Wnt-1、K6阳性表达率和β-catenin、Cyclin D1、Wnt-1、K6阳性染色积分光密度值(IA)。结果观察组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性表达率分别为15.07%、16.89%、15.51%、14.67%,对照组分别为72.04%、68.91%、65.08%、57.13%,两组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性表达率相比P均<0.05。观察组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性染色IA分别为74.41±6.17、68.25±5.79、31.67±6.09、60.54±26.72,对照组分别为117.34±10.05、109.45±7.67、72.42±7.98、125.54±30.14,两组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性染色IA相比P均<0.05。结论DM大鼠表皮组织ESCs中β-catenin、CyclinD1、Wnt-1、K6表达降低,这可能是DM大鼠ESCs结构和功能变化的机制。
糖尿病;表皮干细胞;β-连环素;周期蛋白D1;Wnt通路蛋白1;细胞角蛋白;动物实验
糖尿病(DM)患者的皮肤创伤面具有难愈合或不愈合的特点,治疗棘手[1]。表皮干细胞(ESCs)具有生成新皮肤及附属组织、修复创伤口、促进表皮良性异化的功能,是皮肤创伤愈合过程中的重要细胞[2,3]。DM患者表皮组织中ESCs结构发生变化,导致其功能降低,但其机制并不明确[4]。β-catenin是一种调节表皮ESCs分化的重要细胞因子,周期蛋白D1(Cyclin D1)、Wnt通路蛋白1(Wnt-1)、细胞角蛋白K6是其下游靶基因表达的蛋白[5]。DM大鼠表皮组织ESCs结构和功能的变化可能与β-catenin及其下游cyc1inD1、Wnt-1、K6表达变化有关。本研究观察了DM大鼠ESCs中β-catenin、cyc1inD1、Wnt-1、K6表达变化,探讨DM大鼠ESCs结构和功能变化的机制。现报告如下。
1 材料与方法
1.1 实验动物、主要试剂及仪器 30只实验SD雄性大鼠购自长沙市天勤生物技术有限公司,体质量300~360 g,实验前均于培养室内喂养7 d,饲养环境温度20~26 ℃,相对湿度50~60%。链脲佐菌素购自上海士锋生物科技有限公司,β-catenin、Cyclin D1、Wnt-1抗体试剂均购自美国圣克鲁斯生物技术公司,K6抗体购自上海拜力生物科技有限公司,免疫组织化学SP检测试剂盒购自北京中杉金桥公司,免疫组织化学试剂盒、DAB试剂盒、PBS、柠檬酸钠溶液均购自上海金标公司,K-SFM培养基、胎牛血清素购自英国Gibco公司,Ⅳ型胶原购自美国Sigma公司,免疫定量ELISA分析试剂盒购自美国R&D公司。BHC-1300IIA2超净无菌工作台购自苏州苏洁净化设备公司,GTR16-2高速离心机购自北京时代北利离心机有限公司,DM1000显微镜购自德国徕卡公司,奥林巴斯CX31数码图像系统购自日本奥林巴斯公司,KD-202A石蜡切片机购自西安金马医疗器械有限公司,稳步血糖测定仪购自美国强生公司。
1.2 大鼠分组及DM模型建立方法 将30只大鼠随机分为分为观察组及对照组,每组15只。观察组大鼠采用链脲佐菌素建立DM模型,具体方法如下[6]:大鼠腹部注射55~60 mg/kg链脲佐菌素溶液,正常喂食、喂水2 d后每日测血糖,连续3次血糖高于6.8 mmol/L且大鼠现饮食、饮水、排尿多但体型消瘦判定为造模成功。观察组均造模成功,然后继续饲养28 d。对照组大鼠常规饲养。
1.3 表皮组织ESCs分离方法 在无菌环境下用手术刀切取两组大鼠尾背部表皮,无菌碘液棉签擦净所取标本,生理盐水冲洗10 min,放置在超净工作台上[9],手术刀逐次清除多余结缔及皮下组织;放入无菌培养皿,分别青霉素G溶液1次×3 min、D-Hank′s溶液2次×3 min漂洗。切表皮标本约为0.5 cm×0.5 cm碎块,放入培养瓶内,加入5 mL的0.25~0.3%胰蛋白酶+EDTA溶液,放入4 ℃冰箱培养12 h。取出放入培养皿内,滴加约2 mL PBS,再次D-Hank′s 溶液2次漂洗3 min,后将标本表皮层剥离粉碎,放入无菌培养瓶内,再次D-Hank′s溶液吹打5~7次,标本混合筛网过滤,清液进入离心管,1 200 r/min离心5min。弃上清后作细胞悬液并计数细胞,将悬液滴入培养板于37 ℃、5%CO2、100%湿度中培养20 min,去培养液及未勃附细胞,滴入有ESCs培养液的培养皿,于37 ℃、5%CO2、100%湿度中培养,换液1次/3 d,直到约70%~80%ESCs细胞1∶3融合传代,弃培养液,PBS洗3次,滴0.25%胰蛋白酶+0.02%EDTA溶液调细胞溶液为悬浮状态,30 s内滴入10% 胎牛清血素,1 200 r/min离心5 min,去分离上层液,滴入K-SFM培养基,吹打、重悬后接种于培养瓶,去未贴壁细胞。
1.4 ESCs中β-catenin、Cyclin D1、Wnt-1、K6检测方法 采用免疫组化SP法。两组ESCs培养24 h后,取细胞密度1×105/mL培养液滴入玻片,PBS浸3次,每次 3 min,90%乙醇固定20 min,PBS浸3次,每次3 min,加0.5% 曲拉通X-100孵育15min,PBS浸3 次× 3 min/次,滴40 mL 3%H2O2阻断液,25 ℃条件下孵育10 min,PBS洗涤3 次× 3 min/次,滴50 μL一抗覆盖切片,入37 ℃水浴箱育30 min,PBS洗3次×3 min/次,滴二抗,PBS洗3次,2 min/次,DAB显色及苏木素复染,乙醇脱水干燥切片。Ⅳ型树胶封固。倒置相差显微镜下观察(400×),β-catenin阳性染色为细胞膜上棕黄色颗粒,cyclinD1阳性染色为细胞核棕黄色颗粒,K6和Wnt-1阳性染色为细胞质棕黄色颗粒。随机选取3个视野,每个视野计数1 000个细胞,计算β-catenin、Cyclin D1、Wnt-1、K6阳性表达率。对染色切片进行拍照,用奥林巴斯CX31数码图像分析系统测算β-catenin、Cyclin D1、Wnt-1、K6阳性染色积分光密度值(IA)。
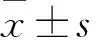
2 结果
观察组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性表达率分别为15.07%、16.89%、15.51%、14.67%,对照组分别为72.04%、68.91%、65.08%、57.13%,两组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性表达率相比P均<0.05。观察组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性染色IA分别为74.41±6.17、68.25±5.79、31.67±6.09、60.54±26.72,对照组分别为117.34±10.05、109.45±7.67、72.42±7.98、125.54±30.14,两组大鼠表皮组织ESCs中β-catenin、Cyclin D1、Wnt-1、K6阳性染色IA相比P均<0.05。
3 讨论
目前全球DM患者人数接近2.8亿,我国DM患者人数处于全球第二位[13,14],并呈现不断增多的态势,形势较为严峻。DM患者并发溃疡、创伤后创面难以愈合,致残率极高,给患者身体及心理带来极大痛苦[15,16]。DM患者皮肤创伤难以愈合的原因较为复杂。国内外众多研究显示,DM造成创伤难愈合的主要原因为:①DM会引起患者体内糖代谢功能障碍,造成体内糖基化物质浓度上升,破坏细胞膜结构,造成表皮细胞凋亡[17];②DM患者多伴发神经性病变,导致机体促表皮愈合神经信号传导受阻,造成人体正常对损伤自修复调节机制运转滞后,干扰正常的组织及皮肤自然性愈合[18];③DM可致患者生长因子受体异变及浓度下降,阻碍表皮细胞及皮下组织、肌肉组织细胞DNA合成[19],干扰正常构成新人体组织细胞的增殖,减慢新组织添补创伤口[20];④多数DM患者因病变及营养物质摄入量不足,自身免疫功能下降,故对侵入细菌抵抗力不足,可致创伤口感染,促使伤口脓化,进一步干扰表皮细胞更新增殖;⑤DM患者血运能力下降,造成表皮创伤口血液流量降低,造成创伤坏死。针对这些原因,有研究提出在促DM患者创伤愈合过程中,利用人体自然促表皮细胞增殖因子使得创面上皮化功能正常发挥,提高愈合效果,同时已有研究证明[21],DM大鼠表皮组织ESCs数量少、活性低。因此,我们认为ESCs结构变化导致的功能下降可能是导致DM患者创面难愈的一个重要因素。
有研究显示[22],β-catenin是一种调节表皮ESCs分化的重要因子,促进机体对创伤进行自然性修复,其通过和上表皮组织内ESCs内钙黏蛋白结合[23],促进细胞间黏合及和外基质链接,保证表皮结构完整性,激活Wnt通路[24],而Wnt-1和表皮组织生成、生长及愈合具有密切关系[25]。同时,β-catenin还可激活其下游靶基因CyclinD1,提高其表达水平,其可加快表皮细胞生长周期进阶速度,细胞增殖及分化关系较密切,加快表皮自修复进程。K6蛋白作为一种人体内促细胞增殖的角蛋白,其和细胞增殖关系较密切,有研究认为K6浓度水平与表皮细胞过度增殖具有显著的正相关性。本研究结果显示,观察组DM大鼠表皮组织ESCs中β-catenin、CyclinD1、Wnt-1、K6阳性表达率和阳性染色IA均低于对照组,说明DM大鼠表皮组织ESCs中β-catenin、CyclinD1、Wnt-1、K6表达降低。笔者推测这可能是导致DM大鼠表皮组织ESCs功能下降的原因。
[1] 史佩娜,高梦娜. 皮肤创伤修复机制及治疗方法研究进展[J]. 浙江医学,2014,10(15):1349-1353.
[2] 蔡黔,万江波,梁文佳. 转染血管内皮生长因子基因的骨髓间充质干细胞修复糖尿病大鼠足背创面[J].中国组织工程研究,2014,50(37):5988-5992.
[3] Yu JY, Ho RJ. Ovatodiolide Targets β-catenin Signaling in Suppressing Tumorigenesis and Overcoming Drug Resistance in Renal Cell Carcinoma[J]. CAM, 2013,2013(16):1616-1628.
[4] Simoneau N , Coulombe M. SHP-1 inhibits β-catenin function by inducing its degradation and interfering with its association with TATA-binding protein[J]. Cell Signal, 2011,23(1):269-279.
[5] Emanuela A, Rossano G. Correction:mTrop1/Epcam knockout mice develop congenital tufting enteropathy through dysregulation of intestinal E-cadherin/β-catenin[J]. PLoS One, 2013,8(5):245-249.
[6] Zhu PF, Liu YY. Silencing of pancreatic adenocarcinoma upregulated factor by RNA interference inhibits the malignant phenotypes of human colorectal cancer cells[J]. Oncol Rep, 2013,30(1):213-220.
[7] Luciana H, Patrcia O. MAPKs and Signal Transduction in the control of gastrointestinal epithelial cell proliferation and differentiation[J]. Inter J Molecul Sci, 2013,14(5):10143-10161.
[8] Hyun CD, Yeo KJ. Recalcitrant cutaneous ulcer of comorbid patient treated with platelet rich plasma: a case report[J]. J Korean Med Sci, 2012,27(12):1604-1606.
[9] Ran L,Li C. Impact of topical application of autologous platelet-rich gel on medical expenditure and length of stay in hospitals in diabetic patients with refractory cutaneous ulcers[J]. J Sichuan Uni, 2012,43(5):762-765.
[10] Lu JH, Gong SL. Advances in the research of treating refractory diabetic wounds with stem cells[J]. Chin J Burn,2014,30(6):518-520.
[11] 弓家弘,陆树良. 干细胞治疗糖尿病难愈创面研究进展[J].中华烧伤杂志,2014,30(6):518-521.
[12] Min P,Songhie K. Effective healing of diabetic skin wounds by using nonviral gene therapy based on minicircle vascular endothelial growth factor DNA and a cationic dendrimer[J].J Gene Med, 2012,14(4):272-278.
[13] Chen GQ, Shan YN. Evaluation of the effects of homologous platelet gel on healing lower extremity wounds in patients with diabetes[J].Inter J Lower Extr Wound, 2013,12(1):22-29.
[14] Masaaki T, Hitoshi M. The usefulness and development of maggots therapy using medical aseptic flies larvae for refractory wound[J]. J Jap Biochem Society, 2014,86(5):620-625.
[15] Li LY, Xie ML. Improved refractory wound healing with administration of acidic fibroblast growth factor in diabetic rats[J]. Diabetes Res Clin Prac, 2011,93(3):396-403.
[16] Li FL, Li H. Effects of external application of Chinese medicine on diabetic ulcers and the expressions of β-catenin, c-myc and K6[J]. Chin J Integrat Med, 2011,17(4):261-266.
[17] Mario L,Ernesto L. Effects of a pulsatile electrostatic field on ischemic injury to the diabetic foot: evaluation of refractory ulcers[J]. Prim Care Diabetes, 2014,8(3):244-249.
[18] Zhang XJ, Ge YZ. Advances in research of the mechanism of covert disorder in diabetic skin][J]. Chin J Burn, 2012,28(1):51-53.
[19] 邓洁,罗羽. 不同换药方式对糖尿病模型小鼠和正常小鼠创面愈合影响的实验研究[J]. 护理研究,2014,24(25):3093-3095.
[20] Chen L,Tie LY. GTP cyclohydrolase I prevents diabetic-impaired endothelial progenitor cells and wound healing by suppressing oxidative stress/thrombospondin-1[J]. Am J Physiol Endocrinol Metabol, 2014,306(10):1120-1131.
[21] Li L, Tie Y. Genistein accelerates refractory wound healing by suppressing superoxide and FoxO1/iNOS pathway in type 1 diabetes[J]. J Nutrit Biochem, 2013,24(1):88-96.
[22] 刘移峰,刘德伍. 糖尿病创面与正常创面微小RNA差异表达谱分析[J]. 中华实验外科杂志,2015,32(1):57-59.
[23] 崔胜勇,刘琰,章雄. 巨噬细胞功能障碍与糖尿病慢性难愈创面的关系[J].中华烧伤杂志,2014,30(3):264-269.
[24] 郭相凯,王彦. 糖尿病患者皮肤损伤生物治疗的新进展[J].中华医学美学美容杂志,2014,20(3):235-237.
[25] 弓家弘,陆树良.干细胞治疗糖尿病难愈创面研究进展[J].中华烧伤杂志,2014,30(6):518-521.
10.3969/j.issn.1002-266X.2017.35.011
R587.1
A
1002-266X(2017)35-0036-03
2016-12-20)

