利用hAPOA1原核蛋白生产兔多克隆抗体
徐志伟 赵杰++刘伟忠 刘照亭 王期

摘要:将hAPOA1的阅读框连接到原核表达载体pGEX-4T-1中,构建成正确的pGEX-4T-1-hAPOA1原核表达质粒,然后将其转入宿主菌BL21,经异丙基硫代半乳糖苷(IPTG)诱导后,宿主菌表达出与预期分子量大小相符的55.4 ku的融合蛋白;将纯化后的包涵体融合蛋白免疫新西兰大白兔,制备抗hAPOA1血清并检测抗体效价。结果表明,经间接酶联免疫吸附测定(ID-ELISA)及蛋白质免疫印迹(Western Blot)方法证实,获得的融合蛋白免疫新西兰大白兔得到了特异性的多克隆抗体,抗体效价为1 ∶[KG-*3]40 000,经济效益可观。
关键词:hAPOA1;原核表达;新西兰大白兔;融合表达;多克隆抗体
中图分类号: S852.5文献标志码: A
文章编号:1002-1302(2016)12-0085-03
收稿日期:2016-08-11
基金项目:江苏省农业科技自主创新资金[编号:CX(16)1326]。
作者简介:徐志伟(1965—),男,江苏常州人,硕士,助理研究员,主要从事畜禽养殖研究。E-mail:xzw1729@sina.com。
通信作者:王期,博士,主要从事生物技术研究。E-mail:swwq0401@163.com。
载脂蛋白A1(ApoA1)是apoA族最多的一种组分,apoA1为单一多肽链,由243个氨基酸残基组成,是高密度脂蛋白(HDL)的主要载脂蛋白,不仅是生物试剂的重要原料,也是抗动脉粥样硬化的指标[1]。目前,apoA1的检测多采用免疫比浊法[2],现有的抗载脂蛋白A1抗體的生产采用传统的免疫方式(免疫原从高密度脂蛋白纯化得到,免疫动物受限等),产量、效价及特异性较差,已无法满足日益增长的使用需求。本研究构建了hAPOA1的原核表达载体,通过大肠杆菌原核表达系统进行hAPOA1的蛋白表达与纯化,并通过免疫新西兰大白兔获得了抗血清,为自主大规模生产抗hAPOA1抗体及后续的免疫检测试剂盒研发奠定了基础。
1材料与方法
1.1试验材料
1.1.1菌种和质粒E.coli DH5α、表达载体pGEX-4T-1、E.coli BL21(DE3)均由笔者所在实验室保存。
1.1.2试剂限制性内切酶NotⅠ、EcoRⅠ为TaKaRa公司产品;T4 DNA连接酶、TaqDNA聚合酶、核酸标准相对分子质量购自TaKaRa公司;蛋白质分子量标准购自MBI公司;蛋白胨和酵母粉购自英国OXOID公司;氨苄青霉素购自Ameresco公司;IPTG购自Merck公司;丙烯酰胺(Acr)及甲叉双丙烯酰胺(Bis)购自Promega公司;四甲基乙二胺(TEMED)购自 BioRad 公司;考马斯亮蓝R-250购自Sanland公司;胶回收试剂盒及质粒提取试剂盒购自Axygen公司;弗氏完全佐剂和不完全佐剂为Sigma公司产品;Goat-Rabbit IgG-HRP购自 Bioworld;其余试剂均为国产分析纯。
1.1.3试验动物本研究所用动物为健康的新西兰大白兔。
1.2试验方法
1.2.1pGEX-4T-1-hAPOA1原核表达质粒的构建根据人源的hAPOA1基因序列(Gene ID:335)设计引物,5′和3′端分别加入EcoRⅠ和NotⅠ酶切位点。上游引物:5′-CCGGAATTCATGAAAGCTGCGGTGCTGACCTT -3′;下游引物:5′-AAAGCGGCCGCTCACTGGGTGTTGAGCTTCTTAGT-3′。以hAPOA1的全长cDNA序列为模板进行PCR扩增,反应程序:95 ℃ 5 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物和pGEX-4T-1载体分别经EcoRⅠ和NotⅠ双酶切,并用T4 DNA连接酶连接,转化E.coli DH5α感受态细胞。重组质粒经PCR和双酶切筛选阳性克隆,并进行DNA测序,该重组质粒命名为pGEX-4T-1-hAPOA1(具体操作参考Novagen公司pET System Manual)。
1.2.2谷胱甘肽转移酶(GST)-hAPOA1融合蛋白的小试诱导表达及鉴定将测序正确的重组质粒pGEX-4T-1-hAPOA1转化宿主菌E.coli BL21(DE3),在平板上挑取3个克隆,各接种于4 mL含氨苄青霉素100 mg/L的LB液体培养基(含胰蛋白胨0.04 g,酵母提取物0.02 g,NaCl 0.04 g),37 ℃ 振荡培养4 h,使D600 nm达到0.8~1.0,加异丙基硫代半乳糖苷(IPTG)至终浓度为1 mmol/L,继续振荡培养6 h,12 500 g 离心10 min后收集菌体并留样进行聚丙烯酰氨凝胶电泳(SDS-PAGE),结合考马斯亮蓝G-250染色,脱色后分析融合蛋白表达与否。
1.2.3GST-hAPOA1融合蛋白的大量表达及表达产物分布将上述鉴定正确表达的pGEX-4T-1-hAPOA1-BL21(DE3)冻存菌株接种于4 mL含氨苄青霉素100 mg/L的LB液体培养基(含胰蛋白胨0.04 g,酵母提取物0.02 g,NaCl 0.04 g)中,37 ℃振荡培养16 h,然后取4 mL接种到400 mL LB液体培养基中,37 ℃振摇培养2~4 h,D600 nm达到0.8~10时,加IPTG至终浓度0.5 mmol/L,20 ℃继续振荡培养 12 h,12 500 g 离心10 min收集菌体并留样,按1 g菌体沉淀加 5 mL 磷酸缓冲盐溶液(PBS)重悬诱导表达后的菌体沉淀,经超声破碎(设置为工作5 s,间歇6 s,功率300 W,全程时间20 min)后,12 500 g、4 ℃离心15 min后取上清和沉淀留样,进行SDS-PAGE,结合考马斯亮蓝G-250染色,脱色后分析GST-hAPOA1融合蛋白表达产物的表达量及存在形式。
1.2.4GST-hAPOA1融合蛋白的纯化对于上述大量诱导的包涵体蛋白,分别用2、3、4、6、8 mol/L尿素溶液对沉淀进行梯度重悬、洗涤处理,每次洗涤完后于4 ℃、12 500 g离心 20 min 重新收集沉淀,接着将洗脱下的目的蛋白装入透析袋,放入PBS中透析过夜。SDS-PAGE结合Western-Blot检验洗脱后的蛋白;采用二喹啉甲酸(BCA)法微量蛋白浓度测量试剂盒测定纯化后蛋白浓度,分装后于-80 ℃保存。
1.2.5hAPOA1多克隆抗体的制备将纯化并透析过的包涵体融合蛋白按常规方法免疫新西兰大白兔(注射总量为500 μg/只),首次免疫加等体积弗氏完全佐剂乳化后,大腿肌肉多位点注射;3周后以同样的抗原剂量与弗氏不完全佐剂乳化后增强免疫;此后每隔7 d以同样的抗原剂量加强免疫1次,共3次。第2次、第3次加强免疫前均耳缘静脉采血,分离血清,以hAPOA1纯化融合蛋白(2 μg/mL)为抗原进行间接酶联免疫吸附测定(ID-ELISA)测定[3],以免疫前家兔血清作为阴性对照,PBS作为空白对照,效价检测合格后在第3次加强免疫后7 d进行颈动脉采全血作为阳性血,同样用 ID-ELISA方法测定免疫兔血清抗体效价。血液处理方法:37 ℃静置1 h,4 ℃静置过夜,5 000 r/min离心15 min,吸取上清于50 mL离心管,再次 5 000 r/min 离心 15 min,吸取上清,留取近期使用量于2~8 ℃存放,其余分装后置于-80 ℃。
1.2.6hAPOA1血清抗体特异性检测取纯化后的融合蛋白GST-hAPOA1及空载体pGEX-4T-1表达蛋白样品进行SDS-PAGE后,采用电转膜法(100 V,60 min)转移至硝酸纤维素(NC)膜上,5%脱脂奶粉封闭后,以本试验制备的兔抗血清(1 ∶[KG-*3]500稀释)为一抗,辣根过氧化物酶标记羊抗兔[JP2]IgG(1 ∶[KG-*3]12 000稀释)为二抗进行反应。二氨基联苯胺(DAB)避光显色15 min左右,条带清晰后用双蒸水洗以终止反应。
2结果与分析
2.1pGEX-4T-1-hAPOA1原核表达质粒的构建
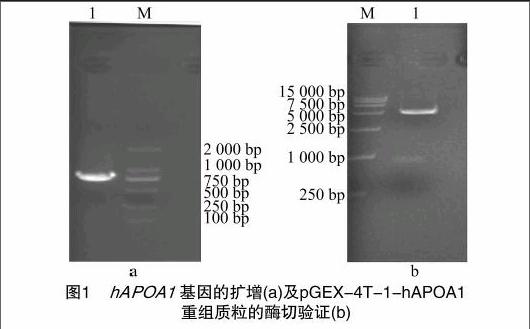
利用上述设计的引物对hAPOA1进行PCR扩增,PCR产物在1%琼脂糖凝胶电泳结果(图1-a)显示,扩增出1个特异性的DNA条带,分子量大小介于750 bp与1 000 bp之间,与理论值804 bp相符。对重组质粒用EcoRⅠ、NotⅠ双酶切,获得大小约为5 000、800 bp的2个条带(图1-b),与理论值4 969、804 bp一致,初步说明重组成功。重组质粒经上海英骏生物技术有限公司测序,结果正确,可以确定 pGEX-4T-1-hAPOA1 原核表达质粒构建成功。
2.2GST-hAPOA1融合蛋白的诱导表达及表达产物SDS-PAGE分析
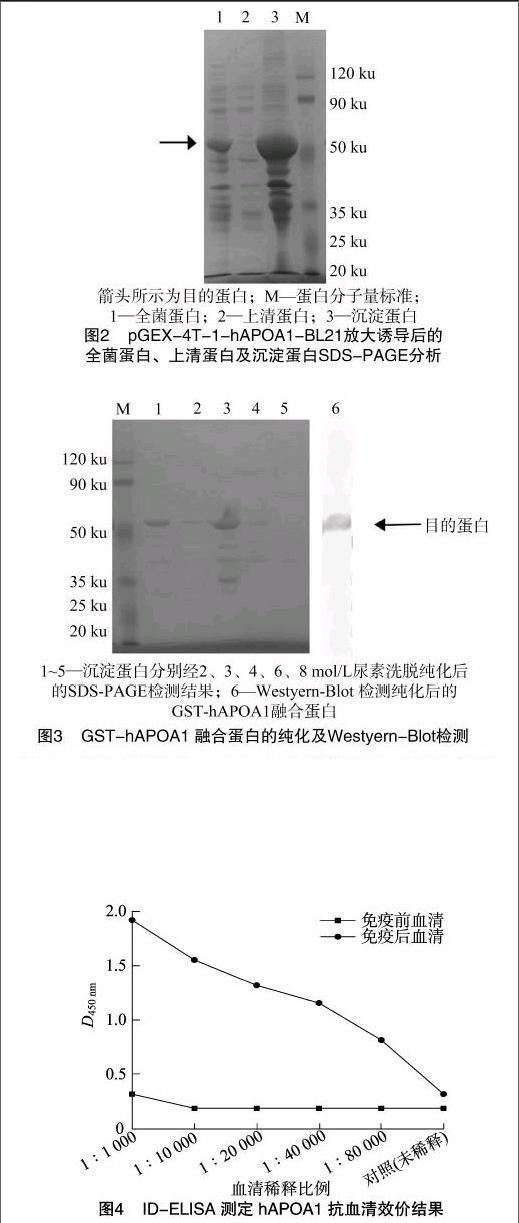
hAPOA1基因编码267个氨基酸,由于克隆的hAPOA1基因插入位置在pGEX-4T-1载体的GST-tag下游,使用hAPOA1基因自带的终止密码子,谷胱甘肽转移酶(GST)标签蛋白分子量约为26 ku,所以重组菌表达的hAPOA1分子量约为55.4 ku。将重组原核表达质粒pGEX-4T-1-hAPOA1转化大肠杆菌感受态BL21,随机挑取3个克隆,37 ℃经IPTG诱导小试,收集菌体进行SDS-PAGE分析,结果显示,在 55 ku 位置有较浓的特征蛋白条带出现,与预期分子量一致,而对照组均无此条带,说明重组菌能表达出hAPOA1蛋白(图未显示)。将上述鉴定正确的pGEX-4T-1-hAPOA1-BL21冻存菌于20 ℃放大诱导培养,收集菌体进行超声破碎,取上清和沉淀分别进行SDS-PAGE,上清中几乎无融合蛋白GST-hAPOA1表达(图2),证明融合蛋白GST-hAPOA1以包涵体形式在宿主菌内高效表达。
2.3GST-hAPOA1融合蛋白的纯化
对包涵体纯化后,收集的蛋白经SDS-PAGE分析、Western Blot检测并经BCA法计算可得,其浓度为1.10 mg/mL,纯度约为90%,6 mol/L尿素溶液洗脱后获得的融合蛋白的纯度及产量最佳(图3)。
2.4hAPOA1抗血清效价测定
将纯化后并经过透析的融合蛋白作为免疫原,采用肌肉多[CM(25]点注射免疫新西兰大白兔,4次注射后进行抗血清的效价[CM)]
为抗原进行ID-ELISA测定,以表达的hAPOA1融合蛋白作抗原,抗血清稀释 40 000 倍以上仍明显地呈阳性反应(图4)。效价判断标准为大于最大D450 nm的50%的最小D450 nm所对应的稀释度,本抗血清效价为 1 ∶[KG-*3]40 000。
2.5抗体免疫原性鉴定
[JP2]对纯化的融合蛋白GST-hAPOA1及空载体pGEX-4T-1表达蛋白样品进行SDS-PAGE电泳,将凝胶上的目的蛋白转移到NC膜中,并对NC膜进行封闭、一抗、二抗孵育,然后用DAB显色,结果在55 ku处出现明显的特异性杂交条带(图5),表明本试验制备的多克隆抗体具有免疫反应性和蛋白特异性,同时也表明融合蛋白在大肠杆菌中的表达获得了成功。
[FK(W15][TPXZW5.tif;S+3mm]
3讨论
高密度脂蛋白(HDL)具有促进胆固醇的逆向转运及抗动脉硬化作用,Apoa1是HDL的结构蛋白,几乎有所HDL都含有Apoa1,其水平可直接反映HDL在体内情况,Apoa1在HDL功能如抗氧化、抗炎方面至关重要,与冠心病呈负相关性[4]。另外,有研究表明,联合检测载脂蛋白A与载脂蛋白B(ApoB)对血脂的判断具有重要的临床价值[5-6],测定载脂蛋白及脂蛋白HDL、低密度脂蛋白(LDL)对分析病理发生状态很有帮助。由此可见Apoa1对于医学诊断及疾病治疗的重要性。目前生产大量Apoa1抗血清,主要采用高密度脂蛋白纯化的Apoa1作为抗原免疫得来。由于大量血清中分离纯化Apoa1的过程中不可避免会有一些血清蛋白等杂蛋白的污染,去掉这些影响抗体交叉反应的杂蛋白成分,势必会提高抗体生产成本。如果用含杂蛋白污染的Apoa1作为抗原免疫动物后,必然会导致非特异性抗体的产生,而Apoa1的临床精确检测需要高质量的抗体。本研究详细报道了抗Apoa1抗体的制备过程,利用自主表达的Apoa1的重组蛋白抗原,不存在大量血清蛋白残留的问题,且生产成本低,抗体特异性及效价均很好,是一种非常经济可取的抗体制备方法。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1]徐宝华. 动脉粥样硬化不稳定斑块的研究进展[J].心血管病学进展,2005,26(5):498-501.
[2]李培英,王抒. 载脂蛋白免疫比浊法有关问题解答[J].临床检验杂志,1995,13(3):158-159.
[3]萨姆布鲁克J,拉塞尔D W. 分子克隆实验指南[M].黄培堂,译.3版.北京:科学出版社,2002:1256-1259.
[4]刘姗姗,王璐,邱建平. 血清载脂蛋白A1、载脂蛋白B及其比值与冠脉病变程度相关性分析[J].中国实验诊断学,2013,17(7):1216-1218.
[5]Hirata T,Fujioka M,Takahashi K A,et al.ApoB C7623T polymorphism predicts risk for steroid-induced osteonecrosis of the femoral head after renal transplantation[J].Jounal of Orthopaedic Science,2007,12(3):199-206.
[6]陳保生. 载脂蛋白的结构和功能与病毒病的预防和治疗[J].中国医学科学院学报,2007,29(3):448-451.

