鹅掌楸愈伤蛋白质组的样品比较
徐飞 郑秀化++李春映 施季森 甄艳

摘要:为建立适合鹅掌楸胚性愈伤大规模蛋白质组研究,比较分析4种蛋白质提取方案:Mg/NP-40-三氯乙酸(简称TCA)/丙酮、TCA/丙酮、裂解液-Clean-up、裂解液-TCA/丙酮,并进行蛋白质的聚丙烯酰腚凝胶电泳(简称SDS-PAGE)和双向电泳分析。SDS-PAGE图谱显示:裂解液-Clean-up、裂解液-TCA/丙酮法分离高分子量蛋白质条带相对于Mg/NP-40-TCA/丙酮、TCA/丙酮法少;Mg/NP-40-TCA/丙酮法和裂解液-Clean up法低分子量提取、分离效果较差。在SDS-PAGE基础上对Mg/NP-40-TCA/丙酮、TCA/丙酮法提取蛋白质样品进行双向电泳,结果表明:TCA/丙酮法得到的凝胶图蛋白质点分布均匀、背景清晰且纵横条纹较少,且TCA/丙酮法相对于Mg/NP-40-TCA/丙酮法来说在小分子量蛋白质、碱性蛋白质分离方面有优势。同时随机选取双向电泳分离的蛋白质进行质谱分析,结果显示,TCA/丙酮法较适合鹅掌楸胚性愈伤蛋白质组的大规模分析。
关键词:鹅掌楸;愈伤组织;蛋白质组;SDS-PAGE;双向电泳
中图分类号:S718.3 文献标志码: A
文章编号:1002-1302(2016)12-0252-04
[HJ1.3mm]
收稿日期:2015-10-28
基金项目:江苏省高校自然科学重大研究项目(编号:12KJA220002);江苏省政府优势学科(林学)建设项目。
作者简介:徐飞(1993—),男,江苏泰州人,研究方向为植物蛋白质组。E-mail:1291146127@qq.com。
通信作者:甄艳,博士,副教授,研究方向为植物蛋白质组。E-mail:zhenyongni30@aliyun.com.cn。
2005年《Science》杂志的特刊列出125个重要的科学问题,而1个体细胞如何成为1株完整的植株是其中的一個重要的科学问题[1]。体胚发生生理与分子生物学事件的研究是一个非常有趣的科学问题,胚性愈伤组织的形成是植物体胚发生的第一步,它起源于单细胞,很多具有全能性的愈伤组织可以发育成完整的植株。目前,关于胚性愈伤组织的形成机制还不清楚[2]。杂交鹅掌楸是我国著名林木遗传育种专家叶培忠教授利用分布在我国的中国鹅掌楸和分布在北美的北美鹅掌楸通过人工杂交育成的种间杂种,具有重要的经济价值和社会价值[3]。南京林业大学林木遗传和生物技术省-部共建教育部重点实验室的陈金慧教授在开展杂交鹅掌楸体胚发生和植株再生研究中已经取得了突出的成绩,并已进入商品化阶段。但是目前鹅掌楸体细胞胚发生仍存在许多问题,例如:(1)胚性能力的获得;(2)对基因型的过度依赖;(3)体细胞胚诱导频率还相对较低、培养过程中体细胞胚发生能力可能丧失;(4)体细胞胚发生不能同步化等。蛋白质组学是功能基因组学研究的一个重要组成部分,蛋白质是基因表达的产物,是生命活动的直接执行者和体现者。鹅掌楸愈伤胚性形成的蛋白质调控网路及组蛋白修饰在愈伤胚性形成中起重要的作用,研究愈伤组织胚性的形成将有助于提高体胚发生的实践操作及了解细胞全能性的基本知识。
蛋白质样品制备是蛋白质组学研究的第1步,也是关键的步骤。由于不同植物组分差异较大,且含有大量干扰物质如核酸、多糖、酚类物质、盐类等,到目前为止还没有一种提取方法适合所有植物[4-5]。蛋白质提取过程中操作不精细或所选取的提取方法或裂解液不适合,都会造成一些蛋白质的降解和低丰度蛋白的丢失,直接影响双向电泳结果及后续质谱分析。杂交鹅掌楸胚性愈伤组织及体胚材料杂质较多,体胚属于薄壁细胞,蛋白质本身含量低。成功地制备样品是鹅掌楸愈伤大规模蛋白组学研究的保证。本试验采用4种试验方案Mg/NP-40-三氯乙酸(简称TCA)/丙酮法(简称NP-40法)、TCA/丙酮法(简称TCA法)、裂解液-Clean-up法(简称LBCU法)、裂解液-TCA/丙酮法(简称LBTA法)对杂交鹅掌楸胚性愈伤进行蛋白质提取、比较分析,以期筛选较适合杂交鹅掌楸愈伤大规模蛋白质组分析的方法。
1材料与方法
1.1试验材料
杂交鹅掌楸胚性愈伤来源于南京林业大学杂交鹅掌楸未成熟的种子(由南京林业大学陈金慧教授实验室提供),杂交鹅掌楸胚性愈伤组织的建立方法见文献[6]。
1.2试验方法
1.2.1杂交鹅掌楸胚性愈伤蛋白质提取方法
1.2.1.1Mg/NP-40-TCA/丙酮法参照Lee等的方法[7-8]并稍作改进。愈伤组织加少量交联聚乙烯吡咯烷酮(简称PVPP)液氮研磨,之后迅速倒入一定体积Mg/NP-40提取缓冲液(体积分数2%的NP-40,pH值8.3的0.5 mol/L Tris-HCl,20 mmol/L MgCl2,体积分数2%的β-巯基乙醇)中,置于冰上1 h,离心(4 ℃、12 000 g)20 min收集上清,加3倍体积的TCA/丙酮,-20 ℃沉淀过夜;之后离心(4 ℃ 12 000 g 20 min),加入3倍体积的100%丙酮洗沉淀,置于 -20 ℃ 1 h,再离心(12 000 g 4 ℃)1 h后弃上清。用-20 ℃丙酮洗沉淀,重复2次,室温风干。干粉中加裂解液[7 mol/L尿素,2 mol/L硫脲,2%(质量浓度)3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(简称CHAPS),1%(质量浓度)二硫苏糖醇(简称DTT),2%两性电解质pharmalyte(pH值3~10)]室温溶解2 h,12 000 g、4 ℃离心1 h收集上清液,用2-D Quant Kit(GE Healthcare)进行蛋白定量,分装后于-70 ℃备用。
1.2.1.2TCA/丙酮法愈伤组织加少量PVPP液氮研磨,之后迅速倒入3倍体积的10% TCA/丙酮中混匀,于-20 ℃过夜,离心(4 ℃ 12 000 g)20 min弃上清,加入3倍体积的100%丙酮重悬沉淀,在-20 ℃下摇匀1 h;离心(12 000 g 4 ℃)1 h弃上清,重复2次;沉淀于室温风干后加裂解液,室温裂解2 h,离心(12 000 g、4 ℃)1 h收集上清液,用2-D Quant Kit(GE Healthcare)进行蛋白定量,分装于-70 ℃备用。
1.2.1.3裂解液-Clean-up法在愈伤组织中加少量PVPP液氮研磨,之后迅速倒入一定体积裂解缓冲液[7 mol/L尿素,2 mol/L硫脲,2%(质量浓度)CHAPS,1%(质量浓度)DTT,2%两性电解质pharmalyte,pH值3~10]中,冰浴1 h(其间不断混匀),之后离心(12 000 g、4 ℃)1 h收集上清,上清液用Clean-Up kit(GE Healthcare)处理。将Clean-up kit纯化的蛋白质沉淀溶于裂解缓冲液中,用2-D Quant Kit(GE Healthcare)进行蛋白质定量,分装后于-70 ℃备用。
1.2.1.4裂解液-TCA/丙酮法在愈伤组织中加少量PVPP液氮研磨,之后迅速倒入一定体积裂解液[7 mol/L尿素,2 mol/L硫脲,2%(质量浓度)CHAPS,1%(质量浓度)DTT,2%两性电解质pharmalyte,pH值3~10]中,冰浴中1 h,并不断混匀,于12 000 g离心(20 min,4 ℃)后收集上清;在上清液中加3倍沉淀体积的10% TCA/丙酮,-20 ℃过夜,12 000 g 离心(20 min,4 ℃)去上清后加入3倍体积100%丙酮清洗沉淀,置于-20 ℃ 1 h,12 000 g离心1 h 4 ℃;弃上清,重复3次。沉淀于室温风干,加裂解液,室温放置2 h,使蛋白充分溶于裂解液中;用2-D定量试剂盒(Quant Kit,GE Healthcare)进行蛋白质定量,分装于-70 ℃备用。
1.2.2双向(2-DE)电泳分析双向电泳第1向等电聚焦(IEF),采用24 cm固相pH值梯度(IPG)、pH值4~7胶条,蛋白质上样量为120 μg。利用IEF系统(EttanTM IPGphorTM3 IEF System,GE Healthcare)进行蛋白质的水化和等电聚焦,温度设置为20 ℃,每根胶条的最大电流低于50 μA,水化和聚焦程序:第1步,30 V 6 h;第2步,60 V 6 h;第3步,200 V 1 h;第4步,500 V 1 h;第5步,1 000 V 1 h;第6步,4 000 V 1 h;第7步,8 000 V 30 min;第8步,8 000 V 30 min;第9步,8 000 V 6 h。
蛋白质样品聚焦后,第1步蛋白质还原:将1% DTT加入平衡液[6 mol/L尿素,30%(质量浓度)丙三醇,2%十二烷基磺酸钠(简称SDS),50 mmol/L Tris-HCl]中平衡15 min;第2步蛋白质烷基化:将4%碘乙酰胺加入平衡液中平衡15 min。
第2向聚丙烯酰胺凝胶电泳(简称SDS-PAGE)采用Ettan DALTⅡ垂直电泳系统进行SDS-PAGE。将平衡的胶条转移至12.5%分离胶上,用低熔点琼脂糖溶液进行封胶,待琼脂糖溶液凝固后,置于Ettan DALTⅡ垂直电泳系统中电泳。参数设定:第1步,2 W/胶,45 min;第2步,17 W/胶,约5 h,待溴酚蓝转移出凝胶面下边沿时,停止电泳。
1.2.3染色与扫描本试验采用硝酸银染色[9],用Imagine ScannerⅢ扫描,图像用Image Master 2D Platinum 6.0软件(GE Healthcare)进行分析。
1.2.4酶解、质谱鉴定蛋白质酶解及基质辅助激光电解离飞行时间串联质谱(MALDI-TOF/TOF)方法参照文献[10-11]。利用Mascot检索引擎对蛋白质质谱分析获得的MS肽段信息及MS/MS离子信息进行非冗余NCBI数据库检索、鉴定。肽质量误差范围±0.4 u;胰蛋白酶解1个漏切;考虑乙酰化作用(蛋白质N端),脲甲基化(C)及氧化(M)修饰;母离子和子离子类型为单一同位素质量;检索时用绿色植物库(Green Plants 734557)。检索总离子分值大于99或匹配肽的最低覆盖率为10%。
2结果与分析
2.1蛋白质浓度分析
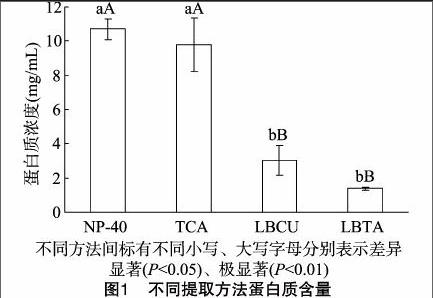
采用2-D Quant Kit进行蛋白质样品浓度测定,由图1可以看出,Mg/NP-40-TCA/丙酮、TCA/丙酮、裂解液-Clean up、裂解液-TCA/丙酮方法提取杂交鹅掌楸总蛋白质浓度分别为(10.7±0.6)、(9.8±1.5)、(3.0±0.8)、(1.4±01) mg/mL,可见Mg/NP-40-TCA/丙酮、TCA/丙酮法提取鹅掌楸愈伤组织蛋白质的效率高。利用DPS数据处理软件对4种提取方法进行差异显著性分析可见,在0.05水平上,Mg/NP-40-TCA/丙酮、TCA/丙酮法与裂解液-Clean up、裂解液-TCA/丙酮法,0.01水平上差异显著;Mg/NP-40-[JP3]TCA/丙酮法和TCA/丙酮法之间没有显著差异,裂解液-Clean up法和裂解液-TCA/丙酮法之间也不存在显著差异(图1)。
[TPXF11.tif]
2.2SDS-PAGE图谱分析
由图2可见,Mg/NP-40-TCA/丙酮、TCA/丙酮方法对高分子量蛋白质提取效果明显好于裂解液-Clean up法和裂解液-TCA/丙酮法;Mg/NP-40-TCA/丙酮法提取蛋白质在分子量30 ku以下条带较少,TCA/丙酮法和裂解液-TCA/丙酮法提取低分子量蛋白质较好;裂解液-Clean up法和裂解液-TCA/丙酮法提取高分子量蛋白质量较Mg/NP-40-TCA/丙酮、TCA/丙酮法少。总体来说,从SDS-PAGE图谱中可以看出,4种方法在低分子量蛋白质提取、分离效果方面较高分子量蛋白质差,低分子量蛋白质在SDS-PAGE胶中出現了弥散现象。为了综合考虑,笔者对Mg/NP-40-TCA/丙[CM(25]酮、TCA/丙酮2种方法提取的蛋白质进行双向电泳,以进[CM)]
[FK(W13][TPXF22.tif]
一步進行比较分析。
2.3双向电泳图谱分析
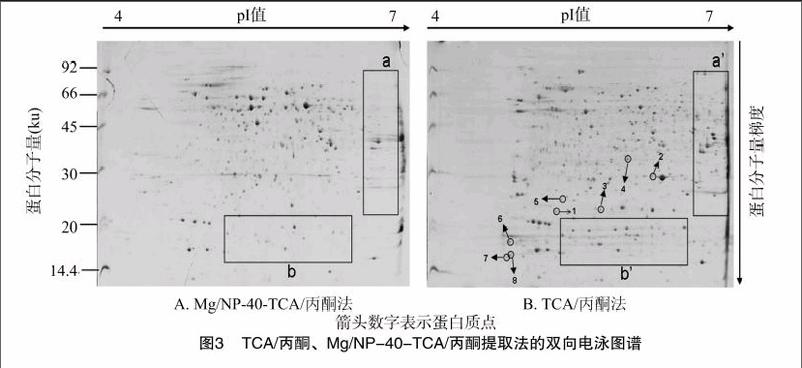
基于SDS-PAGE分析结果,对TCA/丙酮、Mg/NP-40-TCA/丙酮法提取的蛋白质进行双向电泳分析,硝酸银染色。由图3可见,2种方法获得的双向电泳图谱上蛋白质点分布较均匀且蛋白质点圆润,图谱背景清晰,但是Mg/NP-40-TCA/丙酮法的双向电泳图谱上蛋白质点较TCA/丙酮法蛋白质点少,且高丰度蛋白质数量较多,双向电泳分析中高丰度蛋白质的存在会影响蛋白质的上样量及掩盖低丰度蛋白质的呈现。此外,TCA/丙酮法在低分子量蛋白质(图3中的b、b′)和碱性蛋白质(图3中的a、a′)提取方面还有很大的优势。从整体情况分析可知,TCA/丙酮法较Mg/NP-40-TCA/丙酮法效果好。
[FK(W14][TPXF33.tif]
2.4蛋白质鉴定
随机选择TCA/丙酮提取方法的双向电泳图谱中的几个蛋白质点(图3)进行质谱鉴定。蛋白质点5、6、7在绿色植物的数据库中没有匹配,可能原因在于鹅掌楸基因组序列信息少,限制了蛋白质的鉴定。表1结果显示,TCA/丙酮法提取的蛋白质与MALDI/TOF/TOF质谱鉴定分析是兼容的,因此该方法适合鹅掌楸愈伤组织大规模的蛋白质组学分析。
[BT1#]3结论与讨论
样品制备是双向电泳的第1步,蛋白质提取的质量关系到双向电泳图谱的质量及质谱鉴定结果。本试验利用 Mg/NP-40-TCA/丙酮、TCA/丙酮、裂解液-Clean up、裂解液-TCA/丙酮4种方法提取胚性愈伤组织蛋白质,经SDS-PAGE电泳和2-DE电泳比较分析,以期寻求适合杂交鹅掌楸胚性愈伤蛋白质组分析的提取方案。
从蛋白质样品浓度的测定可以看出,裂解液-Clean up、裂解液-TCA/丙酮法提取蛋白质浓度较低,Mg/NP-40-TCA/丙酮、TCA/丙酮法提取蛋白质浓度较高,是前2种方法提取蛋白浓度的3~4倍。显著性分析表明,Mg/NP-40-TCA/丙酮法、TCA/丙酮法提取蛋白质量与裂解液-Clean up法、裂解液-TCA/丙酮法存在显著差异,表明这2种方法总蛋[CM(25]白提取效果明显优于前2种方法。虽然Mg/NP-40-[CM)]
从SDS-PAGE图谱分析可以看出,裂解液-Clean up法、裂解液-TCA/丙酮法在提取高分子量蛋白质方面没有优势。一般来说,Clean up试剂盒纯化效果较好且耗时短,但Clean up试剂盒价格较高,从而提高试验成本,且该试剂盒较适合少量蛋白质的提取和纯化。[JP2]与裂解液-Clean up法、裂解液-TCA/丙酮法相比,TCA/丙酮法、Mg/NP-40-TCA/丙酮法提取效率高,由SDS-PAGE图谱看出,蛋白质条带较清晰。双向电泳分析表明,TCA/丙酮法所获得的2-DE图谱中蛋白质数量和质量较Mg/NP-40-TCA/丙酮法好。TCA/丙酮提取方法获得的蛋白质点多、清晰、纵横条纹较少,且在小分子量蛋白质和碱性蛋白质分离中有优势;质谱试验结果表明,TCA/丙酮法提取的蛋白质适合质谱鉴定、分析。因此综合分析这4种提取方法表明,TCA/丙酮法适合杂交鹅掌楸愈伤大规模蛋白质组分析。为了更好地、更多地鉴定蛋白质,下一步工作应结合杂交鹅掌楸的转录组信息来鉴定蛋白质组。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1]Vogel G. How does a single somatic cell become a whole plant[J]. Science,2005,309(5731):86.
[2]Ikeuchi M,Sugimoto K,Iwase A. Plant callus:mechanisms of induction and repression[J]. Plant Cell,2013,25(9):3159-3173.
[3]王章荣. 鹅掌楸属杂交育种成就与育种策略[J]. 林业科技开发,2008,22(5):1-4.
[4]Zhen Y,Shi J S. Evaluation of sample extraction methods for proteomic analysis of coniferous seeds[J]. Acta Physiologiae Plantarum,2011,33(5):1623-1630.
[5]Wang W,Tai F J,Chen S N. Optimizing protein extraction from plant tissues for enhanced proteomics analysis[J]. Journal of Separation Science,2008,31(11):2032-2039.
[6]陈金慧,施季森,诸葛强,等. 杂交鹅掌楸体细胞胚胎发生研究[J]. 林业科学,2003,39(4):49-53.
[7]Lee D G,Ahsan N,Lee S H,et al. An approach to identify cold-induced low-abundant proteins in rice leaf[J]. Comptes Rendus Biologies,2007,330(3):215-225.
[8]梁书剑,张萌,王巍,等. 双向电泳比较两种方法获得的水稻叶片蛋白[J]. 生物学杂志,2009,26(3):68-71.
[9]Shevchenko A,Wilm M,Vorm O A,et al. Mass spectrometric sequencing of proteins from silver-stained polyacrylamide gels[J]. Analytical Chemistry,1996,68(5):850-858.
[10]Shi J,Zhen Y,Zheng R H. Proteome profiling of early seed development in Cunninghamia lanceolata(Lamb.) Hook[J]. Journal of Experimental Botany,2010,61(9):2367-2381.
[11]Khatun J,Ramkissoon K,Giddings M C. Fragmentation characteristics of collision-induced dissociation in MALDI TOF/TOF mass spectrometry[J]. Analytical Chemistry,2007,79(8):3032-3040.

