国产PCR试剂和COBAS系统血清HBV—DNA检测结果不一致的原因分析
姜新华++高国生++胡爱荣
[摘要] 目的 探討国产PCR试剂和COBAS系统血清HBV-DNA检测结果不一致的原因。 方法 收集2013年12月~2015年10月来本院肝病中心就诊的慢性HBV感染者230例,国产PCR试剂血清HBV-DNA结果均为阴性,应用COBAS系统予以复查,分析两种方法HBV-DNA检测结果的差异及可能的影响因素。 结果 106例(46.09%)患者两种方法血清HBV-DNA检测结果均低于检测下限;124例(53.91%)患者在COBAS系统可检测到不同载量的HBV-DNA,包括3例(1.30%)隐匿性HBV感染。随着患者血清HBV-DNA载量的增加,性别比、HBeAg效价和阳性率、血常规和凝血功能等指标差异均无统计学意义(P>0.05),但血清HBsAg效价、终末期肝病构成比、肝功能酶类指标、AFP等逐渐升高(P<0.05)。血清HBV-DNA与HBsAg效价、肝功能指标、AFP均有一定相关性(P<0.05),与HBeAg效价无相关性(P=0.87)。 结论 针对肝功能指标异常、HBsAg效价较高、病情较重(特别是终末期肝病)的慢性HBV感染患者,国产PCR试剂检测血清HBV-DNA阴性时有必要应用COBAS系统复查。
[关键词] 乙型肝炎病毒;脱氧核糖核酸;终末期肝病;COBAS Taqman系统;荧光定量PCR
[中图分类号] R512.6 [文献标识码] B [文章编号] 1673-9701(2017)02-0000-03
Analysis of the causes of inconsistency of serum HBV-DNA test results between homemade PCR reagent and COBAS system
JIANG Xinhua1 GAO Guosheng2 HU Airong3
1.Clinical Laboratory, Quhua Hospital in Zhejiang Province, Quzhou 324004, China; 2.Clinical Laboratory, Ningbo Second Hospital, Ningbo 315010, China; 3.Department of Liver Diseases, Ningbo Second Hospital, Ningbo 315010, China
[Abstract] Objective To explore the causes of inconsistency of serum HBV-DNA test results between homemade PCR reagent and COBAS system. Methods A total of 230 patients with chronic HBV infection who were diagnosed in the Center for Liver Diseases in our hospital from December 2013 to October 2015 were collected. The serum HBV-DNA results of homemade PCR reagents were all negative. COBAS system was applied for retest. The differences of HBV-DNA test results by both methods and the possible influencing factors were analyzed. Results The test results of serum HBV-DNA in 106 cases (46.09%) were lower than the lower limit of detection in both methods, HBV-DNA with different capacity was detected in the COBAS system in 124 patients(53.91%), including 3 cases(1.30%) of occult HBV infection. With the increase of patients' serum HBV-DNA capacity, there was no significant difference in sex ratio, HBeAg valence and positive rate, blood routine test and coagulation function(P>0.05). But serum HBsAg valence, end-stage liver disease ratio, liver function enzyme index, and AFP were gradually increased(P<0.05). Serum HBV-DNA was associated with HBsAg valence, liver function index and AFP (P<0.05), yet was not associated with HBeAg valence(P=0.87). Conclusion In patients with chronic HBV infection who have abnormal liver function, high HBsAg valence, and severe illness(especially end-stage liver disease), negative results of serum HBV-DNA tested by homemade PCR reagents need to be re-tested by COBAS system.
[Key words] Hepatitis B; DNA; End-stage liver disease; COBAS Taqman System; Fluorescent quantitative PCR
慢性 HBV 感染是导致我国终末期肝病的主要病因[1],HBV-DNA 定量测定能准确地反映病毒复制程度[2],对慢乙肝相关疾病的诊疗、监测及预后的评估均十分重要[3]。近年来国产 HBV-DNA 检测试剂由于采用了可靠的质量管理体系,同时卫计委要求PCR实验室均采用评审准入制度,国产PCR试剂用于慢乙肝患者血清HBV-DNA的检测基本可以满足临床需求[4]。但由于与国际参考方法(COBAS系统)在样本用量、内标、引物等方面存在差异[5],导致灵敏度和准确性稍有欠缺。本文应用COBAS系统对230例国产PCR试剂血清HBV-DNA检测结果阴性的患者予以复查,分析两者结果不一致的可能原因,并为检测方法的合理应用提供依据。
1 资料与方法
1.1 一般资料
本研究230例患者均为2013年12月~2015年10月来本院肝病中心就诊的慢性HBV感染者,所有患者的诊断标准均符合《慢性乙型肝炎防治指南》(2015版)[6],HBsAg和(或)HBV-DNA阳性6个月以上,除外其他肝炎病毒感染、酒精性肝病、药物性肝病、自身免疫性肝病者。其中男167例,女63例,年龄17~81岁,平均(55.67±12.74)岁,将所有患者按血清HBV-DNA水平(COBAS系统)高低分为三组,A组106例(<20.00 IU/mL),B组100例(20.00~1.00×103 IU/mL),C组24例(>1.00×103 IU/mL),三组的年龄和性别比例均无明显差异,具有可比性。
1.2 检测方法及观察指标
所有患者首次血清HBV-DNA检测均采用国产 PCR 试剂,仪器为美国 ABI 7500 型荧光定量 PCR 仪。检测结果当日回报给临床医生,当怀疑与临床实际不相符时,当日或次日再次采血用 Roche COBAS AmpliPrep/COBAS TaqMan 48 系统及配套试剂(简称COBAS系统)复查 HBV-DNA。同时检测患者 HBV 血清标志物、肝功能、血常规、凝血功能和甲胎蛋白(AFP)等可能影响血清HBV-DNA的指标,HBsAg和HBeAg效价采用ABBOTT雅培AXSYM i2000全自动免疫分析仪及配套试剂,肝功能检测采用 Siemens ADVIA2400 全自动生化分析仪及配套装试剂,血常规检测采用 Sysmex i2000全自动血液分析仪和配套试剂,凝血功能检测采用 ACL TOP 全自动凝血分析仪和配套试剂,甲胎蛋白检测采用Siemens ADVIA Centaur XP全自动免疫分析仪和配套试剂。
1.3 统计学方法
采用SPSS 16.0 软件,正态分布的计量资料以均数±标准差(x±s)表示,多组均数比较采用方差分析;偏态分布的计量资料采用中位数(四分位数)表示,多组均数比较采用非参数检验;计数资料采用例数和率表示,率的比较采用χ2检验。采用Spearman相关分析各指标之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 基本情况
230例患者经COBAS系统复查后,106例(46.09%)仍低于检测下限,124例(53.91%)可以检测到HBV-DNA(从20.93 IU/mL~大于1.70×108 IU/mL不等),特别是有24例患者高于1.00×103 IU/mL,并发现3例(1.30%)隐匿性HBV感染(HBsAg均为阴性,血清HBV-DNA分别为37.10 IU/mL、154.00 IU/mL、163.00 IU/mL)。
2.2 不同血清HBV-DNA水平患者的实验室指标比较
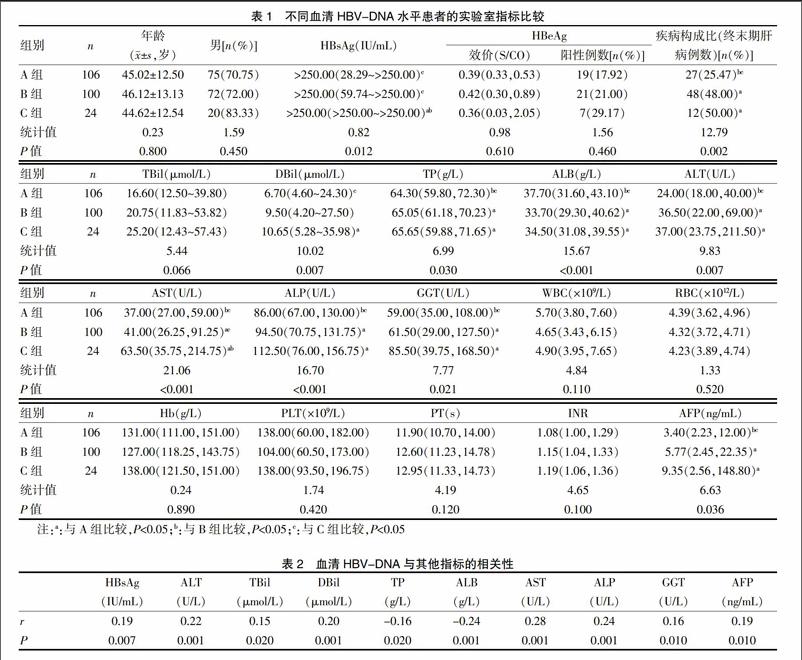
将所有患者按血清HBV-DNA水平(COBAS系统)高低分为三组,A组:<20.00 IU/mL,B組:20.00~1.00×103 IU/mL,C组:>1.00×103 IU/mL,随着血清HBV-DNA的增加,患者的年龄、性别比例、HBeAg效价和阳性率、TBil、血常规和凝血功能指标差异均无统计学意义(P>0.05),但血清HBsAg效价、终末期肝病构成比、DBil、TP、肝功能酶类指标(包括ALT、AST、ALP、GGT等)、AFP逐渐升高(P<0.05),而A组患者的ALB水平显著高于B、C组(P<0.05)。见表1。
2.3 血清HBV-DNA与其他指标的相关性
Spearman相关分析显示,血清HBV-DNA与HBsAg效价、肝功能指标、AFP均有一定相关性(P<0.05);而与HBeAg效价无相关性,相关系数r为0.011(P=0.87)。见表2。
3 讨论
监测血清HBV-DNA的变化,对于判断慢性 HBV 感染患者抗病毒治疗的效果及预后十分重要。目前国内血清 HBV-DNA 水平的检测多采用国产试剂盒,但各厂家的方法没有标准化,且受标本状态、退火温度以及样品中酶活性抑制物等多种因素的影响,各种检测方法的灵敏度、精密度、检测范围等方面均存在差异[7]。COMBAS 系统作为国际参考方法,采用磁珠法提取 DNA、引物探针覆盖高变区、设立内参照,故具有高灵敏度、精确度和线性范围等优点[8],但也有耗时长、费用昂贵等不适宜大范围推广使用的缺点。在临床实践中,部分患者采用国产PCR试剂的血清 HBV-DNA 检测结果低于检测下限,但仍有活动性肝病的症状或经过规范的抗病毒治疗考虑停药,此时有必要明确患者的病毒实际复制情况。
本文纳入的230例患者经COBAS系统复查后,发现超过一半的病例可以检测到HBV-DNA,而且还有24例高于国产PCR试剂的检测下限(1.00×103 IU/mL),后者可能是国产PCR试剂存在检测盲区导致的假阴性[9],而COBAS系统由于采用了涵盖高变区的多对引物具备更好的检测能力;而相当比例的患者存在乙肝病毒低复制状态,提示部分患者经过规范的抗病毒治疗后,即使HBV血清标志物(特别是HBeAg)、ALT水平得到显著控制后,仍不能随意停药。而且极少数患者虽然乙肝表面抗原阴性,在血清中仍可检测到低复制的乙肝病毒,这种隐匿性HBV感染状态为不明原因肝病的病因诊断提供了依据。
为分析哪些患者容易出现国产PCR试剂检测阴性而COBAS系统阳性,本研究将所有患者按血清HBV-DNA水平高低分组,结果发现随着血清HBV-DNA的增加,血清HBsAg效价、血清肝功能指标(包括ALT、AST等)、终末期肝病比率逐渐升高,但HBeAg的效价和阳性率均无明显差异(而且大部分患者血清HBeAg效价较低而表现为HBeAg阴性状态);Spearman相关分析也提示血清HBV-DNA与HBsAg、ALT相关,而与HBeAg效价无相关性。一般认为,HBeAg阳性是HBV复制活跃、传染性强的标志,但部分患者由于前C区和/或基本核心启动子基因的变异导致e抗原分泌减少或不表达,但HBV仍不同程度复制,故此时HBeAg不能作为评价抗病毒疗效以及传染性强弱的依据,这与既往研究结论一致[10-12]。关于血清HBV-DNA与HBsAg效价的相关性目前存在争议[13-16],这可能与各研究纳入病例的异质性有关,正常情况下,X蛋白是乙肝病毒DNA复制过程中必需的功能蛋白[17],在促进HBV-DNA复制的同时,抑制S抗原表达,导致两者负相关,但一旦病毒发生变异HBsAg效价的变化趋势可能与HBV-DNA一致,本文也是如上观点。HBV前C区变异与慢性HBV感染者向终末期肝病发展密切有关[18-20],本文的观点与之一致。
总之,由于国产PCR试剂在灵敏性、准确性方面上存在缺陷,对于那些ALT水平异常、HBsAg效价较高、病情较重(特别是终末期肝病)的慢性HBV感染患者,国产PCR试剂检测血清HBV-DNA阴性仍有必要考虑HBV-DNA处于复制状态,此时COBAS系统不失为一个理想的选择。
[参考文献]
[1] 宋红丽. 乙型肝炎肝移植患者长期抗乙型肝炎病毒治疗的管理概述[J]. 实用器官移植电子杂志,2015,3(4):231-233.
[2] 谭昀,张咏梅,李伏君. 乙型肝炎HBV-DNA检出阳性率及病毒复制水平与乙型肝炎两对半模式间的关系分析[J]. 当代医学,2014,20(19):17-18.
[3] 科技部十二五重大专项联合课题组. 乙型肝炎病毒相关肝硬化的临床诊断、评估和抗病毒治疗的综合管理[J].中华消化杂志,2014,34(2):77-84.
[4] 张玥,田文君,刘义庆,等. 国产和进口荧光定量PCR试剂检测HBV-DNA的比对分析[J]. 检验医学与临床,2015, 12(2):147-148,150.
[5] 赵克开,缪晓辉. 乙型肝炎病毒DNA定量检测临床应用的若干问题与思考[J]. 中华传染病杂志,2014,32(6):321-324.
[6] 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015更新版)[J]. 胃肠病学,2016, 21(4):219-240.
[7] 周薇,胡爱荣. 荧光定量PCR与COBAS Taqman系统在血清HBV-DNA检测中的应用及临床意义[J]. 现代实用医学,2010,22(5):520-521.
[8] 沈弢,龙璐,邓中平,等. 新型国产乙型肝炎病毒核酸定量检测试剂的质量评价[J]. 中华检验医学杂志,2013, 36(3):280-285.
[9] 陈占国,周武,王忠永,等. 实时荧光PCR检测血HBV DNA的疑难结果分析及其对策[J]. 中华检验医学杂志,2013,36(3):217-221.
[10] 苏秋东,毕胜利. 慢性乙型肝炎感染自然史[J]. 中华实验和临床病毒学杂志,2012,26(6):494-496.
[11] 王菲,许爱玲,辛霞霞,等. 乙型肝炎患者血清HBeAg和抗-HBe与HBV DNA定量的关系[J]. 临床肝胆病杂志,2015,31(4):534-536.
[12] 陈凤萍,沈云峰,吳瑶,等. 335例乙型肝炎患者血清HBV-DNA定量与乙肝病毒标志物的相关性分析[J]. 江汉大学学报,2012,40(5):93-95.
[13] Ozdil B,Cosar AM,Akkiz H,et al. Negative correlation between viral load and HBsAg levels in chronic HBV-infected patients[J]. Arch Virol,2009,154(9):1415-1451.
[14] 徐敬轩,谢而付,黄骊瑁,等. 慢性乙型肝炎患者血清中HBeAg、HBsAg与HBV-DNA的关系[J]. 检验医学与临床,2010,21(7):2337-2340.
[15] 方红龙,吴金明,江宏峰,等. 慢性乙型肝炎患者外周血HBsAg与HBV DNA相关性分析[J]. 实用肝脏病杂志,2011,14(2):108-109.
[16] 李筠竹,张振华,张亚飞,等. 慢性乙型肝炎患者血清HBV DNA水平与HBsAg和HBeAg水平的相关性分析[J]. 实用肝脏病杂志,2012,15(3):220-222.
[17] Li BZ,Gao B,Ye LB,et al. Hepatitis B virus X protein(HBx) activates ATF6 and IRE1-XBP1 pathways of unfolded protein response[J]. Virus Research,2007,124(1-2):44-49.
[18] 佘为民,马张妹,王吉耀,等. 乙型肝炎病毒前C区、C启动子区、前S2区基因突变与慢性肝病的相关性[J]. 中华传染病杂志,2006,24(3):196-199.
[19] 江磊,易冬英,张伦理. 探讨前C区A1896变异与乙型肝炎病毒相关的进展性肝病的关系[J]. 实用临床医学,2010,11(6):1-4.
[20] 徐尧江,宋伟泉. HBV基本核心启动子区和前C区变异与肝病进展的关系[J]. 中华临床感染病杂志,2012, 5(4):253-256.
(收稿日期:2016-06-01)

