猪传染性胃肠炎病毒实时荧光定量PCR检测方法的建立及应用
李子祥,邵春艳,2*,徐 琦,孙 静,2,姜 胜,2,何海建,吴 媛,王晓杜,2,宋厚辉,2**
(1.浙江农林大学 动物科技学院,浙江 临安 311300; 2.浙江农林大学 动物健康检测中心,浙江 临安 311300;3.金华职业技术学院 农业与生物工程学院,浙江 金华 321007)
猪传染性胃肠炎病毒实时荧光定量PCR检测方法的建立及应用
李子祥1,邵春艳1,2*,徐 琦1,孙 静1,2,姜 胜1,2,何海建3,吴 媛3,王晓杜1,2,宋厚辉1,2**
(1.浙江农林大学 动物科技学院,浙江 临安 311300; 2.浙江农林大学 动物健康检测中心,浙江 临安 311300;3.金华职业技术学院 农业与生物工程学院,浙江 金华 321007)
针对猪传染性胃肠炎病毒(TGEV)S基因的保守序列设计引物,以TEGV疫苗毒株为模板,克隆S基因,并构建重组阳性质粒,优化反应体系和扩增条件,建立基于SYBR Green Ⅰ染料的实时荧光定量PCR检测方法,并对其特异性、重复性和灵敏度进行分析。结果显示:建立的检测方法灵敏度可达10拷贝/μL,标准曲线线性关系良好 (r=0.997),扩增效率高,具有良好的特异性和重复性。使用该方法对124份临床疑似TGEV病料进行检测,阳性样本有17份,检测样本的阳性率为13.7%。该方法可用于兽医临床上TGEV的快速检测和流行病学分析。
猪传染性胃肠炎; 实时荧光定量PCR; 特异性; 敏感性
猪传染性胃肠炎(TGE)是由冠状病毒科的猪传染性胃肠炎病毒(TGEV)引起的一种高度接触性胃肠传染病,主要侵害仔猪,病猪表现为呕吐、严重腹泻、脱水及迅速消瘦等症状,其中,2周龄以内仔猪患病后死亡率可达100%。世界动物卫生组织(OIE)将其列为B类疫病中必须检疫的猪传染病[1]。我国最早于1956年在广东报道该病,目前,TGE在全国各地均有发生,个别养殖场TGE发病率甚至高达72.5%[2],给养猪业造成了严重的经济损失。随着集约化养殖程度的提高,该病的发生呈明显加重的趋势,且常与猪流行性腹泻病毒(PEDV)和猪轮状病毒(RV)等混合感染[3-4],使得病情更加严重,而单纯依靠临床症状很难对该病进行鉴别诊断。因此,急需建立一种快速、灵敏和特异的检测方法,为TGEV的实验室诊断提供依据。
目前,针对TGEV的核酸检测方法,农业部于2015年出台了TGEV诊断技术标准(SN/T 548—2015),辽宁、江苏和广西等省也出台一些地方检测标准,但这些标准采用的检测方法均是普通PCR方法,操作繁琐、耗时长、灵敏度低,不能满足目前临床检测的需求。实时荧光定量PCR是目前应用广泛的病原检测技术,该方法具有操作简单、灵敏度高、特异性好、可准确定量、不易产生交叉污染和检测过程短等优点。为此,针对TGEV的S基因序列上的保守区域设计荧光定量PCR引物,采用SYBR Green Ⅰ荧光染料检测方法,优化反应体系和扩增条件,建立针对TGEV的实时荧光定量PCR检测方法,以实现样品从核酸到结果判定的一步法检测,旨在为TGEV的临床诊断、疫病监控和流行病学调查等方面提供新的快速检测技术。
1 材料和方法
1.1 毒株
TGEV疫苗(华毒株)、PEDV疫苗(CV777株)、RV疫苗(NX株)、猪瘟病毒(classical swine fever virus,CSFV)疫苗(C株)、猪伪狂犬病毒(porcine pseudorabies virus,PRV)疫苗(Bartha-K61株)、猪圆环病毒2型(porcine circovirus type 2,PCV2)疫苗(LG株)均购自中国兽医药品监察所。
1.2 病料采集与保存
于浙江省各大规模化猪场采集呕吐、腹泻症状的仔猪粪便或病死猪的小肠内容物,共计124份,置于-80 ℃冷冻保存。
1.3 试剂
QIAamp Viral RNA Mini 和DNA提取试剂盒购于凯杰企业管理(上海)有限公司,肠道病毒核酸提取试剂盒购于苏州天隆生物科技有限公司,DL2000 DNA Marker、pMD-18 T Simple载体、Reverse Transcriptase M-MLV、Taq酶、SYBR Premix ExTaq、One step SYBR primeScript RT-PCR 试剂盒购于宝生物工程(大连)有限公司,质粒小量提取试剂盒、DNA凝胶回收试剂盒、无水乙醇、氯化钠等化学药品均购于生工生物工程(上海)股份有限公司。
1.4 主要仪器
生物样品均质器(Bertin Precellys 24)购自法国Bertin Technologies公司,荧光定量PCR仪(Agilent MX3000P)购自安捷伦科技(中国)有限公司,高速冷冻离心机(Eppendorf 5415R)和梯度PCR仪器(Eppendorf Mastercycler pro)购自Eppendorf公司,紫外凝胶成像系统(UVP EC3)购自上海玉博生物科技有限公司,全自动核酸提取仪(NP968)购自苏州天隆生物科技有限公司。
1.5 方法
1.5.1 引物设计与合成 根据GenBank公布的TGEVS基因序列,用Primer Express 3.0软件进行生物信息学分析并设计引物,引物由苏州金唯智生物科技有限公司合成,上游引物TGEV-F序列:5′-CTCACCACCTACTACCACCACAGA-3′,下游引物TGEV-R序列:5′-CTAGCACCATGTAAATAAGCAACAACCTC-3′,预期扩增片段长度为175 bp。
1.5.2 疫苗株病毒和临床腹泻样品的核酸提取及RNA反转录 参照QIAamp Viral RNA Mini 试剂盒说明书,提取TGEV、PEDV、RV和CSFV各疫苗株的总RNA,参照DNA提取试剂盒说明书提取PCV-2和PRV疫苗的DNA,临床组织病料参照肠道病毒核酸提取试剂盒说明书,用全自动核酸提取仪提取其核酸样品,分别取2 μL进行浓度/纯度测定,置于-80 ℃保存备用。参照Reverse Transcriptase M-MLV的说明,分别将各疫苗株提取的TGEV、PEDV、RV、CSFV和PRV 总RNA反转录为cDNA,反应程序:37 ℃ 15 min,98 ℃ 5 min,4 ℃保存,反转录后的cDNA置于-20 ℃保存备用。
1.5.3 实时荧光定量PCR检测方法的建立
1.5.3.1 标准阳性质粒的制备 按1.5.2方法,以合成的TGEV cDNA为模板(DEPC H2O为阴性对照),以1.5.1合成的引物进行PCR扩增。扩增产物经琼脂糖凝胶电泳鉴定后,使用凝胶回收试剂盒回收目的片段,并连接到pMD-18 T Simple载体上。连接产物转化到DH5α感受态细胞中,提取质粒并对重组质粒进行PCR和测序验证。对测序验证正确的重组质粒用微量分光仪测定质粒浓度,根据公式计算质粒拷贝数,并进行10倍梯度稀释,含量分别为1×108~1拷贝/μL,作为实时荧光定量PCR方法的阳性标准品,用于标准曲线的绘制和灵敏度的测定。
1.5.3.2 实时荧光定量PCR扩增 参考SYBR Premix ExTaq推荐的反应体系,以1×104拷贝/μL阳性质粒作为模板,模板含量和PCR体系总体积不变,采用矩阵法优化上下游引物浓度,采用梯度PCR优化退火温度,获得最佳反应体系和反应程序。
1.5.3.3 实时荧光定量PCR标准曲线的建立 以1×108~10拷贝/μL的阳性质粒为模板,以1.5.3.2优化好的反应体系和反应程序进行荧光定量PCR扩增,得到扩增曲线和溶解曲线,Agilent MX3000P软件自动绘制标准曲线,计算出标准曲线方程、相关系数(r)及扩增效率(E)。
1.5.3.4 敏感性试验 以1×108~1 拷贝/μL的阳性质粒为模板,以1.5.3.2优化好的反应体系和反应程序进行荧光定量PCR扩增,以检出的最低稀释度对应的病毒拷贝数作为该检测方法的灵敏度。
1.5.3.5 特异性试验 将TGEV、PEDV、RV、CSFV、PRV、PCV-2疫苗株的cDNA或DNA,按照上述优化的条件进行荧光定量PCR,验证其特异性。
1.5.3.6 重复性试验 分别取1×102~1×104拷贝/μL的TGEV阳性标准品按上述实时荧光定量PCR法进行 3次重复测定,同一浓度设3个重复孔,以验证实时荧光定量PCR方法的稳定性和重复性。
1.5.4 临床样品的测定 利用建立的实时荧光定量PCR方法对124份临床腹泻样品进行TGEV病原检测,反应体系如下:2× One Step SYBR RT-PCR Buffer 10 μL、Enzyme Mix 0.8 μL、上游引物TGEV-F 0.4 μL(10 μmol/L)、下游引物TGEV-R 0.4 μL(10 μmol/L)、ROX 50× 0.4 μL、RNA 2 μL,加DEPC H2O至20 μL。反应程序为:反转录42 ℃ 5 min,95 ℃ 10 s;PCR扩增95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 60 s;60 ℃ 30 s;95 ℃ 30 s。同时分别设TGEV阳性质粒和DEPC H2O为阳性和阴性对照。
2 结果与分析
2.1 标准阳性质粒的构建
以TGEV疫苗株cDNA为模板进行PCR扩增,获得大小约175 bp的扩增产物,与预期结果一致(图1)。将目的片段切胶回收并连接到pMD-18 T Simple载体上,提取阳性质粒并测序。经序列比对,阳性质粒的测序结果与TGEV相应区域序列100%相同,命名该质粒为pSL371。

M.DL2000 DNA Marker;1.阴性对照;2、3.TGEV疫苗株
2.2 实时荧光定量PCR反应体系及反应程序的建立
分别对退火温度、引物浓度和扩增循环数等条件进行优化,结果表明,在退火温度为60 ℃、引物浓度为0.2 μmol/L、扩增循环数为40次时,荧光定量PCR扩增结果最佳。确定最终反应体系如下:2×SYBR PremixTaq10 μL、上游引物TGEV-F0.4 μL(10 μmol/L)、下游引物TGEV-R 0.4 μL(10 μmol/L)、ROX 50× 0.4 μL、cDNA 1 μL,加DEPC H2O至20 μL。反应程序为:预变性95 ℃ 30 s;扩增95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 60 s;60 ℃ 30 s;95 ℃ 30 s。
2.3 实时荧光定量PCR标准曲线
以10倍梯度稀释的重组质粒为模板,采用优化的TGEV实时荧光定量PCR反应条件进行扩增,Agilent MX3000P软件绘制标准曲线如图2所示,当TGEV阳性质粒含量为1×108~10 拷贝/μL时,标准曲线方程为Y=-2.767×logX+ 40.61,相关系数(r)=0.997,扩增效率(E)=129.8%,说明线性关系良好,可信度高。

图2 TGEV标准阳性质粒实时荧光定量PCR标准曲线
2.4 实时荧光定量PCR敏感性
以10倍梯度稀释的1×108~1 拷贝/μL重组质粒为模板,采用优化的荧光定量PCR反应条件进行扩增。结果显示,108~10 拷贝/μL病毒cDNA均有典型S型扩增曲线(图3),而1 拷贝/μL未出现典型的S型扩增曲线,溶解曲线峰狭窄单一,没有引物二聚体和非特异性产物等其他峰值出现,解链温度为81.3 ℃(图4),所以该方法对质粒cDNA检测灵敏度为10拷贝/μL。
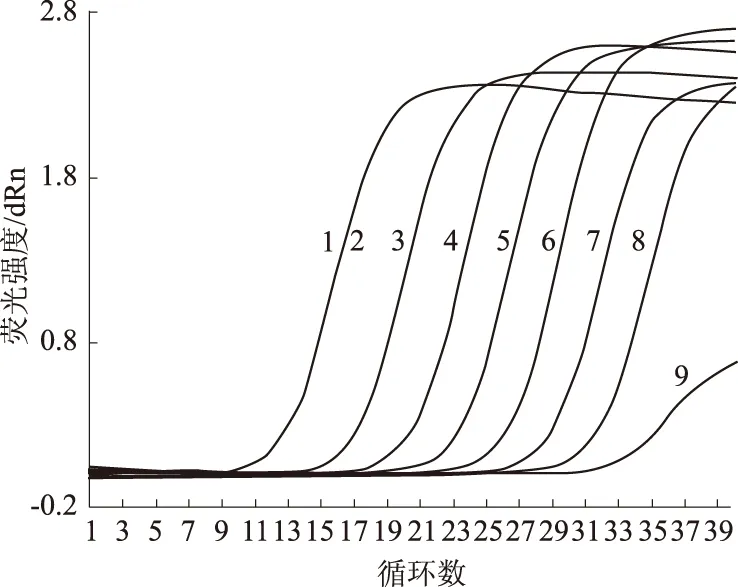
1—9分别表示模板为1×108~1 拷贝/μL

图4 TGEV实时荧光定量PCR敏感性溶解曲线
2.5 实时荧光定量PCR特异性
以TGEV、PEDV、RV、CSFV、PRV和PCV-2各疫苗株的总cDNA或DNA为模板进行荧光定量PCR检测,结果发现,仅TGEV出现特异性S型扩增曲线,其他病毒均未出现S型扩增曲线(图5),溶解曲线也只有TGEV有单峰出现,解链温度为81.5 ℃(图6),表明所建立的方法具有较强的特异性。
2.6 实时荧光定量PCR重复性试验结果
利用本研究建立的荧光定量PCR方法,分别取1×102、1×103、1×104拷贝/μL的TGEV阳性样品按上述荧光定量PCR法进行 3次重复测定(组间),同一含量设3个重复孔(组内),分别计算各含量组内和组间Ct值的变异系数。结果表明,各阳性样品组内与组间变异系数均小于5%(表1),表明该方法的重复性良好。
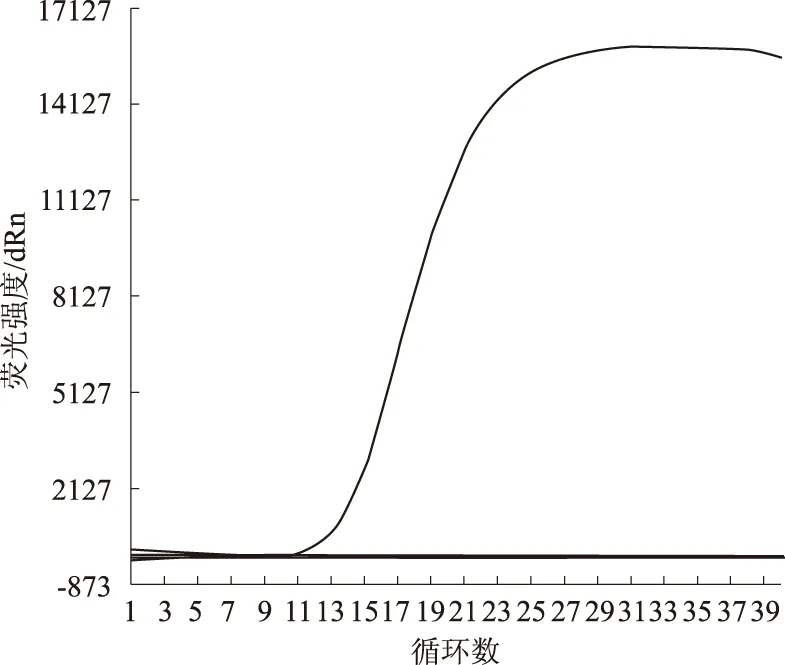
图5 TGEV实时荧光定量PCR特异性试验的扩增曲线

图6 TGEV实时荧光定量PCR特异性试验的溶解曲线
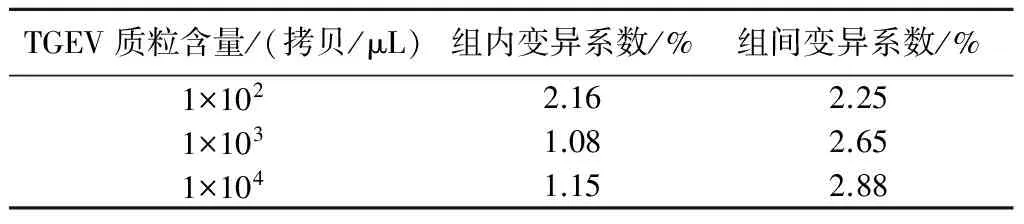
TGEV质粒含量/(拷贝/μL)组内变异系数/%组间变异系数/%1×1022.162.251×1031.082.651×1041.152.88
2.7 TGEV实时荧光定量PCR对临床样品的测定结果
利用上述建立的荧光定量PCR方法对临床采集的124份病猪组织样品进行TGEV的检测,结果显示(表2),样本中TGEV阳性率为13.7%(95%CI=8.2%~21.0%)。
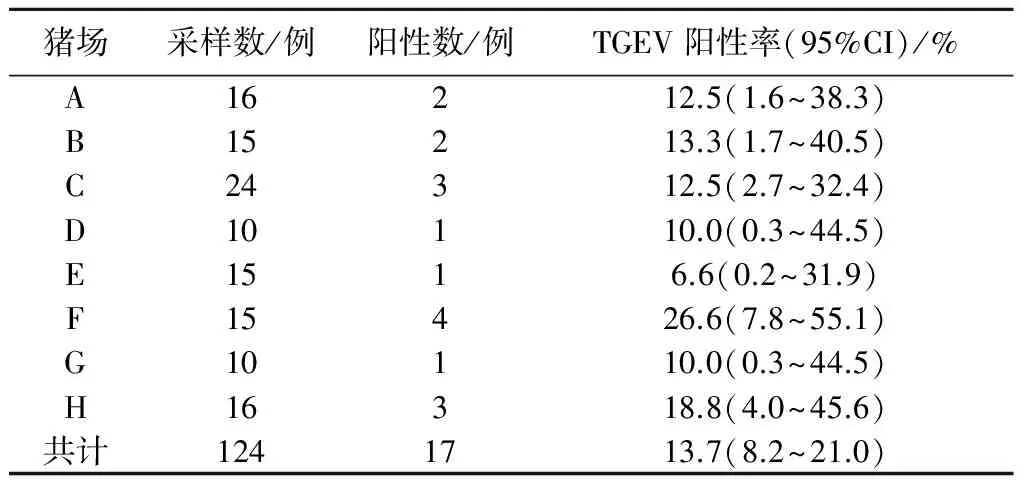
表2 荧光定量PCR检测124份猪病料结果
3 结论与讨论
TGE在我国流行广泛,主要引起2周龄以内仔猪的呕吐和严重腹泻,死亡率可高达100%,该病的发生和流行具有明显的季节性,传播速度快,对生猪养殖业造成了严重的经济损失[5]。临床上TGEV与PEDV、RV和德尔塔冠状病毒(PDCoV)等[6]混合感染的情况非常普遍,给疾病的鉴别诊断带来很大的困难。所以,建立一种快速、灵敏度高和特异性好的检测方法显得尤为重要。目前,TGEV常规检测鉴定方法有病毒分离鉴定、电镜观察、免疫电镜观察、ELISA、中和试验和核酸探针杂交等[7-9],郭容利等[10]、朱芬花[11]和张坤等[12]分别建立了TGEV的RT-PCR或者多重RT-PCR方法,但这些方法操作复杂、周期较长,不能很好地为临床检测提供服务。目前,动物疫病特别是病毒性疾病的实验室检测,最常用的定量PCR方法就是基于SYBR Green Ⅰ的荧光染料法和基于Taq Man的探针法,其中SYBR Green Ⅰ为一种结合于DNA小沟中的荧光染料,扩增之后,可以通过扩增曲线判断病原含量,根据溶解曲线识别扩增产物。
本研究建立的TGEV基于SYBR Green Ⅰ染料法实时荧光定量PCR检测方法,操作简单,使用商品化的一步法SYBR Green Ⅰ荧光定量检测试剂盒,就可以完成以样品RNA为模板的反转录和PCR扩增。与普通PCR相比,该方法采用高灵敏度的光电系统对SYBR Green Ⅰ荧光信号进行检测,实现在同一管内同时进行扩增和检测,不需要再开盖进行电泳检测,避免了样品交叉污染和溴化乙锭(EB)的使用。采用本检测方法在2~3 h内即可完成大批量样品的定量检测,有效提高了工作效率,减少了劳动量。本检测方法与PEDV、RV、PRV、CSFV、PCV2不发生交叉反应,对阳性质粒检测极限为10拷贝/μL,具有特异性强、灵敏度高、重复性好、操作简单、快速高效等优点,可用于TGEV感染的早期诊断或鉴别诊断,为TGEV流行病学监测提供技术支持。
[1] Zhao S,Gao J,Zhu L,etal.Transmissible gastroenteritis virus and porcine epidemic diarrhoea virus infection induces dramatic changes in the tight junctions and microfilaments of polarized IPEC-J2 cells[J].Virus Res,2014,192(4):34-45.
[2] 蒋静,李健,胡永强,等.上海等4省市动物冠状病毒的流行病学调查[J].畜牧与兽医,2007,39(12): 50-52.
[3] Lin CM,Gao X,Oka T,etal.Antigenic relationships among porcine epidemic diarrhea virus and transmissible gastroenteritis virus strains[J].J Virol,2015,89(6): 3332-3342.
[4] 吕兴华.猪传染性胃肠炎和流行性腹泻的鉴别[J].山东畜牧兽医,2016,20(1):71.
[5] 李同雪.规模化猪场主要病毒性腹泻流行现状及防控对策[J].河南畜牧兽医(综合版),2016,37(4): 26-28.
[6] 陈建飞,王潇博,焦贺勋,等.国内首株猪德尔塔冠状病毒Porcine deltacoronavirus的分离鉴定[J].中国预防兽医学报,2016,38(3):171-174.
[7] 张蕾,董毅.猪传染性胃肠炎病毒感染机理的研究进展[J].现代畜牧兽医,2009(7):79-82.
[8] 周燕,王建超,华平,等.猪传染性胃肠炎病毒在ST 细胞中增殖规律的研究[J].中国兽医科技,2005,35(6):423-427.
[9] 谢立兰,方六荣,方华为,等.免疫学和分子生物学技术在猪传染性胃肠炎诊断中的应用进展[J].中国兽药杂志,2016,50(2):56-62.
[10] 郭容利,何孔旺,倪艳秀,等.PEDV、TGEV、PRV多重 RT-PCR检测方法的建立及其应用[J].江苏农业学报,2013,29(5):1065-1069.
[11] 朱芬花.应用RT-PCR检测猪传染性胃肠炎病毒的研究[J].中国畜牧兽医,2012,39(4):91-93.
[12] 张坤,何启盖.猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒多重RT-PCR检测方法的建立及临床应用[J].畜牧兽医学报,2010,41(8):1001-1005.
Development and Application of Real Time Fluorescence Quantitative PCR for Transmissible Gastroenteritis Virus Detection
LI Zixiang1,SHAO Chunyan1,2*,XU Qi1,SUN Jing1,2,JIANG Sheng1,2,HE Haijian3, WU Yuan3,WANG Xiaodu1,2,SONG Houhui1,2**
(1.College of Animal Science and Technology,Zhejiang A & F University,Lin’an 311300,China;2.Animal Health Inspection Center,Zhejiang A & F University,Lin’an 311300,China;3.School of Agriculture and Biological Engineering,Jinhua Polytechnic,Jinhua 321007,China)
In this study,a real-time PCR method was developed for TGEV detection using SYBR Green I dye.The primers were designed according to the conserved region of TGEVSgene.The specific sequence was cloned using the attenuated TGEV strain as a template.The positive recombinant plasmid was constructed.The amplification system and conditions of real time PCR was optimized.Then the sensitivity,specificity and repeatability of this assay were analyzed.The results showed that the sensitivity of this assay was 10 copies/μL of cDNA plasmid,the correlation co-efficient of the standard curve was 0.997.A total of 124 clinical samples were tested by this method,with 17 positive results.The positive rate of TGEV was 13.7%.In conclusion,this method provided a technical support for laboratory diagnostic and epidemiological survey of TGEV.
transmissible gastroenteritis virus(TGEV); real-time fluorescence quantitative PCR; specificity; sensitivity
2016-09-26
浙江省公益性研究农业项目(2016C32065);金华市重点研发项目(2014-2-003,2016-2-013);浙江农林大学人才启动项目(2012FR047);浙江省大学生新苗人才项目(2016R412008)
李子祥(1995-),浙江台州人,在读本科生,研究方向:动物预防医学。E-mail:526874501@qq.com *表示同等贡献作者
**通讯作者:宋厚辉(1975-),山东青岛人,研究员,博士,主要从事动物预防医学与公共卫生方面的研究。 E-mail:songhh@zafu.edu.cn
S855.3
A
1004-3268(2017)03-0129-05

