生物炭与甲壳素配施对连作平邑甜茶幼苗及土壤环境的影响
王艳芳,相立,徐少卓,王森,王晓伟,陈学森,毛志泉,张民
(1山东农业大学化学与材料科学学院,山东泰安 271018;2山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018;3枣庄科技职业技术学院,山东枣庄 277500;4山东农业大学资源与环境学院,山东泰安 271018)
生物炭与甲壳素配施对连作平邑甜茶幼苗及土壤环境的影响
王艳芳1,相立2,徐少卓2,王森2,王晓伟3,陈学森2,毛志泉2,张民4
(1山东农业大学化学与材料科学学院,山东泰安 271018;2山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018;3枣庄科技职业技术学院,山东枣庄 277500;4山东农业大学资源与环境学院,山东泰安 271018)
【目的】研究生物炭与甲壳素配施对连作条件下平邑甜茶幼苗生物量、根系呼吸速率、根系保护酶和土壤环境的影响,为防治苹果连作障碍提供依据。【方法】盆栽条件下,以苹果常用砧木-平邑甜茶为试材,试验设苹果连作土壤作为对照(CK),用1‰甲壳素(w/w,T1)、2%生物炭(w/w,T2)、1‰甲壳素+2%生物炭(T3)以及溴甲烷灭菌(T4)处理苹果连作土壤,共5个处理。采用常规方法测定不同处理对平邑甜茶幼苗生物量、根系呼吸速率及根系抗氧化酶活性的影响,同时用末端限制性片段长度多态性(T-RFLP)和实时荧光定量PCR测定不同处理土壤中真菌群落结构和尖孢镰刀菌数量。【结果】T3和T4可显著增加平邑甜茶幼苗株高、地茎和干鲜重,T3使平邑甜茶幼苗的株高、地径、鲜重、干重分别增加了44.6%、33.0%、76.8%和77.1%,T4各指标分别增加了73.1%、76.9%、117.0%和123.7%;与对照相比,不同处理均使根系呼吸速率明显提高,T1、T2、T3和T4处理的幼苗根系呼吸速率分别是对照的1.37、1.70、1.87和2.02倍;T4处理超氧化物歧化酶(SOD)活性最高,其次为T3处理,T2和T1处理也增加了SOD活性,所有处理都与对照达到了显著差异;过氧化物酶(POD)和过氧化氢酶(CAT)活性变化与SOD变化趋势一致,T4处理根系POD和CAT活性分别为对照的2.68和2.64倍,其次为T3,3种酶活分别为对照的2.52和2.18倍;与对照相比,T2、T3和T4均可显著降低根系丙二醛(MDA)的含量,分别为对照的82.0%、61.9%和43.1%。T2和T3明显提高细菌数量,细菌/真菌比值分别是对照的1.7和2.2倍,溴甲烷灭菌(T4)则使土壤中的细菌、真菌显著降低,但是真菌降低的数量大于细菌的,因此,细菌/真菌比值高于对照;T4具有最高的多样性、丰富度和均匀度指数,分别比对照增加了24.4%、41.3%和13.6%,其次是T3处理;溴甲烷灭菌、生物炭配施甲壳素处理土壤中尖孢镰刀菌基因拷贝数均显著低于连作土,说明连作土壤中尖孢镰刀菌为主的有害真菌数量明显减少;与对照相比,T3土壤中根皮苷、根皮素、肉桂酸、对羟基苯甲酸和间苯三酚含量分别降低了28.1%、30.6%、50.8%、33.6%和46.2%。【结论】生物炭与甲壳素配施相较于单施生物炭或者甲壳素,能更好的提高连作条件下平邑甜茶幼苗的生物量、根系呼吸速率和根系保护酶活性。并且二者配合施用优化了连作土壤的真菌群落结构,增加了土壤细菌/真菌比值,降低了土壤中尖孢镰刀菌基因拷贝数,减少了酚酸类物质含量。因此,生物炭配施甲壳素能更好地缓解苹果连作障碍。
苹果连作障碍;生物炭;甲壳素;平邑甜茶幼苗
0 引言
【研究意义】苹果连作障碍是制约苹果产业可持续发展的瓶颈之一。随着苹果树龄的老化,果园需要不断更新,受土地资源的限制,在更新的果园中,尤其是传统优势栽培地区的苹果园,必然存在着新建果园的连作,进而面临连作障碍的发生。前人研究认为连作土壤中的有害微生物[1-3]和酚酸类物质[4-6]是引起苹果连作障碍的两个重要因素。生物炭可吸附土壤中的酚酸类物质[7],而甲壳素能抑制、灭杀病原菌[8]。因此,研究二者复合施用减轻苹果连作障碍的效果,对指导苹果抗连作障碍栽培具有重要意义。【前人研究进展】土壤中酚酸类物质的积累是导致苹果发生连作障碍的一个重要原因,这些酚酸类物质包括根皮苷、苯甲酸、对羟基苯甲酸、根皮素、丁香酸、香草酸、咖啡酸和阿魏酸等[4,6]。土壤浓度的根皮苷、根皮素、肉桂酸及对羟基苯甲酸能明显抑制苹果幼苗根系发育,破坏根系线粒体功能[4-5];王青青等[6]研究证明一定浓度根皮苷可降低TCA循环中相关酶活性,导致苹果幼苗根系呼吸速率下降。土壤微生物种群结构、数量以及比例失调,土传病害加重是引起苹果连作障碍的另一个重要原因[1-2]。苹果连作后,根际促生菌(PGPR)的多样性、丰富度、均匀度等大大降低,即土壤微生物环境变差[1];用T-RFLP技术分析苹果连作土壤中真菌群落结构,发现连作土壤中对病原菌有抑制作用的木霉菌属(Trichoderma)数量大大降低,真菌群落结构明显变化,使得苹果根系易感染腐霉病[3]。种植前进行土壤溴甲烷熏蒸消除土传病原菌,是国内外公认的防控苹果连作障碍的最佳措施,但溴甲烷污染环境且对人体有害,已被禁止使用。轮作和选育抗性砧木也是行之有效的防控苹果连作障碍的措施,但其耗时太长。【本研究切入点】生物炭具有较大的比表面积和孔隙,对土壤中的农药残留、多环芳烃和酚酸类物质都有很好的吸附效果[7,9-10]。甲壳素及其水解产物壳聚糖可以改善土壤结构,抑制病原菌生长[8],二者单一施用都能在一定程度上缓解苹果连作障碍[7,11],但关于二者配施是否可以更显著地改善苹果连作土壤环境,促进幼苗生长,减轻苹果连作障碍现象等未见报道。【拟解决的关键问题】本研究以苹果连作土壤为对照,溴甲烷灭菌的连作土壤为高标准参照,研究生物炭和甲壳素配合施用对连作条件下盆栽平邑甜茶幼苗的生物量、根系呼吸速率、土壤真菌群落结构和尖孢镰刀菌数量的影响,探索能替代溴甲烷的技术措施,以期为防控苹果连作障碍提供理论依据和技术参考。
1 材料与方法
试验于2014年3—10月在山东农业大学园艺科学与工程学院南校区试验站进行。
1.1 试验材料
供试材料为平邑甜茶(Malus hupehensisRehd.),于2014年4月30日选取长势一致的6片真叶幼苗,移栽至装有7.0 kg苹果连作土的泥瓦盆中(外径29 cm,内径25 cm,深20 cm)。
生物炭采用炭化稻壳,购自安徽宣城家乐米业有限公司。甲壳素购自济南阿波罗甲壳素肥业有限公司。
试验用土取自山东省泰安市岱岳区夏张镇王小庄村25年生苹果园,砧木为八棱海棠(M.micromalus),土壤类型为棕壤土。土壤有机质含量为5.94 g·kg-1,速效磷95.68 mg·kg-1,速效钾41.33 mg·kg-1,铵态氮2.46 mg·kg-1,硝态氮12.77 mg·kg-1,土壤pH为6.17。收集距树干1 m、深5—40 cm范围内的连作土壤,多点取样混匀使用。
1.2 试验设计
试验共设置5个处理:连作土(CK)、1‰ 甲壳素(w/w, T1)、2%生物炭(w/w, T2)、1‰甲壳素+2%生物炭(T3)、连作土溴甲烷熏蒸(T4)。每个处理15盆,每盆定植幼苗2株。于2014年8月12日采样,测定植株生物量、根系保护酶活性、丙二醛(MDA)含量,以及相应的土壤环境。每个处理取9盆,3个生物学重复。去掉表层土和盆周围的土,将土混匀装入黑色塑料袋带回实验室,过2 mm筛,取大约500 g土装入封口袋,用于土壤微生物和酚酸类物质的测定。
1.3 测定项目与方法
1.3.1 根系呼吸速率 采用Oxy-Lab氧电极自动测定系统[12]测定根系呼吸速率。
1.3.2 丙二醛(MDA)含量 用分光光度法分别测定反应产物在600、532和450 nm下的吸光度,计算MDA含量[13]。
1.3.3 根系保护性酶活性 超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法测定[7];过氧化物酶(POD)的活性测定按OMRAN[14]的方法;过氧化氢酶(CAT)的活性按照赵世杰[13]的方法。
1.3.4 土壤微生物数量 土壤细菌、真菌、放线菌均用平板涂抹法测定,测定前计算水分系数。 细菌采用牛肉膏蛋白胨培养基,真菌采用马丁氏培养基,放线菌采用高氏一号培养基[15]。
1.3.5 土壤总DNA和T-RFLP分析 参照尹承苗等[16]的方法。
1.3.6 土壤中尖孢镰刀菌数量 根据苹果尖孢镰刀菌菌株测序结果,在GenBank进行Blast同源比对,根据NCBI基因库中尖孢镰刀菌保守序列用Premer Premier5.0软件设计PCR引物,正向引物序列:GTGAACATACCACTTGTTGCCTC,反向引物序列:GAGTCCCAACACCAAGCTGTG,送上海生工生物工程技术服务有限公司合成。按照赵永坡等[17]的方法测定不同处理土壤中尖孢镰刀菌的基因拷贝数。
1.3.7 土壤酚酸类物质含量 准确称取过12目筛的风干土壤80 g,加入适量硅藻土,于烧杯中混合均匀。按照WANG等[7]的方法进行提取测定。
1.4 数据处理
试验数据采用Microsoft Excel 2003进行数据整理,SPSS 19.0软件进行方差和显著性检测分析。
2 结果
2.1 不同处理对平邑甜茶幼苗干鲜重的影响
由表1可以看出,T3和T4可显著增加平邑甜茶幼苗株高、地茎和干鲜重。T3使平邑甜茶幼苗的株高、地径、鲜重、干重分别比对照增加了44.6%、33.0%、76.8%和77.1%;T4各指标分别增加了73.1%、76.9%、117.0%和123.7%。与对照相比,T1和T2也不同程度的促进了幼苗的生长,但是其效果不如T4处理效果好。
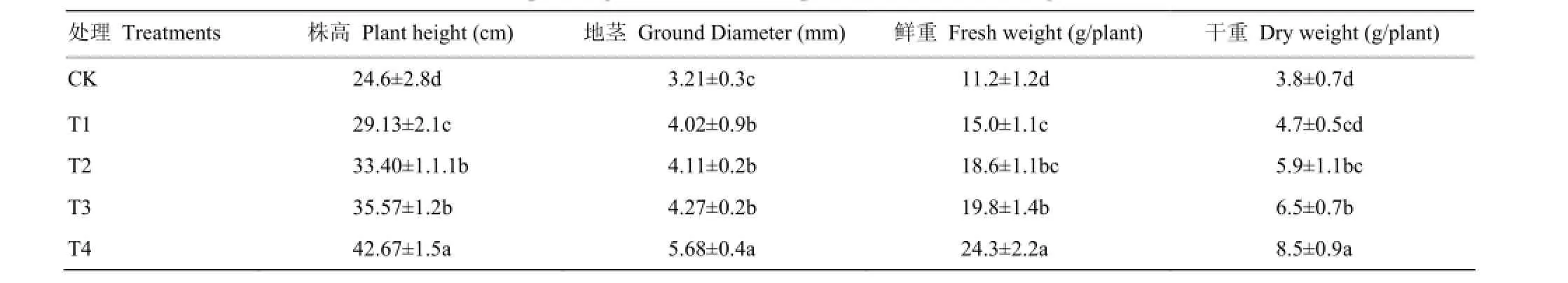
表1 不同处理对平邑甜茶幼苗生物量影响Table 1 Effects of different treatments on planting biomass of M. hupehensis Rehd. seedlings
2.2 对幼苗根系呼吸速率的影响
图1显示,CK、T1、T2、T3和T4处理的平邑甜茶幼苗根系呼吸速率分别为0.1593、0.219、0.2713、0.2978和0.3212 μmol O2·min-1·g-1FW,T1、T2、T3和T4处理的平邑甜茶幼苗根系呼吸速率分别是对照的1.37、1.70、1.87和2.02倍。
2.3 对幼苗根系保护酶SOD、POD、CAT活性和MDA含量的影响
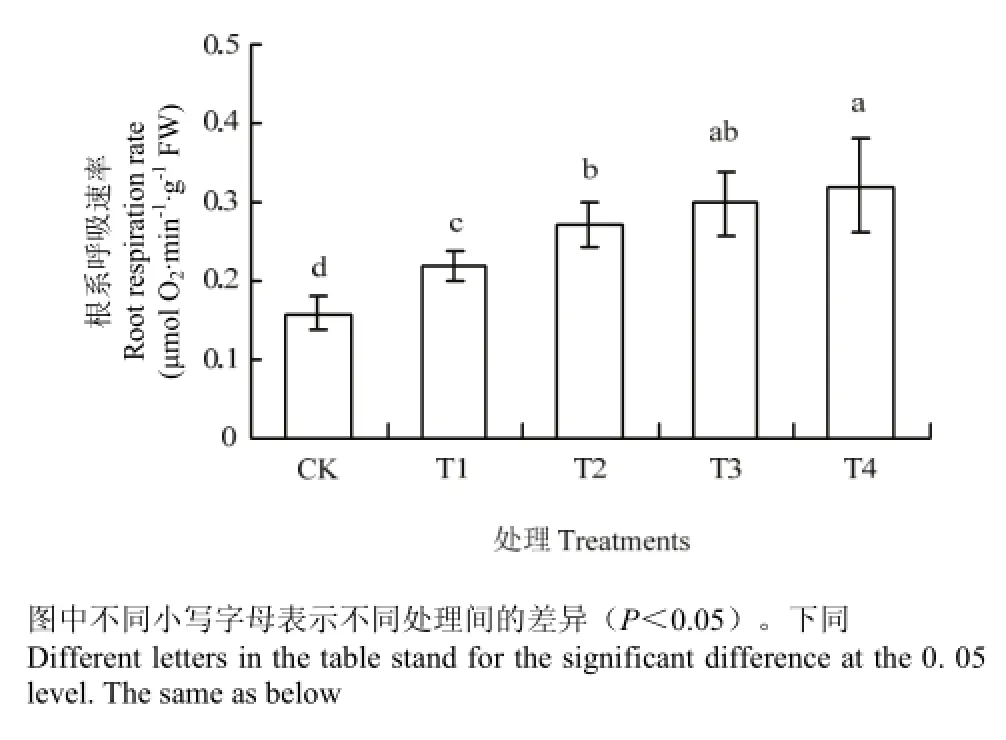
图1 不同处理对平邑甜茶幼苗根系呼吸速率的影响Fig. 1 Effects of different treatments on the respiration rate of seedling roots

图2 不同处理对平邑甜茶幼苗根系保护酶活性和MDA的影响Fig. 2 Effects of different treatments on the antioxidant enzyme activities and the MDA content in root of seedlings
由图2可以看出,不同处理对平邑甜茶幼苗根系SOD活性影响大小不一,其中以T4处理SOD活性最高,其次为T3,T2和T1处理也增加了SOD活性,并与对照达到了显著差异;POD和CAT活性变化与SOD变化趋势一致,均表现为T4使根系抗氧化酶活性最高。SOD、POD和CAT活性分别为对照的1.34、2.68和2.64倍;其次为T3,3种酶活分别为对照的1.21、2.52和2.18倍。与对照相比,T2、T3和T4均可显著降低根系MDA的含量,分别为对照的82.0%、61.9%和43.1%。
2.4 对土壤微生物数量的影响
由图3可以看出,连作土壤中单施甲壳素(T1),细菌和真菌数量都有所减少,但细菌/真菌比值比对照明显提高;而生物炭(T2)以及甲壳素和生物炭二者复合配施(T3)明显提高细菌数量,细菌/真菌比值分别是对照的1.7和2.2倍。溴甲烷灭菌(T4)则使土壤中的细菌、真菌显著降低,但是真菌降低的数量大于细菌,因此,细菌/真菌比值显著高于对照。
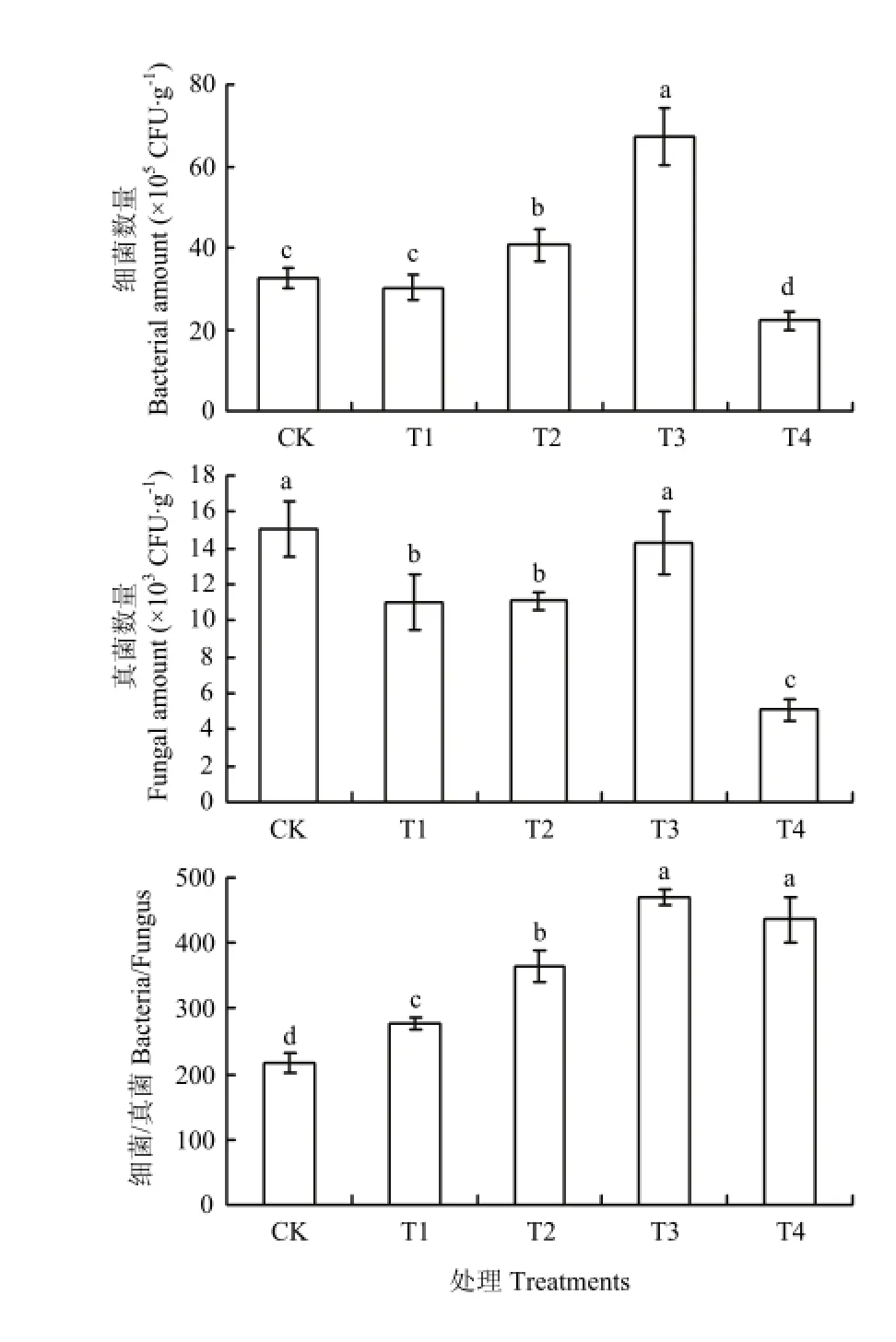
图3 不同处理对土壤微生物数量的影响Fig. 3 Effects of different treatments on soil microorganisms
2.5 对土壤真菌多样性的影响
根据T-RFLP的图谱中OUT的数量、种类及丰度,分别计算了不同处理土壤的真菌多样性指数(表2)。与对照相比,T1和T2使连作土壤中真菌的多样性(香浓指数)、丰富度和均匀度明显升高,但效果不如T3和T4。T4具有最高的多样性、丰富度和均匀度指数,分别比对照增加了24.4%、41.3%和13.6%,其次是T3处理。辛普森指数是土壤中微生物优势度的衡量指标,它与多样性指数成倒数关系,所以,T4具有最低的辛普森指数。
2.6 对土壤中尖孢镰刀菌基因拷贝数的影响
采用实时荧光定量 PCR 技术对不同处理下尖孢镰刀菌基因拷贝数进行测定(图4)。结果表明,溴甲烷灭菌、生物炭配施甲壳素处理土壤中尖孢镰刀菌基因拷贝数均显著低于连作土,说明连作土壤中尖孢镰刀菌为主的有害真菌数量明显减少。
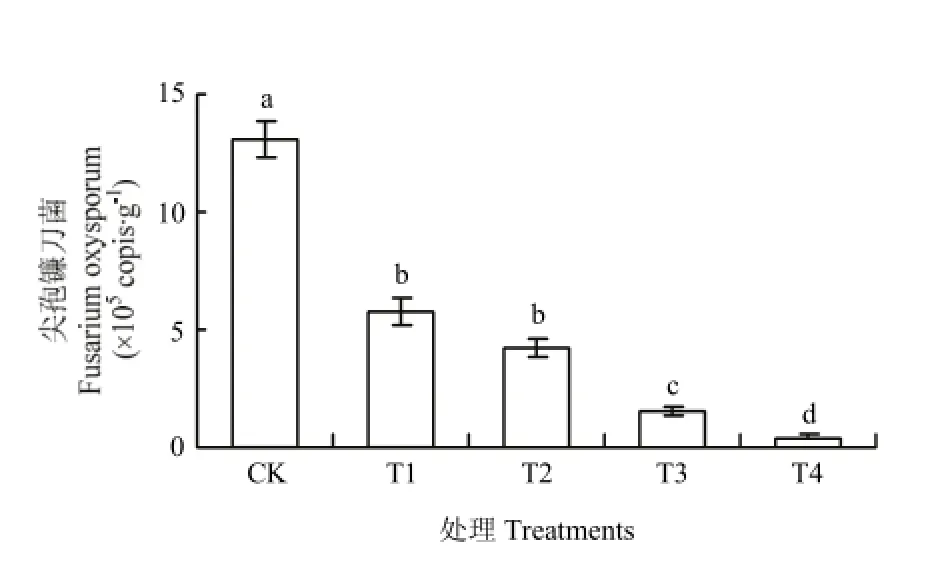
图4 不同处理对土壤尖孢镰刀菌基因拷贝数的影响Fig. 4 Effects of different treatments on the copies of Fusarium oxysporum
2.7 对土壤中酚酸类物质含量的影响
由表3可以看出,连作条件下,土壤中的酚酸类物质含量是最高的,而溴甲烷灭菌和甲壳素处理对土壤中酚酸类物质含量的影响不明显。生物炭处理以及生物炭配施甲壳素处理可明显降低土壤中酚酸类物质的含量,但两种处理之间根皮苷等酚酸含量差异不明显。与对照相比,T3土壤中根皮苷、根皮素、肉桂酸、对羟基苯甲酸和间苯三酚含量分别降低了28.1%、30.6%、50.8%、33.6%和46.2%。
3 讨论
苹果连作障碍的发生具有普遍性,随着苹果矮化密植栽培模式的建立,苹果树生命周期缩短,品种更新加快,老果园、苗圃的更新和连作栽培在所难免,这使得苹果连作障碍问题越来越突出。引起连作障碍的原因复杂多样,主要有微生物群落结构失衡[1],特别是有害真菌数量剧增[18]以及酚酸类化感物质积累等[4]。越来越多的研究者认为,导致作物连作障碍的因素之间存在协同作用。ZHOU等[19]将酚酸物质添加至土壤中后,进行黄瓜重茬栽培发现,土壤中有益微生物菌群数量大大减少,而尖孢镰刀菌和疫霉菌等病原菌数量呈持续上升趋势。ZHANG等[20]研究发现黄瓜根系分泌的酚酸类物质能促进尖孢镰刀菌(Fusarium oxysporum)孢子萌发。土壤中有害微生物的增多又会促进根系分泌更多的酚酸类物质。因此,缓解连作障碍的措施主要集中于灭杀土壤中有害微生物或者降低土壤中酚酸类物质。目前,土壤化学消毒法(如溴甲烷消毒)是国内外公认的防治连作障碍有效措施,但因其污染环境且对人体有害,逐步被禁止使用。大量研究表明,绿肥、壳质粗粉、秸秆稻壳等植物残体、堆肥、粪肥和生物炭等土壤添加剂[7,21-23]有利于提高土壤养分,降低土壤中有害物质,改善土壤的微生物体系以及团粒结构,提高土壤质量,增强土壤生态系统的稳定性,降低连作土壤中农作物病害的发生,从而缓解连作障碍。甲壳素在农业生产上可被作为植物病害抑制剂、植物生长调节剂以及农药载体和种衣剂等[22],可显著增加连作条件下平邑甜茶幼苗生物量,提高幼苗抗性[11]。生物炭具有较大的比表面积和孔隙,含有丰富的有机碳及矿物营养元素[24],因此,其既可吸附土壤中的重金属离子和有机污染物[7,10,25],又可调控土壤微生物结构,抑制病原菌[26-27],进而提高作物的生物量。本试验中,单施生物炭、甲壳素均能提高平邑甜茶幼苗株高、地茎和干鲜重,而二者复合施用效果更好。生物炭配施甲壳素对连作条件下苹果幼苗的促进作用仅次于溴甲烷土壤消毒的效果。这可能一方面是甲壳素对土壤中有害微生物有一定的抑制作用;另一方面生物炭不仅自身能调控土壤微生物,而且还能通过吸附土壤中的有害酚酸类物质,减少有害微生物赖以生存的食源,进而降低土壤有害真菌的数量。

表2 对土壤真菌多样性的影响Table 2 Effects of different treatments on the soil fungal diversity

表3 对土壤中酚酸类物质的影响Table 3 Effects of different treatments on the concentration of phenolic compounds in soil
根系呼吸作用是植株地下部代谢的中心,它对根系更新、养分的吸收以及植株生长发育具有重要意义。根系总呼吸速率变化趋势因胁迫大小及时间而不同,通常较轻微胁迫会刺激植物的根系呼吸,而长时间处于严重的胁迫条件下会明显降低[12]。POD、CAT、SOD是保护酶系统的主要酶,在植物遭受逆境时,SOD、POD和CAT等保护酶可通过清除活性氧等自由基来减轻对植物细胞膜的伤害作用,进而提高植物细胞对逆境胁迫的抵抗力[5]。本试验发现生物炭与甲壳素配施的平邑甜茶幼苗根系呼吸速率仅次于溴甲烷熏蒸处理,明显高于连作对照;同时二者配合施用可明显提高根系SOD、POD和CAT活性,并且降低MDA含量。这表明生物炭配施甲壳素,可显著减轻连作障碍对苹果幼苗的胁迫。结合前人研究结果[7,24,26-27]推测,一方面可能是生物炭吸附了部分酚酸类化合物,降低了其有害浓度;另一方面可能与甲壳素和生物炭抑制土壤病原菌有关。二者配施很好的改善了土壤环境,有利于提高根系的生理功能。
作物连作后土壤微生物区系发生明显变化,主要表现为土壤微生物种群结构、数量以及比例失调,土传病害加重,某些病原菌微生物数量急剧增加,有益微生物大大减少,打破了原有的根际微生态平衡[1]。甲壳素是一类天然多糖类高分子化合物,对真菌有抑制作用[28],其降解液中的几丁质酶对病原真菌也有抑制作用[29];生物炭的特殊孔隙结构和物质组成,使其能改善土壤结构,促进土壤微团聚体的形成,促进微生物种群发展,提高微生物活性。研究表明1%的桉木生物炭和0.5%的温室废弃物生物炭能显著抑制黄瓜土壤中的立枯丝核菌,促进黄瓜的生长发育[27],在芦笋连作土壤中添加生物炭后,丛枝菌根大量繁殖,而由尖孢镰刀菌引起的芦笋根腐病和冠腐病大大降低[26]。本研究采用平板涂布法结合T-RFLP、实时荧光定量PCR技术研究连作苹果园土壤中微生物数量、真菌群落结构及尖孢镰刀菌的基因拷贝数。结果发现,生物炭配施甲壳素能增加土壤中细菌数量,明显提高细菌/真菌值,使土壤类型由真菌型向细菌型转变。二者复合使用,提高了连作土壤中真菌的多样性、均匀度和丰富度,并且极大的降低了土壤中尖孢镰刀菌的基因拷贝数,使得连作土壤中病原菌数量减少,整个真菌群落结构往更利于幼苗生长的方向渐变。同时,生物炭还具有较强的吸附能力。蛇纹岩土中添加5%的木材生物炭,大大减少了土壤中生物可利用态铬(Cr)、镍(Ni)和锰(Mn),使得番茄生长率为对照的40倍之多[25];高比表面积、低可溶性有机碳含量的生物炭可有效吸附土壤中的灭草松等农药残留[10]。本试验中,生物炭、生物炭复合甲壳素处理的连作土壤中根皮苷、根皮素等有害酚酸类物质明显降低,推测是由于生物炭吸附了酚酸类物质,降低了这些化合物在土壤中的有效浓度。酚酸类物质含量的降低,既减少了这些化合物对苹果幼苗的毒害作用[4],又减少了有害微生物的食源,因此使苹果幼苗生物量较对照明显增加。
4 结论
生物炭与甲壳素配合施用可显著提高连作条件下平邑甜茶幼苗的生物量、根系呼吸速率和根系保护酶活性,降低连作土壤中根皮苷等酚酸类物质的含量,减少连作土壤中有害真菌的数量,尤其是尖孢镰刀菌的基因拷贝数。生物炭与甲壳素配施能缓解苹果连作障碍,效果明显高于单施生物炭或者甲壳素,并接近于溴甲烷熏蒸处理,且其环保绿色无污染。因此,在老果园更新建立连作果园时,可考虑用生物炭与甲壳素配施替代溴甲烷熏蒸技术。
[1] GUO H, MAO Z, JIANG H, LIU P, ZHOU B, BAO Z, SUI J, ZHOU X, LIU X. Community analysis of plant growth promoting rhizobacteria for apple trees.Crop Protection, 2014, 62: 1-9.
[2] YIM B, WINKELMANN T, DING G C, SMALLA K. Different bacterial communities in heat and gamma irradiation treated replant disease soils revealed by 16S rRNA gene analysis-contribution to improved aboveground apple plant growth?Frontiers in microbiology, 2015: 6.
[3] WEERAKOON D M N, REARDON C L, PAULITZ T C, IZZO A D, MAZZOLA M. Long-term suppression ofPythium abappressoriuminduced byBrassica junceaseed meal amendment is biologically mediated.Soil Biology and Biochemistry, 2012, 51: 44-52.
[4] 王艳芳, 潘凤兵, 展星, 王功帅, 张国栋, 胡艳丽, 陈学森, 毛志泉.连作苹果土壤酚酸对平邑甜茶幼苗的影响. 生态学报, 2015, 35(19): 6566-6573.
WANG Y F, PAN F B, ZHAN X, WANG G S, ZHANG G D, HU Y L, CHEN X S, MAO Z Q.Effects of five kinds of phenolic acid on the function of mitochondria and antioxidant systems in roots ofMalus hupehensisRehd seedlings.Acta Ecologica Sinica, 2015, 35(19): 6566-6573.(in Chinese)
[5] 张兆波, 毛志泉, 朱树华. 6 种酚酸类物质对平邑甜茶幼苗根系线粒体及抗氧化酶活性的影响. 中国农业科学, 2011, 44(15): 3177-3184.
ZHANG Z B, MAO Z Q, ZHU S H. Effects of phenolic acids on mitochondria and the activity of antioxidant enzymes in roots of seedlings ofMalus hupehensisRehd.Scientia Agricultura Sinica,2011, 44(15): 3177-3184. (in Chinese)
[6] 王青青, 胡艳丽, 周慧, 展星, 毛志泉, 朱树华. 根皮苷对平邑甜茶根系TCA循环酶的影响. 中国农业科学, 2012, 45(15): 3108-3114.
WANG Q Q, HU Y L, ZHOU H, ZHAN X, MAO Z Q, ZHU S H. Effects of phlorizin on the tricarboxylic acid cycle enzymes of roots ofMalus hupehensisRehd.Scientia Agricultura Sinica, 2012, 45(15): 3108-3114. (in Chinese)
[7] WANG Y, PAN F, WANG G, ZHANG G, WANG Y, CHEN X, MAO Z. Effects of biochar on photosynthesis and antioxidative system ofMalus hupehensisRehd. seedlings under replant conditions.Scientia Horticulturae, 2014, 175: 9-15.
[8] AHMED A S, EZZIYYANI M, SÁNCHEZ C P, CANDELA M E. Effect of chitin on biological control activity ofBacillusspp. andTrichoderma harzianumagainst root rot disease in pepper (Capsicum annuum) plants.European Journal of Plant Pathology, 2003, 109(6): 633-637.
[9] LIU L, CHEN P, SUN M, SHEN G, SHANG G. Effect of biochar amendment on PAH dissipation and indigenous degradation bacteria in contaminated soil.Journal of Soils and Sediments, 2015, 15(2): 313-322.
[10] CABRERA A, COX L, SPOKAS K, HERMOSÍN M, CORNEJO J, KOSKINEN W. Influence of biochar amendments on the sorptiondesorption of aminocyclopyrachlor, bentazone and pyraclostrobin pesticides to an agricultural soil.Science of the Total Environment, 2014, 470: 438-443.
[11] 王艳芳, 潘凤兵, 付风云, 相立, 张先富, 陈学森, 沈向, 毛志泉.甲壳素对连作平邑甜茶生长, 光合及抗氧化酶的影响. 园艺学报, 2015, 42(1): 10-18.
WANG Y F, PAN F B, FU F Y, XIANG L, ZHANG X F, CHEN X S, SHEN X, MAO Z Q. Effects of chitin on growth, photosynthesis and antioxidative system ofMalus hupehensisseedlings under replant condition.Acta Horticulturae Sinica, 2015, 42(1): 10-18. (in Chinese)
[12] 高相彬, 赵凤霞, 沈向, 胡艳丽, 郝云红, 杨树泉, 苏立涛, 毛志泉.肉桂酸对平邑甜茶幼苗根系呼吸速率及相关酶活性的影响. 中国农业科学, 2009, 42(12): 4308-4314.
GAO X B, ZHAO F X, SHEN X, HU Y L, HAO Y H, YANG S Q, SU L T, MAO Z Q. Effects of cinnamon acid on respiratory rate and its related enzymes activity in roots of seedlings ofMalus hupehensisRehd.Scientia Agricultura Sinica, 2009, 42(12): 4308-4314. (in Chinese)
[13] 赵世杰, 史国安, 董新纯. 植物生理学实验指导. 中国农业科技出版社, 北京, 2002.
ZHAO S J, SHI G A, DONG X C.Experimental Guide for Plant Physiology. Beijing: China Agricultural Science and Technology Press, 2002. (in Chinese)
[14] OMRAN R G. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings.Plant Physiology, 1980, 65(2): 407-408.
[15] 沈萍, 陈向东. 微生物学实验. 北京: 高等教育出版社, 2007.
SHEN P, CHEN X D.Experiment of Microbiology. Beijing: Higher Education Press, 2007. (in Chinese)
[16] 尹承苗, 王功帅, 李园园, 陈学森, 吴树敬, 毛志泉. 连作苹果园土壤真菌的TRFLP分析. 生态学报, 2014, 34(4): 837-846.
YIN C M, WANG G S, LI Y Y, CHEN X S, WU S J, MAO Z Q. Assessment of fungal diversity in apple replanted orchard soils by T-RFLP analysis.Acta Ecologica Sinica, 2014, 34(4): 837-846. (in Chinese)
[17] 赵永坡, 初雷霞, 岳开华, 李振方, 林文雄. 太子参根际尖孢镰刀菌绝对荧光定量检测方法的建立及其应用. 江西农业大学学报, 2014, 36 (5): 1127-1131.
ZHAO Y P, CHU L X, YUE K H, LI Z F, LIN W X. Establishment and application of qRT-PCR method for quantification ofFusarium oxysporumf. sp. inPseudostellaria heterophyllarhizosphere.Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(5): 1127-1131. (in Chinese)
[18] YIM B, SMALLA K, WINKELMANN T. Evaluation of apple replant problems based on different soil disinfection treatments-links to soil microbial community structure?Plant and Soil, 2013, 366(1): 617-631.
[19] ZHOU X, YU G, WU F. Soil phenolics in a continuously mono-cropped cucumber (Cucumis sativusL.) system and their effects on cucumber seedling growth and soil microbial communities.European Journal of Soil Science, 2012, 63(3): 332-340.
[20] ZHANG F, ZHU Z, YANG X, RAN W, SHEN Q. Trichoderma harzianum T-E5 significantly affects cucumber root exudates and fungal community in the cucumber rhizosphere.Applied Soil Ecology, 2013, 72: 41-48.
[21] MAZZOLA M, HEWAVITHARANA S S, STRAUSS S L.Brassicaseed meal soil amendments transform the rhizosphere microbiome and improve apple production through resistance to pathogen reinfestation.Phytopathology, 2015, 105(4): 460-469.
[22] 蒋小姝, 莫海涛, 苏海佳, 张小勇. 甲壳素及壳聚糖在农业领域方面的应用. 中国农学通报, 2013, 29 (6): 170-174.
JIANG X S, MO H T, SU H J, ZHAO X Y. The application of chitin and chitosan in agriculture.Chinese Agricultural Science Bulletin, 2013, 29(6): 170-174. (in Chinese)
[23] ZHANG Z, CHEN Q, YIN C, SHEN X, CHEN X, SUN H, MAO Z. The effects of organic matter on the physiological features ofMalus hupehensisseedlings and soil properties under replant conditions.Scientia Horticulturae, 2012, 146: 52-58.
[24] ATKINSON C J, FITZGERALD J D, HIPPS N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils: A review.Plant and Soil, 2010, 337(1/2): 1-18.
[25] HERATH I, KUMARATHILAKA P, NAVARATNE A, RAJAKARUNA N, VITHANAGE M. Immobilization and phytotoxicity reduction of heavy metals in serpentine soil using biochar.Journal of Soils and Sediments, 2015, 15(1): 126-138.
[26] ELMER W H, PIGNATELLO J J. Effect of biochar amendments on mycorrhizal associations andFusarium crownand root rot of asparagus in replant soils.Plant Disease, 2011, 95(8): 960-966.
[27] JAISWAL A K, ELAD Y, GRABER E R, FRENKEL O.Rhizoctonia solanisuppression and plant growth promotion in cucumber as affected by biochar pyrolysis temperature, feedstock and concentration.Soil Biology and Biochemistry, 2014, 69: 110-118.
[28] 李倩, 诸葛玉平, 王建, 刘东雪, 张阿芳, 王立华. 几种高分子有机肥原料对土壤生物学性质的影响. 水土保持学报, 2013, 27(4): 241-246.
LI Q, ZHUGE Y P, WANG J, LIU D X, ZHANG A F, WANG L H. Effects of several organic polymermaterials on soil biological characteristics.Journal of Soil and Water Conservation, 2013, 27(4): 241-246. (in Chinese)
[29] 张志红, 彭桂香, 李华兴, 蔡燕飞, 张新明, 赵兰凤. 生物肥与甲壳素和恶霉灵配施对香蕉枯萎病的防治效果. 生态学报, 2011, 31(4): 1149-1156.
ZHANG Z H, PENG G X, LI X H, CAI Y F, ZHANG X M, ZHAO L F. Effects on controlling banana Fusarium wilt by bio-fertilizer, chitosan, hymexazol and their combinations.Acta Ecologica Sinica, 2011, 31(4): 1149-1156. (in Chinese)
(责任编辑 赵伶俐)
Effects of Biochar and Chitin Combined Application on Malus hupehensis Rehd. Seedlings and Soil Environment Under Replanting Conditions
WANG YanFang2, XIANG Li1, XU ShaoZhuo1, WANG Sen1, WANG XiaoWei4, CHEN XueSen1, MAO ZhiQuan1, ZHANG Min3
(1College of Chemistry and Material Science, Shandong Agricultural University, Taian 271018, Shandong, Shandong;2College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018;3Zaozhuang Vocational College of Science and Technology, Tengzhou 277500, Shandong;4College of Resources and Environment, Shandong Agricultural University, Taian 271018, Shandong)
【Objective】 The experiment was conducted to explore the effects of biochar and chitin combined application on the plant biomass, root respiration rate, root protective enzymes and soil environment under replanting conditions, and to provide a basis for prevention of apple replanting disease (ARD). 【Method】 TheMalus hupehensisRehd. seedlings were planted in pots with apple replanting soil. The experiment included 5 treatments, which were the control (CK), 1‰ chitin (T1), 2% biochar (T2), 1‰ chitin + 2% biochar (T3) and methyl bromide sterilization (T4). The biomass, root respiration rate and protective enzymes activities ofM. hupehensisseedlings were measured by conventional method. The number of microorganism, fungal group structure and theFusarium oxysporumnumbers were detected by terminal restriction fragment length polymorphism (T-RFLP) and a real-time quantitative PCR detection system. 【Result】 The results showed that compared with the control, T3 and T4 significantly enhanced the plant height, ground diameter, fresh and dry weight, and that in T3 increased by 44.6%, 33.0%, 76.8% and 77.1%, and in T4 increased by 73.1%, 76.9%, 117.0% and 123.7%, respectively. T1, T2, T3 and T4 treatments made the root respiration rate increased significantly, which were 1.37, 1.70, 1.87 and 2.02 times more than the control. The four different treatments also increased the root activity of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT), and the increase reached a significant difference. The SOD, POD and CAT activities of T4 treatments were 1.34, 2.68 and 2.64 times compared with the control, and T3 were 1.21, 2.52 and 2.18 times, respectively. T2 and T3 improved the numbers of bacteria, enhanced the ratio of bacteria and fungi and made the soil become “bacterial soil”. The ratios of T3 and T4 were 1.7 and 2.2 times as large as the control, methyl bromide sterilization made the numbers of bacteria and fungi decreased significantly, and the fungi numbers decreased more than bacteria’s, so the bacteria/fungi ratio was higher than the control. T4 had the highest Shannon diversity index, evenness index and richness index, increased by 24.4%, 41.3% and 13.6% compared with CK, and the second was the T3 treatment. Compared with the control, T3 and T4 reduced the gene copie’s number ofF. oxysporum, which explained that theF. oxysporumharmful fungi number decreased significantly in replanting soils. Compared with CK, the concentration of phlorizin, phloretin, cinnamic acid, p-hydroxybenzoic acid and phloroglucinol reduced by 28.1%, 30.6%, 50.8%, 33.6% and 46.2% in T3, respectively.【Conclusion】The biochar and chitin combined application improved the condition in apple replanting soil better than solely biochar or chitin addition. The combined application improved theM. hupehensis.seedlings biomass, root respiration rate and root activity of protective enzymes. And the combined application optimized the soil fungi community structure, increased the soil bacteria/fungus ratio, and reduced theF. oxysporumgene copy numbers and contents of phenolic acids. Therefore, biochar and chitin combined application can better relieve ARD.
apple replant disease; biochar; chitin;Malus hupehensisRehd. seedlings
10.3864/j.issn.0578-1752.2017.04.011
2016-06-13;接受日期:2016-08-19
国家现代农业产业技术体系建设专项(CARS-28)、山东省高校科技计划(J15LF06)、泰安市科技发展计划(201340629)
联系方式:王艳芳,E-mail:wyanfang@126.com。通信作者毛志泉,E-mail:mzhiquan@sdau.edu.cn。通信作者张民,E-mail:minzhang-2002@163.com

