基于纳米Nb2O5/石墨烯复合材料的增强效应电化学测定绿原酸
瞿万云,吴 艳,2,胡卫兵
(1.湖北民族学院 化学与环境工程学院,湖北 恩施 445000;2.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
基于纳米Nb2O5/石墨烯复合材料的增强效应电化学测定绿原酸
瞿万云1,吴 艳1,2,胡卫兵2*
(1.湖北民族学院 化学与环境工程学院,湖北 恩施 445000;2.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
制备了Nb2O5/石墨烯修饰玻碳电极(Nb2O5/RGO/GCE),建立了一种简便、灵敏检测绿原酸的电化学方法。用氧化石墨烯(GO)和五氯化铌(NbCl5)一步溶剂热法制备Nb2O5/RGO复合材料,并用扫描电子显微镜(SEM)对其进行形貌表征。采用循环伏安法(CV)和方波伏安法(SWV)研究了绿原酸在Nb2O5/RGO/GCE上的电化学行为。结果发现,Nb2O5/RGO复合材料能显著增强绿原酸的电化学活性。对实验条件(如pH值、扫描速率与富集时间等)进行了优化。在最佳条件下,绿原酸的氧化峰电流与浓度在5.0×10-7~1.2×10-5mol/L范围内呈良好的线性关系,检出限为2.0×10-7mol/L。采用修饰电极测定各种药物中绿原酸的含量,得到加标回收率为96.6%~101.5%。该方法具有良好的灵敏度和稳定性,已成功应用于药物中绿原酸含量的测定。
纳米复合材料;石墨烯;绿原酸;Nb2O5纳米棒

图1 绿原酸的结构式Fig.1 Structural formula of CGA
绿原酸(Chlorogenic acid,CGA)是由咖啡酸和奎宁酸组成的缩酚酸,属于苯丙素类化合物(结构式见图1),具有抗氧化、抗肿瘤、抗菌、抗病毒、免疫调节、降糖等多种作用[1]。它广泛存在于植物中,是许多药材(如金银花、杜仲叶)和中成药的主要药效成分,其含量是衡量药物质量的重要指标[2],因此,建立一种简便、快捷及灵敏测定绿原酸的方法具有重要意义。目前,已报道的绿原酸测定方法有化学发光法[3]、高效液相色谱法[4-6]、毛细管电泳法[7-8]、电化学法[9-12]等。其中,电化学检测法因仪器价格便宜、灵敏度高、检测快速等优点受到广泛研究。
石墨烯是由碳原子以sp2杂化方式连接的新型二维结构,具有大的比表面积和良好的电子传输能力,被广泛应用于电化学分析[13-15]。由于石墨烯在溶剂中的分散性及其本身的卷曲、团聚、层间的堆叠等,限制了其在电分析化学领域中的应用。因此,有必要通过将石墨烯与其它纳米材料复合,借助不同材料的协同作用,进一步改善石墨烯的电化学性质。近年来,石墨烯基纳米复合材料备受关注,特别是用石墨烯作为载体材料,合成石墨烯/无机纳米复合材料用于电化学和生物传感领域的报道越来越多。例如,Li等[16]用MnO2/氧化石墨烯复合材料制作了非酶过氧化氢传感器,在碱性介质中灵敏检测H2O2;Xu等[17]用 ZnO/石墨烯复合材料作修饰剂,直接电化学检测血红蛋白;Fan等[18]利用水热法制备TiO2/石墨烯复合材料,并用其作修饰剂,灵敏检测多巴胺;Huang等[19]用溶剂热法制备WO3/石墨烯复合材料,用此材料修饰玻碳电极灵敏检测和厚朴酚。Nb2O5具有耐酸碱腐蚀性质、优异的光学性质和稳定优越的电化学性能,具备成为电极材料的条件[20]。而将Nb2O5/石墨烯(Nb2O5/RGO)用于绿原酸的测定尚未见报道。本文采用一步溶剂热法制备了Nb2O5/RGO复合材料,将其用作修饰剂,制备了Nb2O5/RGO修饰玻碳电极(Nb2O5/RGO/GCE)。研究了绿原酸在Nb2O5/RGO/GCE电极上的电化学行为,发现Nb2O5/RGO复合材料对绿原酸的电化学氧化有明显的增敏作用。基于此,建立了药物中绿原酸含量的测定方法,从而为提高金银花等药材乃至相关制剂的质量控制提供一定的实验依据。
1 实验部分
1.1 仪器与试剂
CHI660E电化学工作站(上海辰华仪器公司),三电极系统:工作电极为玻碳电极(φ=3 mm)或修饰电极,参比电极为饱和甘汞电极(SCE ),对电极为铂丝电极;KQ3200DE超声清洗仪(昆山市超声仪器有限公司);JSM-6510LV型扫描电子显微镜(日本电子株式会社)。
绿原酸(中国药品生物制品检定所):准确称取一定量绿原酸溶于无水乙醇,配制成1.0×10-2mol/L的储备液,避光置于冰箱中保存,使用时适当稀释。鳞片石墨(>99.98%,国药集团化学试剂有限公司);五氯化铌(NbCl5,99.99%,Sigma-Aldrich公司);双十六烷基磷酸(DHP,Fluka公司);金银花(某药材公司);杜仲颗粒(某制药有限公司)。其他试剂均为分析纯,所有试剂未经纯化直接使用。实验用水为二次蒸馏水。
1.2 Nb2O5纳米棒、RGO和Nb2O5/RGO材料的制备
用鳞片石墨为原料,采用改进的 Hummers方法[21]制备氧化石墨烯(GO)。称取100 mg GO置于50 mL水中,超声10 min后,得GO分散液。
将25 mg NbCl5用10 mL无水乙醇溶解。将上述GO分散液和NbCl5乙醇溶液加至100 mL聚四氟乙烯反应釜内衬中,反应釜置于不锈钢外壳中拧紧盖好,于235 ℃保温72 h,得到黑色的Nb2O5/石墨烯(Nb2O5/RGO)复合材料。同时,分别将单一的GO分散液和NbCl5乙醇溶液转至100 mL聚四氟乙烯反应釜内衬中,于235 ℃保温72 h,得到黑色的RGO悬浮液[22]和Nb2O5纳米材料[20]。上述产品分别用水、乙醇和丙酮各离心洗涤3次,60 ℃真空干燥得到Nb2O5/RGO,RGO和 Nb2O5粉末。
1.3 修饰电极的制备
将4 mg Nb2O5/RGO和2 mg DHP加至4 mL水中,超声分散40 min直至得到均一、黑色的悬浮液。玻碳电极(GCE)用粒度为0.05 mm的Al2O3抛光粉进行抛光,冲洗干净后分别在无水乙醇、水中超声清洗2 min,红外灯下烘干。 用微量进样器取10 mL上述Nb2O5/RGO分散液滴加至玻碳电极表面,红外灯下挥发掉溶剂,即得Nb2O5/RGO/GCE修饰电极。Nb2O5/GCE和RGO/GCE修饰电极参照上述方法制备。
1.4 样品溶液的制备
取不同批号(6041392,5121002,6031132)的杜仲颗粒剂混合,研成细粉。取1.0 g,精密称定,置磨口瓶中,加70%乙醇约20 mL,超声提取30 min,用70%乙醇定容至25 mL,摇匀,滤过,取滤液离心即可。
将干燥的金银花研磨成细粉,过四号筛。取5.0 g,精密称定,置于磨口瓶中,用70%乙醇超声萃取3次(每次20~25 mL,萃取时间30 min),萃取液过滤后,用70%乙醇定容至100 mL。
1.5 实验方法
修饰电极先在10 mL B-R缓冲溶液(pH 2.5)中经过多次循环伏安扫描(扫描范围为0.0~0.9 V)至循环伏安曲线稳定。然后,加入一定量的绿原酸标准溶液,在搅拌条件下开路富集2 min,静止15 s,在0.0~0.9 V之间进行循环伏安(CV)和方波伏安(SWV)实验。
2 结果与讨论
2.1 Nb2O5和Nb2O5/RGO材料的表征
采用扫描电子显微镜(SEM)分别对制备的Nb2O5和Nb2O5/RGO材料进行表征,其SEM图见图2。从图2A中可以看出Nb2O5纳米棒的形貌;由图2B可以清晰看到在RGO中分散有Nb2O5纳米棒,且纳米棒长度为2.5 μm左右,直径为400 nm左右。

图3 1.0×10-5 mol/L绿原酸在Nb2O5/RGO/GCE上的循环伏安图Fig.3 Cyclic voltammograms of 1.0×10-5 mol/L CGA at Nb2O5/RGO/GCE(a) and Nb2O5/RGO/GCE(b)scan rate:0.1 V/s
2.2 绿原酸在Nb2O5/RGO/GCE电极上的电化学行为
于0.0~0.9 V电位区间内,以Nb2O5/RGO/GCE作为工作电极,采用循环伏安法(CV)比较了pH 2.5 B-R缓冲溶液中加入1.0×10-5mol/L绿原酸前后的电化学行为,结果如图3所示。未加绿原酸时(曲线b),未观察到氧化还原峰;加入1.0×10-5mol/L绿原酸后(曲线a),第一圈正向扫描过程中,在0.48 V出现1个灵敏度高、峰形好的氧化峰。反向扫描过程中,在0.45 V出现1个还原峰,两峰电位差为29 mV,峰电流之比(Ipa/Ipc)为1.32。表明绿原酸在Nb2O5/RGO/GCE电极上的反应为准可逆的电化学过程。此外,随着扫描次数的增加,氧化峰电流逐渐降低,最后趋于稳定;还原峰随扫描次数增加几乎不变,说明绿原酸及其氧化还原产物在修饰电极上均有吸附。为了得到更好的灵敏度和重现性,选择第一圈的氧化峰作为研究对象。
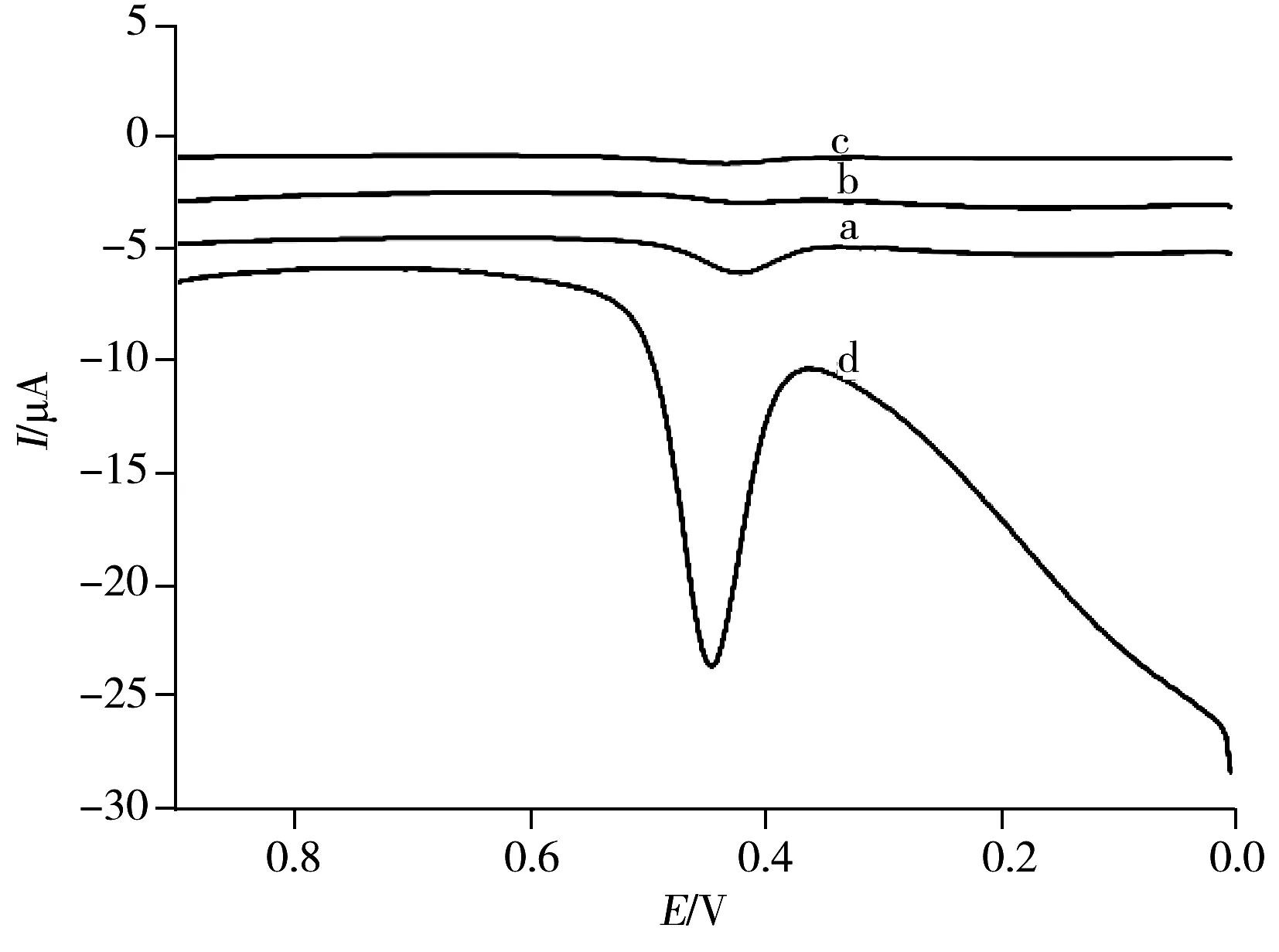
图4 绿原酸在不同电极上的方波伏安曲线Fig.4 Square wave voltammograms of 1.0×10-5 mol/L CGA on different modified electrodesa.GCE,b.Nb2O5/GCE,c.RGO/GCE,d.Nb2O5/RGO/GCE;Incr E=0.004 V,amplitude:0.025 V,frequency:15 Hz
为了说明Nb2O5/RGO复合材料的特殊性质,用方波伏安法(SWV)比较了1.0×10-5mol/L绿原酸在裸GCE电极、RGO/GCE电极、Nb2O5/GCE电极和Nb2O5/RGO/GCE电极上的氧化行为,结果如图4所示。由图4可见,在裸GCE电极(曲线a)上观察到1个灵敏度较小的氧化峰;在Nb2O5/GCE电极(曲线b)和RGO/GCE电极(曲线c)上几乎未观察到电化学响应信号,可能是RGO和Nb2O5材料阻碍了绿原酸与电极间的电子传输,从而降低了绿原酸的电化学氧化活性。而在Nb2O5/RGO/GCE电极(曲线d)上开路富集2 min后出现灵敏的氧化峰,与裸GCE相比,峰电流增大约5倍。其原因可能如下:①由于Nb2O5纳米棒分散到RGO中阻止了氧化石墨烯在还原过程中的团聚和堆叠,使复合材料具有较大的比表面积,从而为绿原酸的氧化提供了较多的反应位点;②复合材料中的RGO和Nb2O5之间产生了协同效应,有效促进了电子的传输速率,从而增强了绿原酸的电化学氧化活性。
2.3 影响绿原酸电化学行为的因素
2.3.1 测定介质及pH值的影响 用CV法研究了绿原酸在HClO4溶液、NaAc-HAc缓冲溶液、磷酸盐缓冲溶液、B-R缓冲溶液和NaOH溶液(浓度均为0.1 mol/L)中的电化学行为。实验发现,绿原酸在中性和碱性溶液中无电化学氧化信号,在酸性溶液中出现灵敏的氧化峰,且在B-R缓冲液中的峰形较好,峰电流较大。在B-R缓冲溶液中,用CV法研究了pH值在1.9~4.6范围内对绿原酸峰电流的影响,结果如图5所示。结果显示,pH 2.5时,绿原酸的氧化、还原峰电流最大,所以选择pH 2.5的B-R缓冲溶液为测定介质。
从图5可以观察到,随着pH值的增加,绿原酸的氧化还原峰电位逐渐负移,这表明质子参与了绿原酸的氧化还原过程。氧化峰电位(Epa)和还原峰电位(Epc)与pH值的关系见图5插图,其线性方程为:Epa(V)=0.604 9-0.053 63pH(r=-0.996 8);Epc(V)=0.592 9-0.059 86pH(r=-0.999 1),斜率分别为53.63 mV/pH和59.86 mV/pH。说明参加氧化还原反应的电子数和质子数之比为1。
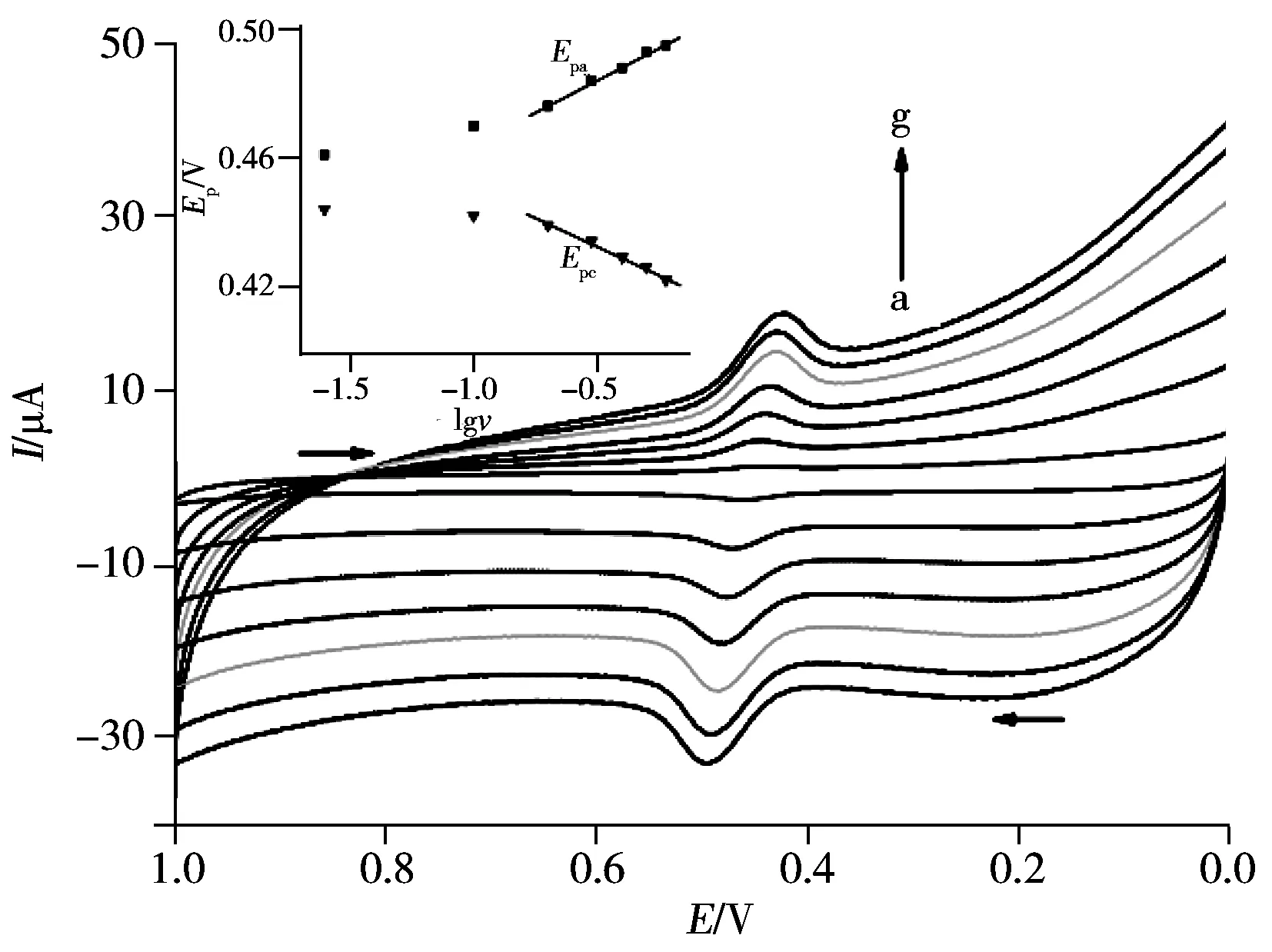
图6 不同扫描速率下绿原酸在Nb2O5/RGO/GCE上的循环伏安图Fig.6 Cyclic voltammograms of 1.0×10-5 mol//L CGA at Nb2O5/RGO/GCE under different scan ratesscan rate(a-g):0.025,0.1,0.2,0.3,0.4,0.5, 0.6 V/s;insert:relationship between redox peak potential(Epa,Epc) and lgv
2.3.2 扫描速率的影响 用CV法研究了扫描速率对绿原酸峰电流的影响,结果如图6所示。由图6可知,绿原酸在Nb2O5/RGO/GCE电极上的氧化、还原峰电流均随扫速的增加而增大,且在0.025~0.5 V/s 范围内,氧化峰电流(Ipa)和还原峰电流(Ipc)与扫速之间呈良好的线性关系,线性回归方程分别为:Ipa(μA)=0.785 6+15.88v(V/s)(r=0.995 6);Ipc(μA)=0.216 7+15.06v(V/s)(r=0.997 8)。表明绿原酸在此修饰电极上的氧化还原反应受吸附控制。
绿原酸的氧化、还原峰电位也会随扫描速率改变而改变。随着扫描速率的增加,绿原酸的氧化峰电位正移,还原峰电位负移,且呈一定的线性关系(图6插图)。线性方程分别为:Epa(V)=0.506 7+0.045 01lgv(V/s)(r=0.996 7);Epc(V)=0.412 3-0.040 42lgv(V/s)(r=0.997 2)。根据Laviron[23]公式,Epa和Epc的斜率分别为2.3RT/nF(1-α)和-2.3RT/nFα,其中,n为电子转移数,α为电子转移系数。计算得到:n=2.7,α=0.53。电子转移系数接近理论值0.5,这进一步证明了绿原酸在Nb2O5/RGO/GCE电极上是一个准可逆的电极过程。
2.3.3 Nb2O5/RGO用量的影响 Nb2O5/RGO的用量(由滴加在电极表面的Nb2O5/RGO分散液的量决定)对绿原酸的氧化峰电流有很大的影响。当Nb2O5/RGO分散液的量从0逐渐增至10 μL时,绿原酸的氧化峰电流显著增加;当Nb2O5/RGO分散液的量从10 μL增至14 μL时,绿原酸的氧化峰电流略有增加。此后,继续增加Nb2O5/RGO分散液的量,峰电流反而降低,原因可能是此时电极表面的DHP太多,降低了电极表面膜的导电性能,从而阻碍了绿原酸与电极之间的电子交换。因此实验选择修饰剂的最佳用量为10 μL。
2.3.4 富集电位与富集时间的选择 在-0.2~0.2 V 电位范围内,富集时间为2 min,绿原酸的浓度为1.0×10-5mol/L,比较了开路富集和闭路富集(富集电位分别为-0.3, -0.2, -0.1, 0, +0.1, +0.2 V)时绿原酸氧化峰电流的大小,发现开路富集峰电流大于闭路富集的峰电流,所以实验选择开路富集。
在开路富集条件下,用SWV法考察了富集时间对峰电流的影响,结果发现,绿原酸的峰电流随富集时间的增加而增大,当绿原酸浓度为1.0×10-5mol/L时,开路富集超过2 min后峰电流增大趋缓(说明已达吸附平衡),所以选择富集时间为2 min;当绿原酸浓度为2.0×10-6mol/L时,开路富集超过3 min后峰电流几乎不再增大,所以选择富集时间为3 min。实验表明,绿原酸在Nb2O5/RGO/GCE电极表面发生了吸附,浓度较小的溶液达到吸附平衡所需时间较长。
2.4 线性方程与检出限
在上述优化条件下,用SWV法考察了绿原酸氧化峰电流与浓度的关系。结果显示,随着绿原酸浓度的升高,其氧化峰电流随之增大,且绿原酸的氧化峰电流与其浓度在5.0×10-7~1.2×10-5mol/L范围内有良好的线性关系,其线性回归方程为:Ip(μA)=1.280c(μmol/L)-0.202 7(r=0.994 3),开路富集3 min后,绿原酸的检出限(S/N=3)为2.0×10-7mol/L。
将Nb2O5/RGO/GCE电极检测绿原酸的电分析方法与已有文献方法进行比较,结果见表1。通过比较发现,用Nb2O5/RGO复合材料作修饰剂的电分析方法在回收率、线性范围和检出限方面均具有较大优势。

表1 各种测定绿原酸分析方法的比较Table 1 Comparison of various analytical methods for the determination of CGA
2.5 重现性、稳定性与选择性
在最佳实验条件下,用5支新修饰的Nb2O5/RGO/GCE电极分别测1.0×10-5mol/L和2.0×10-6mol/L的绿原酸溶液,计算得其相对标准偏差(RSD)分别为3.8%和2.7%,说明修饰电极有良好的重现性。将制备好的修饰电极在4 ℃冰箱中分别放置1,2,5 d后再进行测定,其氧化峰电流分别降低1.8%,3.2%,8.5%,说明Nb2O5/RGO/GCE具有良好的稳定性。Nb2O5/RGO/GCE电极使用后,由于表面吸附了绿原酸的氧化产物和还原产物而被污染,所以每次测定完成后需更新电极表面。
在相同条件下,固定绿原酸的浓度为1.0×10-5mol/L,研究了常见的金属离子和有机分子对绿原酸测定的影响。以相对误差<5%计,100倍的Zn2+,Na+,Fe3+,Mg2+,K+,Cu2+,Ca2+;10倍的咖啡酸、阿魏酸、乳酸、蔗糖、葡萄糖几乎不干扰绿原酸的测定,说明Nb2O5/RGO/GCE电极具有良好的选择性。
2.6 样品分析及回收率的测定
取一定体积的样品溶液加至10 mL电解池中,在最佳条件下测定绿原酸的含量。然后加入一定量的绿原酸标准溶液,用相同方法测定绿原酸的含量,每个样品连续测定4次,电解池中绿原酸的含量和加标回收率见表2。由表2可见,其回收率为96.6%~101.5%,说明该修饰电极有好的适用性。通过计算,1.0 g杜仲颗粒中绿原酸的含量为0.96 mg;金银花中绿原酸的含量为2.5%。

表2 绿原酸的测定结果(n=4)Table 2 Determination results of CGA in pharmaceutical products(n=4)
[1] Wu W H,Kang Z,Ouyang D S,Zhou H H.Nat.Prod.Res.Dev.( 吴卫华,康桢,欧阳冬生,周宏灏.天然产物研究与开发),2006,18 :691-694.
[2] Chinese Pharmacopoeia.VolⅠ(中国药典.1部).2015:166,221.
[3] Wang X X,Wang J G,Yang N J.FoodChem.,2007,102(1):422-426.
[4] Xin H,Feng J,Cheng R M,Xin N.Chin.J.Exp.Tradit.Med.Formulae(辛华,丰杰,程若敏,辛宁.中国实验方剂学杂志),2011,17(2):60-63.
[5] Yuan X D,Koh H L,Chui W K.J.Pharm.Biomed.Anal.,2005,39(3/4):697-704.
[6] Yao Z H,Wang Q Y,Wei Z C,Gong H B,Lin P,Dai Y,Yao X S.J.Instrum.Anal.(姚志红,王其意,韦卓纯,龚海标,林培,戴毅,姚新生.分析测试学报),2016,35(6):641-647.
[7] Li Z B,Huang D N,Tang Z X,Deng C H,Zhang X M.Talanta,2010,82(4):1181-1185.
[8] Lü Y Q,Wu C H,Yuan Z B.J.Instrum.Anal.(吕元琦,邬春华,袁倬斌.分析测试学报),2004,23(4):98-100.[9] Yao X,Chen G.Anal.Bioanal.Chem.,2007,388:475-478.
[10] Mansoor N,Hamid R Z.Electrochim.Acta,2005,50(22):4350-4355.
[11] Chao M Y,Ma X Y.J.FoodDrugAnal.,2014,22(4):512-519.
[12] Li L J,Zhang L,Cui F H,Cheng H,Li Y Q.Chin.J.Anal.Lab.(李利军,张雷,崔福海,程昊,李彦青.分析试验室),2015,34(5):503-506.
[13] Kang X H,Wang J,Wu H,Liu J,Aksay I A,Liu Y H.Talanta,2010,81(3):754-759.
[14] Fan H X,Li Y,Wu D,Ma H M,Mao K X.Anal.Chim.Acta,2012,711:24-28.
[15] Wu Y,Huang M,Song N N,Hu W B.Anal.Methods,2014,6:2729-2735.
[16] Li L M,Du Z F,Liu S,Hao Q Y,Wang Y G,Li Q H,Wang T H.Talanta,2010,82:1637-1641.
[17] Xu J,Liu C H,Wu Z F.Microchim.Acta,2011,172(3):425-430.
[18] Fan Y,Lu H T,Liu J H,Yang C P,Jing Q S,Zhang Y X,Yang X K,Huang K J.ColloidsSurf.B,2011,83(1):78-82.
[19] Huang M,Wu Y,Hu W B.Ceram.Int.,2014,40:7219-7225.
[20] Huang M,Hu W B.J.HuazhongNormalUniv.:Nat.Sci.(黄猛,胡卫兵.华中师范大学学报:自然科学版),2013,47(4):501-504.
[21] Tang L H,Wang Y,Li Y M,Feng H B,Lu J,Li J H.Adv.Funct.Mater.,2009,19:2782-2789.
[22] Nethravathi C,Rajamathi M.Carbon,2008,46(14):1994-1998.
[23] Laviron E.J.Electroanal.Chem.,1979,101:19-28.
Electrochemical Detection of Chlorogenic Acid Based on the Enhancement Effect of Nb2O5/RGO Nanocomposites
QU Wan-yun1,WU Yan1,2,HU Wei-bing2*
(1.College of Chemical and Environmental Engineering,Hubei University for Nationalities,Enshi 445000,China;2.Key Laboratory of Biological Resources Protection and Utilization of Hubei Province,Hubei University for Nationalities,Enshi 445000,China)
A simple and sensitive electrochemical method was developed for the determination of chlorogenic acid based on Nb2O5/reduced graphene oxide(RGO) nanocomposites modified glassy carbon electrode(Nb2O5/RGO/GCE).Nb2O5/RGO composite was synthesized by a hydrothermal reduction using NbCl5and graphene oxide(GO),and its morphology was characterized by scanning electronic microscopy(SEM).Electrochemical behaviors of chlorogenic acid on Nb2O5/RGO/GCE were studied by cyclic voltammetry(CV) and square wave voltammetric(SWV) methods.The results showed that the Nb2O5/RGO composite displayed a remarkably enhanced electrochemical activity toward the oxidation of chlorogenic acid.Conditions influencing the detection process,such as pH value of buffer solution,scan rate and accumulation time,were optimized.Under the optimized conditions,the oxidation peak current of chlorogenic acid has a good linear relationship with concentration of chlorogenic acid in the range of 5.0×10-7-1.2×10-5mol/L,with a detection limit(S/N=3) of 2.0×10-7mol/L.The proposed method was applied in the determination of chlorogenic acid in pharmaceutical products,and the spiked recoveries were in the range of 96.6%-101.5%.With good sensitivity and stability,the developed method was successfully applied in the determination of chlorogenic acid in pharmaceutical products.
nanocomposite;reduced graphene oxide;chlorogenic acid;Nb2O5nanorod
10.3969/j.issn.1004-4957.2017.03.004
2016-09-18;
2016-10-20
国家自然科学基金资助项目(21465009,21461008 )
O657.1;TQ460.72
A
1004-4957(2017)03-0319-06
*通讯作者:胡卫兵,博士,教授,研究方向:无机纳米材料的制备及电化学,Tel:0718-8439547,E-mail:chemistryhu@126.com

