叶酸通过下调ERK1/2信号通路抑制血管平滑肌细胞增殖和迁移*
潘孙雷, 林 辉, 骆杭琪, 高飞丹, 孟立平, 周昌钻, 蒋承建, 池菊芳, 郭航远1,△
(1温州医科大学第一临床医学院,浙江 温州 325000; 2绍兴市人民医院心内科,浙江 绍兴 312000)
叶酸通过下调ERK1/2信号通路抑制血管平滑肌细胞增殖和迁移*
潘孙雷1, 2, 林 辉1, 2, 骆杭琪2, 高飞丹2, 孟立平2, 周昌钻2, 蒋承建2, 池菊芳2, 郭航远1,2△
(1温州医科大学第一临床医学院,浙江 温州 325000;2绍兴市人民医院心内科,浙江 绍兴 312000)
目的: 探讨叶酸(folic acid, FA)对血管平滑肌细胞(VSMCs)增殖和迁移的影响及其机制。方法: 取SD大鼠的主动脉,采用组织贴块法培养VSMCs,随机分组进行实验。采用CCK-8和EdU法检测叶酸对VSMCs活力和增殖能力的影响。采用划痕实验和Transwell法检测叶酸对VSMCs迁移和侵袭的影响。采用Western blot法检测细胞增殖核抗原(PCNA)蛋白表达以及血小板源性生长因子受体(PDGFR)和细胞外信号调节激酶1/2 (ERK1/2)蛋白的磷酸化水平。结果: 叶酸抑制血小板源性生长因子(PDGF)诱导的VSMCs的活力,并呈浓度依赖性(P<0.05)。叶酸抑制PDGF诱导的VSMCs的迁移,并呈浓度依赖性(P<0.05)。叶酸降低PCNA表达和PDGFR磷酸化水平,并抑制PDGF激活的ERK1/2信号通路。结论: 叶酸降低PDGF诱导的VSMCs PCNA和p-PDGFR蛋白水平,下调ERK1/2信号通路,从而抑制VSMCs的增殖和迁移。
叶酸; 血管平滑肌细胞; 细胞增殖; 细胞迁移; ERK1/2信号通路
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是血管壁的主要细胞类型,发挥着维持血管正常生理功能的作用。血管平滑肌的异常增殖和迁移在心血管疾病如动脉粥样硬化和冠脉介入后再狭窄的发生发展中扮演重要角色[1]。已有研究表明,在血管损伤修复过程中,多种细胞因子和生长因子会促进平滑肌细胞的增殖迁移,比如血小板源生长因子(platelet-derived growth factor, PDGF)-BB[2]。增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)蛋白是细胞增殖的重要标志之一,其表达水平的高低反映细胞的增殖活性。PDGF-BB通过与PDGF受体(PDGFR)结合后激活细胞内信号转导通路[包括磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/Akt、细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)和p38丝裂源活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)通路]促进细胞增殖[3]。有研究报道ERK信号通路参与PDGF诱导的平滑细胞增殖迁移[4]。
叶酸(folic acid, FA)是一种广泛存在蔬菜水果中的微量元素,参与DNA的甲基化和DNA合成,具有抗氧化、清除自由基、抗炎等作用。研究发现叶酸对心血管疾病具有良好的防治作用[5]。Huo等[6]报道中国患者在降压治疗的同时补充叶酸能显著降低首次卒中的发作风险。但目前叶酸对心血管疾病的防治机制尚不清楚。本实验探讨叶酸对血管平滑肌细胞增殖迁移的影响及其机制。
材 料 和 方 法
1 动物
6周龄SPF级SD大鼠,雌雄不限,体重150~180 g。由上海斯莱克实验动物有限责任公司提供,许可证号为SCXK(沪)2012-0002。
2 主要试剂
DMEM培养基、PBS、0.25%胰蛋白酶-EDTA、青霉素和链霉素、DAPI购自杭州吉诺生物医药技术有限公司;胎牛血清购自Gibco;Transwell侵袭小室购自BD Biosciences;PDGF-BB购自Sigma;EdU试剂盒购自广州锐博生物科技有限公司;CCK-8试剂盒和PD98059购自上海碧云天生物技术有限公司;抗PCNA、p-PDGFR、PDGFR、p-ERK1/2、ERK1/2和GAPDH抗体购自Abcam。
3 主要方法
3.1 大鼠原代血管平滑肌细胞提取及鉴定 采用改良的组织贴块法[7]培育大鼠胸主动脉VSMCs,用形态学观察和细胞免疫荧光检测α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)鉴定VSMCs,通过α-SMA与DAPI核染之间的关系鉴定VSMCs的纯度。取第3~7代细胞用于实验。
3.2 实验分组 取大鼠主动脉,用改良的组织块法分离VSMCs。用10% 胎牛血清、DMEM培养基培养细胞。取第3~7代细胞进行实验。待细胞生长汇合至70%~80%后,将10% 胎牛血清的DMEM培养基换成无胎牛血清的DMEM培养基培养24 h,使细胞同步化后再进行干预实验。实验分组分为5组,分别为对照组(不作任何干预)、PDGF组(仅加入PDGF-BB 20 μg/L干预)和不同叶酸浓度组[分别加入不同叶酸浓度(1、10、50 μmol/L)预处理24 h,再加入PDGF-BB(20 μg/L)与不同叶酸浓度共同干预24 h]。另外,设置ERK1/2信号通路抑制组(30 μmol/L PD98059[8]预处理24 h,再加入PDGF-BB 20 μg/L),即PD98059组,验证叶酸对ERK1/2信号通路的影响。
3.3 CCK-8检测法检测VSMCs 活力 取第3代对数期VSMCs制成细胞悬液接种于96孔板,每孔加入细胞悬液100 μL(细胞数为每孔5×103个), 在培养箱(37 ℃、5% CO2)中培养24 h后换成无胎牛血清的DMEM培养液培养24 h,使细胞同步化后再加入各组干预因子进行实验。每组重复3个复孔,2个空白对照组,置于培养箱(37 ℃、5% CO2)中培养24 h和48 h后每孔加入10 μL CCK-8溶液,置于培养箱(37 ℃、5% CO2)中培养1 h。用酶标仪测定在450 nm处的吸光度值,以吸光度值代表VSMCs的活力水平。
3.4 EdU实验检测VSMCs的增殖能力 取第3代对数期VSMCs制成细胞悬液接种于96孔板,每孔加入细胞悬液100 μL(细胞数为每孔5×103个), 在培养箱(37 ℃、5% CO2)中培养24 h后换成无胎牛血清的DMEM培养液培养24 h,使细胞同步化后再加入各组干预因子培养24 h后加入EdU孵育2 h标记增殖细胞,用4%的多聚甲醛固定细胞,Apollo染色液染色后进行DNA染色,用荧光显微镜观察细胞增殖情况并拍照。
3.5 划痕实验检测VSMCs的迁移能力 取第3代对数期VSMCs制成细胞悬液。以每孔5×105个细胞接种于6孔板中。待细胞生长至汇合70%~80%后,用无菌的100 μL移液枪头以垂直6孔板底面沿中轴轻划出一条直线,用PBS缓冲液漂洗3次,洗去划痕造成的细胞碎片。用无胎牛血清的DMEM培养基培养12 h,使细胞同步化并同时加入 1.8 mmol /L 羟基脲作用 12 h抑制细胞增殖。在0 h和24 h分别用倒置光学显微镜观察细胞迁移情况并拍照。
3.6 Transwell法检测VSMCs的侵袭能力 取第3代对数期VSMCs制成细胞悬液。加入100 μL无血清培养的1×109/L的细胞悬浮液加于Transwell小室上室中,下室加入500 μL的含10%胎牛血清的DMEM,每组设置3个复孔,在培养箱(37 ℃、5% CO2)中培养24 h,取出Transwell小室,用棉签轻轻擦去上室未穿透的细胞,PBS缓冲液轻洗3次,4%多聚甲醛固定10 min,0.1%结晶紫染色30 min,在显微镜下随机选取5个视野计数穿膜细胞数目,取平均值,放大倍数为100倍。
3.7 Western blot检测相关蛋白的表达水平 收集各组细胞裂解蛋白加样,120 V电泳至溴酚蓝到凝胶底部时停止。250 mA电转膜2 h,将膜放入5%脱脂奶粉的TBST中封闭30 min。加Ⅰ抗,于摇床上4 ℃孵育过夜,TBST洗涤 10 min、3次。加Ⅱ抗,于摇床上室温孵育2 h,TBST洗涤3次,每次10 min。用ECL液曝光、显影。应用凝胶成像系统摄像,对所得图像进行灰度值分析,以GAPDH为内参照。用Quantity One软件定量分析。
4 统计学处理
采用SPSS 19.0软件进行统计分析,所有实验重复3次,数据均采用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 叶酸抑制PDGF诱导的VSMCs活力和增殖能力以及增殖标志蛋白PCNA的表达
CCK-8实验和EdU实验检测各组VSMCs活力和增殖能力,结果图1所示。PDGF组显示PDGF促进VSMCs活力和增殖能力增加,叶酸可抑制PDGF诱导的VSMCs活力和增殖能力(P<0.05),并呈浓度依赖性。各组PCNA蛋白的表达水平如图2所示,PDGF组的PCNA蛋白表达水平明显高于对照组(P<0.05),不同浓度叶酸均抑制PDGF诱导的PCNA蛋白表达(P<0.05),并呈浓度依赖性。

Figure 1.The effects of folic acid on VSMCs viability and proliferation were measured by CCK-8 assay and EdU cell proliferation assay (×100). Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs PDGF group.
2 叶酸抑制PDGF诱导的VSMCs迁移
划痕实验检测各组VSMCs迁移结果如图3所示,PDGF组显示PDGF促进VSMCs迁移,叶酸抑制PDGF诱导的VSMCs迁移(P<0.05),并呈浓度依赖性。Transwell法检测结果显示,对照组、PDGF组以及叶酸1 μmol/L、10 μmol/L和50 μmol/L组的侵袭细胞数分别为48±5、385±11、273±8、186±7和126±5,PDGF组的细胞侵袭能力明显高于对照组,而不同浓度叶酸组的细胞侵袭能力明显低于PDGF组,差异有统计学意义(P<0.05),见图3。
3 叶酸抑制PDGF激活的ERK1/2信号通路
如图4所示,PDGF组p-PDGFR的蛋白水平明显高于对照组(P<0.05),不同浓度叶酸抑制PDGF诱导的p-PDGFR蛋白水平升高(P<0.05),并呈浓度依赖性。PDGF组p-ERK1/2的蛋白水平明显高于对照组(P<0.05),说明PDGF激活ERK1/2信号通路。不同浓度叶酸抑制PDGF诱导的p-ERK1/2蛋白水平升高(P<0.05),并呈浓度依赖性,提示叶酸抑制PDGF激活的ERK1/2信号通路。

Figure 2.The effect of folic acid on the protein expression of PCNA in the VSMCs was detected by Western blot. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs PDGF group.
4 叶酸通过下调ERK1/2 抑制PDGF诱导的VSMCs活力和增殖迁移能力
为了证实ERK1/2信号通路参与PDGF诱导VSMCs活力和增殖迁移能力,本研究加入ERK1/2通路抑制剂PD98059[8],验证PD98059对PDGF诱导VSMCs活力和增殖迁移能力的作用,结果如图5显示。PD98059抑制PDGF诱导的VSMCs活力和增殖迁移能力(P<0.05)。
讨 论
本研究结果显示PDGF能促进VSMCs活力、增殖迁移能力和PCNA蛋白的表达,并发现叶酸能抑制PDGF诱导的VSMCs活力、增殖迁移能力和PCNA、PDGFR蛋白的表达,并进一步提示具有量效关系,PDGF激活ERK1/2信号通路,而叶酸抑制PDGF-BB激活的ERK1/2信号通路。ERK1/2信号通路抑制剂PD98059同样抑制PDGF-BB诱导的VSMCs活力、增殖迁移能力和PCNA、PDGFR蛋白的表达。这些结果表明叶酸的这种效应是通过下调ERK1/2信号通路实现的。
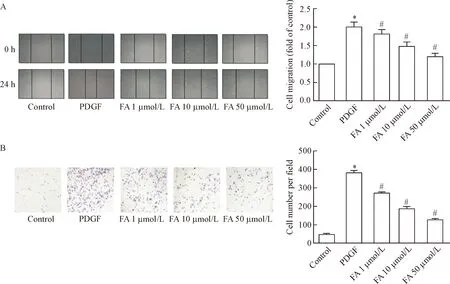
Figure 3.The effects of folic acid on the migration (A) and invasion (B) of the VSMCs were examined by wound healing assay and Transwell assay (×100). Mean±SD. n=3. * P<0.05 vs control group; #P<0.05 vs PDGF group.

Figure 4.The effects of folic acid on the phosphorylation of PDGFR and ERK1/2 in the VSMCs were detected by Western blot. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs PDGF group.
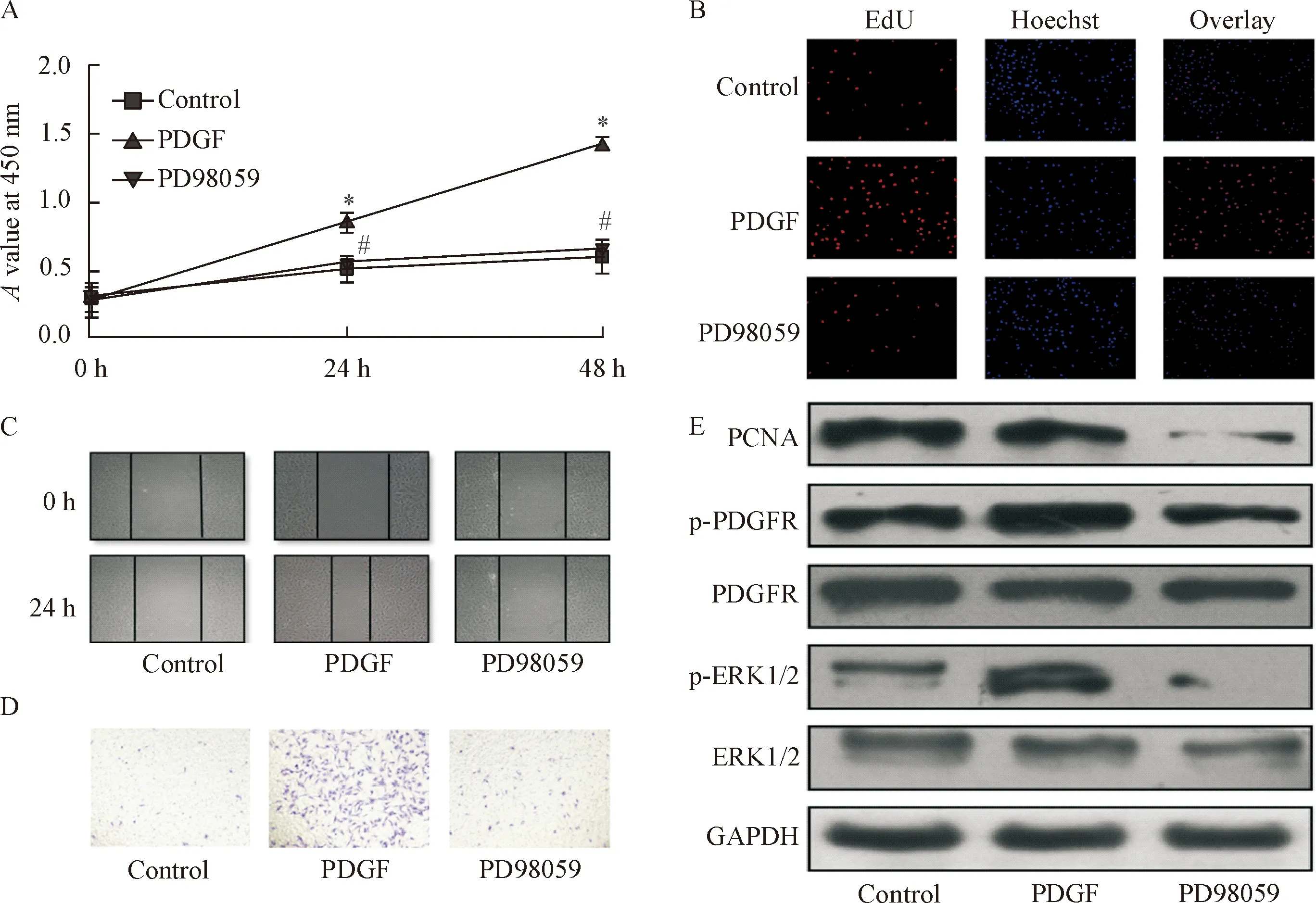
Figure 5.The effect of folic acid on ERK1/2 signaling pathway verified by ERK1/2 inhibitor PD98059 was determined. A: the viability of the VSMCs was measured by CCK-8 assay; B: the proliferation ability of the VSMCs was examined by EdU cell proli-feration assay (×100); C: the migration ability of the VSMCs was examined by wound healing assay (×100); D: the invasion ability of the VSMCs was examined by transwell assay (×100); E: the protein levels of PCNA, p-PDGFR and p-ERK1/2 were determined by Western blot. Mean±SD. n=3. * P<0.05 vs control group; #P<0.05 vs PDGF group.
叶酸与其活性代谢物质5-甲基四氢叶酸是人类必需的营养物质,在核苷酸的合成和甲基化反应中扮演重要角色[9]。流行病学研究表明补充叶酸能降低心血管疾病不良事件的发生风险[10]。外源性补充叶酸可抑制氧化应激,改善血管内皮功能,延缓动脉粥样硬化的进展,有助于冠心病的防治。高剂量叶酸预处理改善缺血心肌功能,并减轻缺血再灌注损伤[11]。Cheng等[12]报道叶酸通过抑制ERK1/2/NOX4/ROS信号通路减轻由低氧所致的血管内皮细胞损伤。何志勇等[13]报道叶酸通过减少内皮细胞表达Bax及Bcl-2,下调Bax/Bcl-2比值,拮抗同型半胱氨酸诱导的内皮细胞凋亡,发挥心血管保护作用。与这些研究结果相结合,本研究结果表明叶酸通过抑制血管平滑肌增殖迁移发挥血管保护作用。
ERK是丝裂原活化蛋白激酶家族的一员。ERK信号通路由有丝分裂原刺激激活并在调节细胞增殖和分化中具有重要地位。PDGF与PDGFR结合启动多种生物学效应通过激活细胞内信号传导通路促进血管平滑肌增殖迁移和胶原合成[14]。汤娜娜等[15]报道缺氧时生成增多的活性氧通过活化ERK1/2信号通路,促进肺动脉平滑肌细胞增殖。Luo等[16]报道血浆升高的S-腺苷同型半胱氨酸通过激活ERK1/2信号通路诱导血管平滑肌增殖迁移,促进动脉粥样硬化形成。Kingsley等[4]报道在平滑肌细胞中,ERK1/2通路参与PDGF-BB诱导的血管平滑肌细胞增殖迁移。越来越多的研究表明,抑制ERK1/2信号通路可以抑制VSMCs的增殖迁移。Chen等[8]报道dihydroaustrasulfone alcohol抑制ERK1/2信号通路抑制VSMCs的增殖迁移。Shi等[17]报道Liraglutide通过抑制ERK1/2信号通路减弱高糖诱导的VSMCs的增殖迁移。本研究结果显示叶酸阻断PDGFR的磷酸化,随后抑制由PDGFR介导的ERK1/2信号通路。因此,本研究提示叶酸可能是抑制PDGFR磷酸化从而抑制PDGFR调节的ERK1/2信号转导通路,来抑制血管疾病中异常的血管平滑肌的增殖迁移。
[1] Bennett MR, Sinha S, Owens GK. Vascular smooth muscle cells in atherosclerosis [J]. Circ Res, 2016, 118(4): 692-702.
[2] Doran AC, Meller N, McNamara CA. Role of smooth muscle cells in the initiation and early progression of athe-rosclerosis [J]. Arterioscler Thromb Vasc Biol, 2008, 28(5): 812-819.
[3] Zhan Y, Kim S, Izumi Y, et al. Role of JNK, p38, and ERK in platelet-derived growth factor-induced vascular proliferation, migration, and gene expression [J]. Arterioscler Thromb Vasc Biol, 2003, 23(5): 795-801.
[4] Kingsley K, Huff JL, Rust WL, et al. ERK1/2 mediates PDGF-BB stimulated vascular smooth muscle cell proliferation and migration on laminin-5 [J]. Biochem Biophys Res Commun, 2002, 293(3): 1000-1006.
[5] Guo H, Lee JD, Xing Y, et al. Changes of homocysteine levels and arterial endothelial function in patients with high risk of coronary artery disease after 6-month folic acid supplementation [J]. Acta Cardiol, 2004, 59(5): 503-506.
[6] Huo Y, Li J, Qin X, et al. Efficacy of folic acid therapy in primary prevention of stroke among adults with hypertension in China: the CSPPT randomized clinical trial [J]. JAMA, 2015, 313(13): 1325-1335.
[7] 孟立平, 蒋承建, 赵 飞, 等. 大鼠胸主动脉血管平滑肌细胞原代培养方法的改进 [J]. 温州医科大学学报, 2015, 45(8): 593-596.
[8] Chen YC, Wen ZH, Lee YH, et al. Dihydroaustrasulfone alcohol inhibits PDGF-induced proliferation and migration of human aortic smooth muscle cells through inhibition of the cell cycle [J]. Mar Drugs, 2015, 13(4): 2390-2406.
[9] Zhu L, Yu J, Jia B, et al. Effect of losartan with folic acid on plasma homocysteine and vascular ultrastructural changes in spontaneously hypertensive rats [J]. Int J Clin Exp Pathol, 2015, 8(10): 12908-12914.
[10]Duthie SJ, Beattie JH, Gordon MJ, et al. Nutritional B vitamin deficiency alters the expression of key proteins associated with vascular smooth muscle cell proliferation and migration in the aorta of atherosclerotic apolipoprotein E null mice [J]. Genes Nutr, 2015, 10(1): 446.
[11]Moens AL, Champion HC, Claeys MJ, et al. High-dose folic acid pretreatment blunts cardiac dysfunction during ischemia coupled to maintenance of high-energy phosphates and reduces postreperfusion injury [J]. Circulation, 2008, 117(14): 1810-1819.
[12]Cheng F, Lan J, Xia W, et al. Folic acid attenuates vascular endothelial cell injury caused by hypoxia via the inhibition of ERK1/2/NOX4/ROS pathway [J]. Cell Biochem Biophys, 2016, 74(2): 205-211.
[13]何志勇, 张 雄, 王小同. 叶酸拮抗同型半胱氨酸诱导的内皮细胞凋亡的作用机制 [J]. 中国病理生理杂志, 2007, 23(4): 699-701.
[14]Raines EW. PDGF and cardiovascular disease [J]. Cytokine Growth Factor Rev, 2004, 15(4): 237-254.
[15]汤娜娜, 刘先胜, 徐永健, 等. 活性氧和ERK1/2信号通路在缺氧大鼠肺动脉平滑肌细胞增殖和凋亡中的作用 [J]. 中国病理生理杂志, 2009, 25(1): 36-41.
[16]Luo X, Xiao Y, Song F, et al. Increased plasmaS-adenosyl-homocysteine levels induce the proliferation and migration of VSMCs through an oxidative stress-ERK1/2 pathway inapoE-/-mice [J]. Cardiovasc Res, 2012, 95(2): 241-250.
[17]Shi L, Ji Y, Jiang X, et al. Liraglutide attenuates high glucose-induced abnormal cell migration, proliferation, and apoptosis of vascular smooth muscle cells by activating the GLP-1 receptor, and inhibiting ERK1/2 and PI3K/Akt signaling pathways [J]. Cardiovasc Diabetol, 2015, 14:18.
(责任编辑: 卢 萍, 罗 森)
Folic acid inhibits proliferation and migration of vascular smooth muscle cells by down-regulating ERK1/2 signaling pathway
PAN Sun-lei1, 2, LIN Hui1, 2, LUO Hang-qi2, GAO Fei-dan2, MENG Li-ping2, ZHOU Chang-zuan2, JIANG Cheng-jian2, CHI Ju-fang2, GUO Hang-yuan1, 2
(1TheFirstClinicalMedicalCollege,WenzhouMedicalUniversity,Wenzhou325000,China;2DepartmentofCardiology,ShaoxingPeople’sHospital,Shaoxing312000,China.E-mail:ghangyuan@hotmail.com)
AIM: To elucidate the effect of folic acid (FA) on the proliferation and migration of vascular smooth muscle cells (VSMCs) and the related mechanism. METHODS: VSMCs were derived from SD rats and culturedinvitro. The cells were randomly divided and treated as indicated. CCK-8 assay and EdU cell proliferation assay were employed to assess the viability and proliferation ability of the VSMCs. Wound healing assay and Transwell chamber assay were used to assess migration ability of the VSMCs. The protein level of proliferating cell nuclear antigen (PCNA), and the phosphorylation of platelet-derived growth factor receptor (PDGFR) and extracellular signal-regulated kinase 1/2 (ERK1/2) in the VSMCs were determined by Western blot. RESULTS: FA inhibited PDGF-induced VSMC viability and proliferation in a dose-dependent manner (P<0.05). FA inhibited PDGF-induced VSMC migration in a dose-dependent manner (P<0.05). FA down-regulated PCNA and p-PDGFR protein levels and blocked PDGF-activated ERK1/2 signaling pathway. CONCLUSION: FA inhibits VSMC proliferation and migration via down-regulating the expression of PCNA and the level of p-PDGFR, and blocking ERK1/2 signal transduction pathway.
Folic acid; Vascular smooth muscle cells; Cell proliferation; Cell migration; ERK1/2 signaling pathway
1000- 4718(2017)03- 0405- 06
2016- 11- 10
2016- 12- 21
浙江省科技厅公益项目(No. 2016C33227)
△通讯作者 Tel: 0575-88228888; E-mail: ghangyuan@hotmail.com
R363.2; R543.3+1
A
10.3969/j.issn.1000- 4718.2017.03.004

