阿苯达唑纳米脂质体冻干粉的制备及性质考察Δ
陈 蓓,陈春燕,高惠静,王建华,赵 军(新疆医科大学第一附属医院药学部,乌鲁木齐 830011)
阿苯达唑纳米脂质体冻干粉的制备及性质考察Δ
陈 蓓*,陈春燕,高惠静,王建华,赵 军#(新疆医科大学第一附属医院药学部,乌鲁木齐 830011)
目的:制备阿苯达唑纳米脂质体冻干粉并对其性质进行考察。方法:利用冷冻干燥法制备阿苯达唑纳米脂质体冻干粉,以粒径、包封率联合外观、再分散性为指标,采用单因素试验联合正交试验筛选冻干处方工艺。考察冻干前、后脂质体的形态学变化、粒径、Zeta电位、水分含量、4℃下12个月的稳定性。结果:采用外加冻干保护剂的总量为10%,其中葡萄糖-海藻糖-甘露醇配比为1.0∶1.0∶3.0,以速冻的方式,于-35℃冰箱预冻18 h,冷冻干燥48 h获得冻干粉。与冻干前比较,冻干后脂质体形态未发生明显变化,可见清晰的磷脂双分子层膜结构;冻干前、后脂质体的粒径分别为(208.63±1.04)、(223.04±2.02)nm,Zeta电位分别为 (-15.6±0.04)、(-19.4±0.06)mV,包封率分别为(94.62±0.49)%、(91.10±0.46)%(n=3);与脂质体比较,脂质体冻干粉在4℃下12个月较稳定。结论:成功制得阿苯达唑纳米脂质体冻干粉,其稳定性优于阿苯达唑纳米脂质体,冻干工艺可行。
阿苯达唑;纳米脂质体;冻干粉;粒径;包封率;稳定性;正交试验
包虫病是一种严重危害人畜健康的寄生虫病,新疆是包虫病高发区。阿苯达唑(Albendazole,ABZ)是世界卫生组织(WHO)推荐抗包虫的主要药物之一,但是因其水溶性差、肠道吸收不好、生物利用度不高,严重影响了其疗效[1]。ABZ纳米脂质体(NL-ABZ)是针对上述问题而研究的一种新型给药系统。NL-ABZ的处方包含0.5%~1.0%阿苯达唑、1.0%~3.0%卵磷脂、0~0.3%苯甲酸钠、0~0.02%抗氧剂和0.7%~0.9%氯化钠溶液,平均粒径为200 nm,制备工艺为微射流高压均质工艺。大鼠预实验结果表明,与普通ABZ脂质体(L-ABZ)相比,NL-ABZ的生物利用度显著提高。然而液态的纳米脂质体混悬液的物理化学稳定性差,磷脂也易水解氧化,并且药物也容易泄漏,且粒子的聚集导致粒径变大[2],是其应用于临床的主要局限。真空冷冻干燥技术制备冻干脂质体是目前解决液态脂质体不能长期储存、提高脂质体稳定性的最佳方法。冻干制剂特有的疏松多孔结构,可以使药物易于重新复溶而恢复活性;而且冻干制剂含水量低,易长期稳定保存,可以有效避免脂质体以水溶液方式贮存导致的易氧化、水解、聚集、分层、渗漏等问题[3-5]。本研究拟制备NL-ABZ冻干粉,优化冻干处方工艺,并考察冻干制剂的理化性质和稳定性。
1 材料
1.1 仪器
FDU-1100冷冻干燥机(东京理化器械株式会社);ZEN3690激光粒度分布仪(英国马尔文公司);JSM-1230透射电子显微镜(日本电子株式会社);HS153梅特勒水分测定仪(瑞士Mettler Toledo公司)。
1.2 药品与试剂
ABZ原料药(广西桂林南药股份有限公司,批号:M-D60605,纯度:99%);大豆磷脂Epikuron 200(德国Lucas Meyer Gmbh公司);0.9%氯化钠注射液(国药集团新疆制药有限公司,批号:20130122);葡萄糖(天津市盛奥化学试剂有限公司,批号:20120618);麦芽糖(上海蓝季科技发展有限公司,批号:20120812);海藻糖(国药集团化学试剂有限公司,批号:20120702);蔗糖、乳糖(天津市天新精细化工开发中心,批号:20120710、20120909);甘露醇(天津永晟精细化工有限公司,批号:20121001);木糖醇、山梨醇(天津市光复精细化工研究所,批号:20121113、20120309);以上试剂均为分析纯。
2 方法与结果
2.1 冻干粉评价指标
2.1.1 粒径 测定复溶后的纳米脂质体冻干粉粒径,与冻干前纳米脂质体粒径变化不大者为佳。
2.1.2 包封率 测定复溶后的纳米脂质体冻干粉包封率[6],比冻干前纳米脂质体包封率降低较少者为佳。
2.1.3 外观 以保持原体积、饱满、不皱缩、不塌陷、可整块脱落但不散碎为佳。以“+++”表示松散、光滑、平整饱满;“++”表示轻度皱缩、塌陷;“+”表示严重皱缩、塌陷;“-”表示不能成型。
2.1.4 再分散性 取纳米脂质体冻干粉,加入与冻干前同体积的0.9%氯化钠注射液,振摇分散。振摇后能很快分散、无不溶颗粒或团块,得到均匀的纳米脂质体混悬液者为佳。以“+++”表示振摇1 min内能复溶成均匀混悬液,无不溶颗粒或团块;“++”表示振摇1~3 min内能复溶成较均匀混悬液,肉眼可见少量不溶颗粒;“+”表示振摇5 min仍不能复溶成较均匀混悬液,黏壁,肉眼可见部分不溶颗粒或团块。
2.2 统计学方法
2.3 NL-ABZ的制备
取处方量的ABZ原料药、大豆磷脂,按质量比1∶2混合,加入至适量冰醋酸中溶解,快速搅拌下快速加入氢氧化钠溶液中和,调pH至6~7。置于透析袋内以0.9%氯化钠注射液透析,冰水浴超声40 min,4 000 r/min(离心半径:6 cm)离心15 min。弃上清,加苯甲酸钠和0.9%氯化钠注射液制得脂质体初品,再以微射流高压均质处理得到NL-ABZ,规格为10 g/L。
2.4 NL-ABZ冻干工艺的考察
冻干工艺一般分为预冻、升华干燥、解析干燥3步[7]。本试验以10%甘露醇为冻干保护剂,以粒径和包封率为主要评价指标,以冻干样品外观和再分散性为辅助参考指标,分别对预冻方式、预冻温度、预冻时间及干燥时间进行单因素考察。
2.4.1 预冻方式 预冻方式分为慢冻和速冻2种。本试验分别考察了速冻(直接于-35℃放置18 h)、慢冻(4℃放置1 h,-18℃放置12 h,-35℃放置5 h)条件对冻干产品的影响。结果显示,速冻优于慢冻。
2.4.2 预冻温度 根据文献[8]报道,预冻的最低温度至少要低于样品共熔点以下10℃。本试验考察了预冻温度分别为-18、-35、-80℃时对冻干产品的影响。结果显示,最适预冻温度为-35℃。
2.4.3 预冻时间 如果预冻时间过短,在干燥阶段易导致喷瓶,影响包封率及外观;预冻时间过长又会增加不必要的能耗[9]。本试验考察了预冻时间分别为12、18、24 h时对冻干产品的影响。结果显示,最适预冻时间为18 h。
2.4.4 干燥时间 干燥时间决定了样品中的含水量,干燥时间不够,样品中含有较高的水分,外观塌陷,复溶时极易黏壁,造成产品外观和再分散性都不理想。本试验考察了总干燥时间分别为24、36、48 h时对冻干产品的影响。结果显示,最适干燥时间为48 h。
2.5 冻干保护剂的筛选
以粒径和包封率为主要评价指标,以冻干样品外观和再分散性为辅助参考指标,对冻干保护剂进行筛选。2.5.1 加入方式 冻干保护剂的加入方式分为外加和内加2种。本试验以10%甘露醇为冻干保护剂,考察了内加、外加对冻干产品的影响。结果显示,内加、外加方式制得的NL-ABZ冻干粉复溶后的粒径分别为(255.30±3.32)、(251.71±2.61)nm,包封率分别为(75.90±1.18)%、(76.53±0.61)%,外观分别为“++”“++”,再分散性分别为“++”“++”。这表明冻干保护剂的加入方式对该冻干制剂的上述指标无明显影响(P>0.05),但外加冻干保护剂的用量较少,便于清洗高压均质机,故确定采用外加方式。
2.5.2 单一冻干保护剂的筛选 固定冻干保护剂总量为10%,以不加任何冻干保护剂所制得的NL-ABZ冻干粉作为阴性对照,考察不同单一冻干保护剂(葡萄糖、麦芽糖、蔗糖、乳糖、海藻糖、甘露醇、山梨醇、木糖醇)对冻干产品的影响,结果见表1。
由表1可知,各种冻干保护剂单独使用均不能达到冻干制剂的要求。综合考察,以甘露醇、葡萄糖、海藻糖三者合用作为冻干保护剂,以期达到满意的效果。
2.5.3 正交试验优选冻干保护剂 以葡萄糖(A)、海藻糖(B)、甘露醇(C)3种冻干保护剂的质量比为因素,每个因素设3个水平,以综合评分[(最小粒径/平均粒径)× 50%+(平均包封率/最大包封率)×50%]为指标,按L9(34)表设计正交试验。因素与水平见表2,正交试验设计与结果见表3,方差分析结果见表4。
由表3可知,对综合评分的影响大小先后顺序为A>C>B;由表4可知,A和C对综合评分均有显著影响(P<0.05)。综合考虑,确定最优冻干保护剂处方为A1B1C1,即葡萄糖-海藻糖-甘露醇(1.0∶1.0∶3.0)。为验证上述结果的重现性,保证纳米脂质体冻干粉制备工艺的稳定可行,按上述条件制备3批冻干粉进行验证试验。结果显示,3批冻干粉复溶后粒径为(223.04± 2.02)nm,包封率为(91.10±0.46)%。
2.5.4 冻干保护剂总量的考察 固定葡萄糖-海藻糖-甘露醇质量比为1.0∶1.0∶3.0,考察冻干保护剂总量分别为4%、8%、12%、16%、20%时对冻干产品的影响,结果见表5。

表1 不同单一冻干保护剂对冻干粉的影响(n=3)Tab 1 Effects of different single freeze-dried protective agents on freeze-dried powder(n=3)

表2 因素与水平Tab 2 Factors and levels

表3 正交试验设计与结果Tab 3 Design and results of orthogonal test
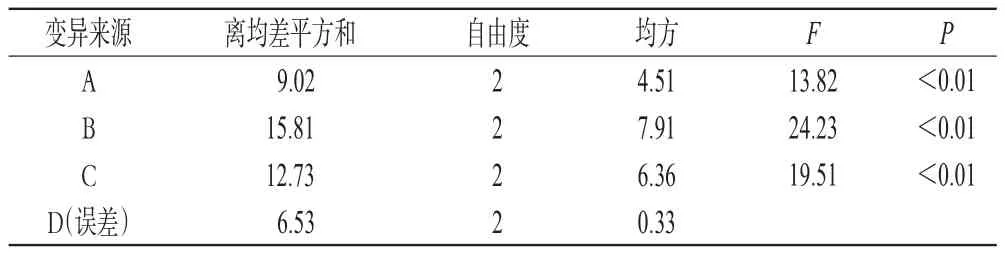
表4 方差分析结果Tab 4 Result of variance analysis
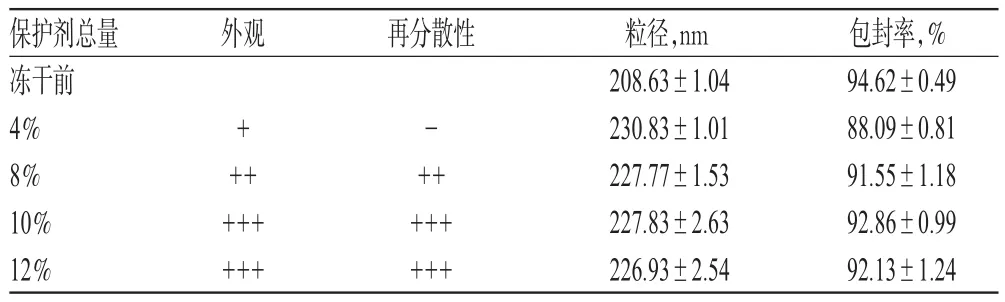
表5 不同总量冻干保护剂对冻干粉的影响(n=3)Tab 5 Effects of freeze-dried protective agents with different contents on freeze-dried powder(n=3)
由表5可知,当冻干保护剂总量为10%、12%时,冻干产品粒径、包封率、外观和再分散性等指标均为最佳。考虑到制备成本,最后确定冻干保护剂总量为10%。
综上所述,取NL-ABZ,外加10%冻干保护剂[葡萄糖-海藻糖-甘露醇(1.0∶1.0∶3.0)],-35℃预冻18 h,干燥48 h,制得NL-ABZ冻干粉。
2.6 NL-ABZ冻干粉的性质考察
2.6.1 形态学 取适量NL-ABZ及NL-ABZ冻干粉,加入0.9%氯化钠注射液稀释。用1%醋酸双氧铀负染法制样,干燥后置于透射电子显微镜下观察形态,结果见图1。

图1 NL-ABZ和NL-ABZ冻干粉的电镜图(×7 000)Fig 1 Electron microscopy of NL-ABZ and NL-ABZ freeze-dried power(×7 000)
由图1可见,NL-ABZ外观圆整、大小均一,可清晰观察到磷脂双分子层结构。NL-ABZ冻干粉复溶后脂质体形态未发生明显改变,有清晰的磷脂双分子层膜结构。
2.6.2 粒径和Zeta电位 取适量NL-ABZ及NL-ABZ冻干粉,加入0.9%氯化钠注射液稀释,混匀后采用激光粒度分布仪测定粒径和Zeta电位。结果显示,NL-ABZ(冻干前)的平均粒径为(208.63±1.04)nm,Zeta电位为(-15.60±0.04)mV;NL-ABZ冻干粉(冻干后)复溶后的平均粒径为(223.04±2.02)nm,Zeta电位为(-19.40±0.06)mV,表明冻干前后粒径及Zeta电位无显著变化。NL-ABZ冻干前、后的粒径分布见图2,Zeta电位见图3。
2.6.3 水分含量 采用梅特勒水分测定仪测定NL-ABZ冻干粉的含水量为3.12%(<5%),说明处方工艺可行。
2.6.4 稳定性 以粒径、包封率、磷脂氧化指数、ABZ含量为指标,分别考察4℃条件下NL-ABZ(冻干前)和NL-ABZ冻干粉(冻干后)12个月内的稳定性,结果见表6。

图2 NL-ABZ冻干前、后的粒径分布Fig 2 Particle size distributions of NL-ABZ before and after freeze-drying
图3 NL-ABZ冻干前、后的Zeta电位Fig 3 Zeta potentials of NL-ABZ before and after freeze-drying
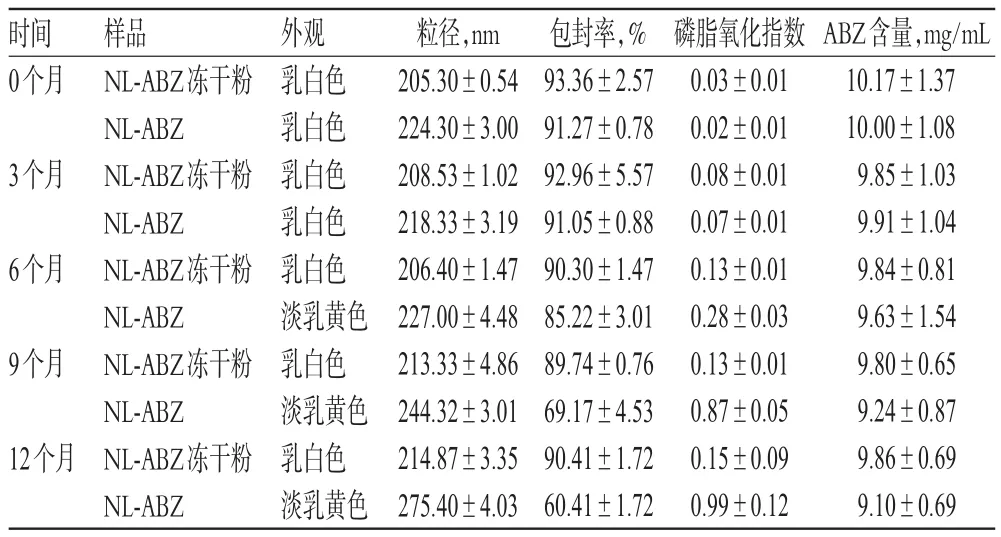
表6 4℃下12个月内的稳定性试验结果(n=3)Tab 6 Results of stability test within 12 months at 4℃(n=3)
由表6可知,NL-ABZ在4℃下贮存,随放置时间的延长,其外观逐渐变黄,粒径增大的幅度较大;6个月时磷脂氧化指数略超过0.2,磷脂被氧化;9个月时包封率已下降至70%以下;12个月时ABZ含量与0个月时比较显著下降(P<0.05)。NL-ABZ冻干粉于4℃下贮存,放置12个月的外观、粒径、包封率、磷脂氧化指数及ABZ含量与0个月时比较均无明显变化(P>0.05)。由此可见,冻干工艺能明显延长NL-ABZ在4℃下的稳定性。
3 讨论
糖类冻干保护剂能够有效防止脂质体在冷冻干燥过程中的破坏,目前主要认为有两大机制:玻璃化和水取代机制[10]。预冻过程中,糖类溶液作为保护剂能诱导玻璃态的生成,使磷脂膜免受冰晶的机械破坏,减小冰晶嵌入脂质体双分子层膜的概率,防止膜破裂;同时可以作为间隔基质,阻碍脂质体粒子之间的相互融合和聚集,但本身属于无定形保护剂,在冻干时不会有良好的外观[11]。另一个保护机制是水取代机制。糖类作为冻干保护剂可与脂质体中磷脂的头部基团形成氢键,脱水后代替水分作为脂质体的保护剂,保持脂质体双分子膜的完整性,避免包封药物的泄漏[12]。
醇类冻干保护剂甘露醇由于自身结晶的支撑能力,容易获得饱满的外观,但是结晶的形成又会对脂质体膜造成机械破坏,导致脂质体的包封率下降和粒径的增大。
然而一个合格的脂质体冻干粉制剂应同时满足两个条件:(1)需要有玻璃态(无定形)存在,能保护脂质体膜不受到冰晶的机械破坏作用;(2)外观饱满、平整、致密,有一定硬度,在升华干燥阶段不会塌陷。这是两个相互制约的方面。而本文考察的各种保护剂单独使用也均不能同时满足上述两个条件,因此对所有纳入的冻干保护剂进行了两两搭配。结果表明,将糖类与醇类联用时,不仅能获得良好的外观和再分散性,复溶后的脂质体粒径和包封率较冻干前也无明显变化(P>0.05),能够获得满意的冻干保护效果。
[1] 柴君杰,孟贺巴特,焦伟,等.阿苯达唑乳剂治疗肝囊性包虫病212例临床疗效观察[J].中国寄生虫学与寄生虫病杂志,2001,19(3):129-134.
[2] 蔡明志,王昆,黄复生.温度对冻干脂质体物理化学稳定性的影响研究[J].第三军医大学学报,2004,26(6):552-554.
[3] 袁松,孙会敏,丁丽霞.脂质体物理化学稳定性研究进展[J].中国药事,2011,25(4):384-388.
[4] 唐文雅,宋艳志,邓意辉.脂质体冻干保护剂的种类及其作用机制研究进展[J].沈阳药科大学学报,2012,29(7):560-569.
[5] 鲍士宝,喻婷婷,马福敏,等.VC纳米脂质体悬浮液及其前体脂质体的制备与稳定性研究[J].食品工业科技,2013,34(3):228-236.
[6] 陈蓓,袁明奎,赵军,等.葡聚糖凝胶色谱法测定阿苯达唑脂质体包封率的方法研究[J].中国药房,2012,23(45):4281-4285.
[7] 张丽霞,王会娟,孙莉.两性霉素B长循环脂质体冻干剂的制备工艺研究[J].药学与临床研究,2007,15(5):384-386.
[8] 孙歆慧,王征,曾婧娉.pH值敏感型脂质体表面修饰技术的研究进展[J].现代药物与临床,2012,27(6):619-623.
[9] 张晓茹,王宝华,倪健,等.注射用丹参无菌粉末冷冻干燥工艺研究[J].中国药房,2011,22(31):2902-2904.
[10] Hincha DK,Premakumar R,Zuther E,et al.Fructans from out and rye:composition and effects on membrane stability during drying[J].Biochimicaet Biophysica Acta,2007,1768(6):1611-1619.
[11] 周晖,贺霞,杨文涛,等.表柔比星长循环脂质体冻干粉的制备[J].医药导报,2014,33(7):917-921.
[12] 张献领,鲍士宝,刘春,等.茶多酚前体脂质体的制备及稳定性研究[J].贵州师范大学学报(自然科学版),2014,32(6):71-75.
Preparation and Properties Study of Albendazole Nanoliposomes Freeze-dried Powder
CHEN Bei,CHEN Chunyan,GAO Huijing,WANG Jianhua,ZHAO Jun(Dept.of Pharmacy,the First Affiliated Hospital of Xinjiang Medical University,Urumqi 830011,China)
OBJECTIVE:To prepare the Albendazole nanoliposomes freeze-dried power and study its properties.METHODS:Freeze-drying method was conducted to prepare Albendazole nanoliposomes freeze-dried power,using the particle size,encapsulation efficiency,appearance,redispersibility as indexes,single factor test was combined with orthogonal test to screen freeze-drying preparation technology.The morphological changes,particle size,Zeta potential,moisture content,12 months stability at 4℃before and after freeze-drying were detected.RESULTS:Plus a total content of freeze-dried protective agent was 10%,the ratio of glucose-trehalose-mannitol was 1.0∶1.0∶3.0,using quick-freeze,pre-freezing 18 h in-35℃refrigerator,dry-freezing 48 h to obtain freeze-dried powder.Compared with before freeze-drying,the freeze-dried liposomal morphology had no obvious changes,showing clear phospholipid bilayer membrane structure;the particle sizes before and after freeze-drying were(208.63±1.04)nm and(223.04±2.02)nm,Zeta potentials were(-15.6±0.04)mV and(-19.4±0.06)mV,encapsulation efficiencies were(94.62±0.49)%and(91.10±0.46)%(n=3),respectively.Compared with liposomes,liposomes freeze-dried power had good stability in 12 months at 4℃.CONCLUSIONS:Albendazole nanoliposomes freeze-dried power is prepared successfully,its stability is superior to albendazole nanoliposomes,and the freeze-drying technology is feasible.
Albendazole;Nanoliposomes;Freeze-dried powder;Particle size;Encapsulation efficiency;Stability;Orthogonal test
R943
A
1001-0408(2017)07-0967-04
2016-07-29
2016-09-15)
(编辑:邹丽娟)
新疆重大疾病医学重点实验室——省部共建国家重点实验室培育基地开放项目(No.SKLIB-XJMDR-2014-10)
*主管药师,硕士。研究方向:药物新制剂。电话:0991-4363438。E-mail:chenbei_lisa@163.com
#通信作者:主任药师,硕士。研究方向:新药研发。电话:0991-4363438。E-mail:1184888385@qq.com
DOI10.6039/j.issn.1001-0408.2017.07.30

