杏花中绿原酸提取工艺优化及不同产地和品种杏花中绿原酸的含量比较
罗慧玉,闫伟伟,徐 鹏,曾春萍(.张家口市食品药品检验中心,河北张家口 075000;2.河北医科大学药学院,石家庄 05007)
杏花中绿原酸提取工艺优化及不同产地和品种杏花中绿原酸的含量比较
罗慧玉1,2*,闫伟伟1,2,徐 鹏1,曾春萍1(1.张家口市食品药品检验中心,河北张家口 075000;2.河北医科大学药学院,石家庄 050017)
目的:优化杏花中绿原酸的提取工艺,比较不同产地、不同品种杏花中绿原酸的含量。方法:采用高效液相色谱法测定杏花中绿原酸含量;以提取溶剂乙醇的体积分数、料液比、超声提取次数和超声提取时间为因素,以绿原酸含量为指标,设计单因素和正交试验优化提取工艺,并进行验证试验。采用优化后提取工艺提取并比较7个产地杏花和3个产地山杏花中绿原酸的含量。结果:最优提取工艺为加12倍量的75%乙醇,超声提取2次,每次30 min。在此条件下,杏花绿原酸含量可达77.38 mg/g(RSD=0.58%,n=3);山杏花、杏花中绿原酸含量分别为77.38~83.33、63.12~70.22 mg/g。结论:建立的提取工艺合理、稳定、可行;山杏花中绿原酸含量较杏花高,同品种、不同产地的杏花中绿原酸含量差异不大。
杏花;绿原酸;正交试验;提取工艺;优化;产地;品种
杏花为蔷薇科植物杏(Prunus armeniaca L.)或山杏(Prunus armeniaca L.var.ansu Maxim.)的干燥花,其功能主治为“主补不足、女子伤中、寒热痹、厥逆”[1]。杏主要分布于我国东北、华北、西北、西南及长江中下游各地;山杏主要分布于我国东北、内蒙古及华北地区(如辽宁、河北等),俄罗斯、蒙古也有分布[2]。目前关于杏花中有效成分的文献报道较少,为深入挖掘我国宝贵的中药资源,笔者在前期试验中对杏花的化学成分进行了较系统的研究,从中发现杏花中绿原酸含量较高,可达70 mg/g。而绿原酸具有保护心血管、抗诱变、抗癌、抗菌、抗病毒、降脂降糖及免疫调节等作用[3-4],广范应用于食品、医药、保健和日用化工等领域[5]。
超声波技术利用超声振动使植物组织细胞壁瞬间破裂,促进溶剂渗透入中草药细胞使其释放内含物,可提高有效成分的浸出率、缩短提取时间,同时可避免高温对提取成分的影响,具有省时、节能、快速、高效等特点,近年来被广泛应用于中药材有效成分的提取[6-8]。
为了提高杏花的利用率和判断各产地药材中绿原酸含量的高低,笔者采用单因素和正交试验法,以绿原酸含量为指标优化杏花提取工艺,为其开发利用提供试验依据;并根据最优提取工艺,对7个产地的杏花及3个产地的山杏花中绿原酸进行提取并比较其含量。
1 材料
1.1 仪器
LC 2010A HT高效液相色谱(HPLC)仪、SPD-M10A VP二极管阵列检测器、LC Solution色谱管理系统(日本岛津公司);YF-103型粉碎机(瑞安市永历制药机械有限公司);旋转蒸发仪(上海申生科技有限公司);CPA225D分析天平(德国赛多利斯集团);AS 10200A超声波清洗器(天津奥特赛恩斯仪器有限公司,250 W,50 kHz)。
1.2 药材、对照品与试剂
杏花来源于江苏(2014年3月)、陕西蓝田(2015年3月)、浙江(2014年3月)、陕西旬邑(2015年3月)、山西(2014年3月)、河南(2014年3月)和安徽(2014年3月)7个产地;山杏花来源于北京房山(2015年3月)、河北张家口市区(2015年4月)、河北张家口沽源(2015年4月)3个产地,均由河北省药品检验研究院段吉平主任药师鉴定为蔷薇科植物杏或山杏的干燥花;绿原酸对照品(中国食品药品检定研究院,批号:110753-201314,纯度:96.6%);磷酸、乙腈均为色谱纯,甲醇、乙醇为分析纯。
2 方法与结果
2.1 绿原酸含量的测定
2.1.1 色谱条件确定 色谱柱:YMC-Pack ODS-A C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%磷酸水溶液(9∶91,V/V);检测波长:325 nm;流速:1.0 mL/min;柱温:30℃;进样量:10 μL。取“2.1.2”项和“2.1.3”项溶液(正交试验3号)进样分析,结果主峰与各杂质峰均能达到基线分离,分离度均大于1.5。色谱见图1。

图1 高效液相色谱图Fig 1 HPLC chromatograms
2.1.2 对照品贮备液的制备 精密称取绿原酸对照品12.94 mg,置于25 mL量瓶中,加50%甲醇约10 mL,超声溶解后加50%甲醇定容,得质量浓度为0.500 mg/mL的绿原酸对照品贮备液。
2.1.3 供试品溶液的制备 样品提取后离心(离心半径为11 cm,4 000 r/min)10 min,取上清液蒸去溶剂,残渣加50%甲醇溶解并定容至50 mL量瓶中,即得。
2.1.4 线性关系和定量限试验 分别吸取绿原酸对照品贮备液0.1、0.2、1、2、5、10 mL,置于10 mL量瓶中,加50%甲醇稀释至刻度,摇匀,得绿原酸质量浓度分别为0.005 0、0.010、0.050、0.100、0.250、0.500 mg/mL的对照品溶液,进样测定。以绿原酸对照品质量浓度(x)为横坐标、峰面积(y)为纵坐标,绘制标准工作曲线,得回归方程为y=2.92×107x-1.85×104(r=0.999 9),结果表明绿原酸在0.005 0~0.500 mg/mL范围内峰面积与质量浓度呈良好线性关系。将对照品溶液用50%甲醇不断进行稀释后进样分析,得到绿原酸定量限为0.01 μg/mL(信噪比为10)。
2.1.5 精密度、稳定性、重复性和准确度试验 按相关方法进行操作。结果,精密度试验中绿原酸峰面积的RSD为0.30%(n=5);稳定性试验中峰面积的RSD为0.49%(48 h,n=8);重复性试验中绿原酸平均含量为77.38 mg/g(RSD=0.58%,n=5);准确度试验中低、中、高3个水平样品的平均回收率为98.47%(RSD=1.4%,n=3)。2.1.6 测定法 精密吸取供试品溶液1 mL,置于25 mL量瓶中,用50%甲醇稀释并定容至刻度,摇匀,经0.45 μm微孔滤膜滤过,取续滤液进样测定,计算含量。
2.2 单因素试验筛选绿原酸提取工艺
在超声提取工艺中影响绿原酸提取量的主要因素有超声提取时间、溶剂浓度和用量[9];另外,在节约资源基础上应尽可能完全地提取药材中的主成分,故还应考虑提取次数的影响。故本研究设计单因素试验考察乙醇体积分数、料液比、超声提取次数及提取时间对绿原酸含量的影响。
2.2.1 乙醇体积分数 准确称取药材粉末1.0 g,在超声提取时间(功率:250 W,频率:50 kHz,下同)为20 min、料液比为1∶10的条件下,分别设定乙醇体积分数为55%、65%、75%、85%、95%,超声提取1次,结果见图2A。

图2 各因素对绿原酸含量的影响Fig 2 Effects of each factor on the content of chlorogenic acid
由图2A可知,乙醇体积分数在较低水平时,随体积分数的增大,绿原酸含量逐步增加;当乙醇体积分数为75%时,绿原酸含量达到最大值;但当乙醇体积分数高于75%后,绿原酸含量逐渐下降。因此,选择65%、75%、85%乙醇进行正交试验考察。
2.2.2 料液比 精密称取药材粉末1.0 g,在乙醇体积分数为75%、超声提取时间为20 min的条件下,料液比分别选择1∶6、1∶8、1∶10、1∶12、1∶14,超声提取1次,结果见图2B。
由图2B可见,当料液比由1∶6增大到1∶10时,绿原酸含量快速增加;当料液比超过1∶10后,绿原酸含量的变化不大,且基本达到最大值。因此,选择料液比为1∶8、1∶10、1∶12进行正交试验考察。
2.2.3 超声提取次数 精密称取药材粉末1.0 g,在料液比为1∶10、乙醇体积分数为75%、超声提取时间为20 min的条件下逐次提取,结果见图2C。
由图2C可见,提取3次后已提取总绿原酸96%的量,故选择提取次数为1、2、3次进行正交试验考察。
2.2.4 超声提取时间 精密称取药材粉末1.0 g,在料液比为1∶10、乙醇体积分数为75%的条件下,分别超声提取10、20、30、40、50 min,结果见图2D。
由图2D可见,随着超声提取时间延长,绿原酸含量呈现先增加后趋于平缓的趋势;提取30 min后,绿原酸含量不再增加。因此,选择超声提取时间为20、30、40 min进行正交试验考察。
2.3 正交试验优化绿原酸提取工艺
在单因素试验的基础上,以绿原酸含量为指标,对乙醇体积分数(A)、料液比(B)、超声提取次数(C)、超声提取时间(D)4个因素进行考察,各因素均确定3个水平。因素与水平见表1;L9(34)正交试验设计与结果见表2;方差分析结果见表3。

表1 因素与水平Tab 1 Factors and levels

表2 正交试验设计与结果Tab 2 Design and results of orthogonal test
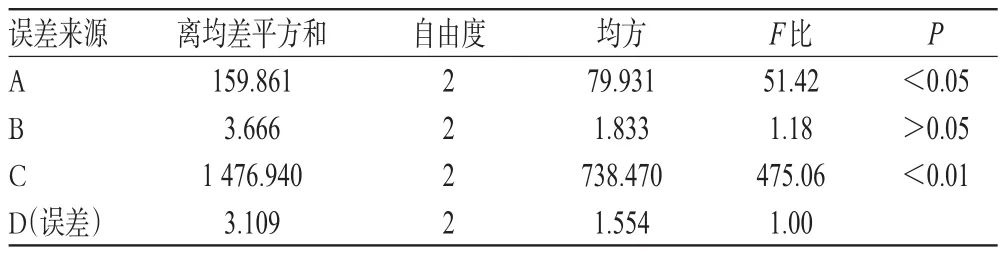
表3 方差分析结果Tab 3 Variance analysis results
由表2可知,影响因素主次顺序为C>A>B>D。由表3可知,对杏花中绿原酸的提取,提取次数影响极显著(P<0.01),乙醇体积分数影响显著(P<0.05),料液比及超声提取时间无显著影响。对因素C,虽然C3大于C2,但其差值较小,故从工业生产的角度考虑选择C2。综合考虑极差分析和方差分析结果,优化出超声波辅助乙醇提取绿原酸的工艺为A2B3C2D2,即用12倍量75%乙醇,超声提取2次,每次30 min。
按上述最优工艺,精密称取同一产地的药材粉末3份,每份100 g,加1 200 mL 75%乙醇,超声提取2次,每次30 min。结果,3次试验中绿原酸含量平均值为77.38 mg/g(RSD=0.58%,n=3)。此结果优于正交试验中各方案结果,提示该绿原酸提取工艺合理、可行。
2.4 不同产地杏花、山杏花中绿原酸含量的测定
分别取10个不同产地及品种药材粉末各1.0 g,精密称定,按照最优提取工艺提取后测定提取液中绿原酸的含量,结果见表4。

表4 不同产地杏花、山杏花提取液中绿原酸含量测定结果(n=3)Tab 4 Determination results of chlorogenic acid content in extracts of P.armeniaca flos and A.sibirica flos from different origins(n=3)
由表3可知,来自沽源、张家口市区、房山的山杏花中绿原酸含量为77.38~83.33 mg/g,其他产地的杏花中绿原酸含量为63.12~70.22 mg/g。山杏花中的绿原酸含量较杏花更高,同一品种不同产地杏花中绿原酸含量差异不大。
3 讨论
笔者在预试验中考察了药材粉碎粒度对提取工艺的影响,结果显示药材粉碎成中粉时所得绿原酸含量最大。另外还在预试验中进行了检测波长和流动相系统及比例的筛选,最后确定检测波长为325 nm、流动相为乙腈-0.1%磷酸水溶液(9∶91)时绿原酸峰形较好且保留时间较适中。
正交试验结果显示,提取2次后绿原酸的含量约为提取1次的1.6倍。方差分析表明,提取次数(因素C)的F为475.06,大于99.00,表明C因素有显著影响。表2虽显示C3结果高于C2,但增加量仅约占C2的0.7%,即2次提取后已将绿原酸基本提取完全,而多提取1次需要消耗更多的溶剂及能源,因此,从节约能源、环保等角度考虑,提取次数选择2次。
绿原酸是金银花主要有效成分之一,其在金银花中的含量为2.227%~2.931%,而在山银花中的含量为3.309%~5.657%[10];另外,绿原酸在杜仲叶中含量也较高,据报道,在年周期中,7月份药材含量最高(可达3.1%),11月份药材最低(1.4%)[11],表明其在不同生长时期含量也不同。本文建立的提取工艺,所得山杏花中绿原酸含量为7.738%~8.333%,杏花中含量为6.312%~7.022%,含量均较上述文献报道的药材高,故二者可为绿原酸提取的药材资源。另外,本试验优化的提取工艺高效便捷、快速环保、合理可行、结果稳定,且所需设备简单、操作性强,检测手段也较为常用,适宜大规模工业化生产,可为今后充分利用杏花资源提供理论依据。
[1] 江苏新医学院.中药大辞典:上册[M].上海:上海科学技术出版社,1977:1103.
[2] 肖培根.新编中药志:第2卷[M].北京:化学工业出版社,2002:365-370.
[3] 刘颖,郭明晔,白根本.绿原酸的研究进展[J].中药材,2012,35(7):1180-1185.
[4] 魏明,杨晓梅,刘佳红,等.绿原酸的药理作用研究进展[J].陕西中医,2016,37(4):511-512.
[5] 王丽萍,郭栋,王果,等.中药绿原酸的研究进展[J].时珍国医国药,2011,22(4):961-963.
[6] 薛峰,李春娜,李鹏收,等.超声提取在中药化学成分提取中的应用[J].中国实验方剂学杂志,2014,20(18):231-234.
[7] 冯子旺,俞力超,李峰,等.正交试验优选桑黄多酚超声提取工艺[J].中国药房,2012,23(3):221-222.
[8] 邱婧然,王志祥,周黎明.正交试验优选白芷中总香豆素的超声提取工艺[J].中国药房,2014,25(7):618-620.
[9] 朱秀丽,皇甫磊落,陈日平,超声技术在中草药提取中的应用[J].西安文理学院学报(自然科学版),2007,10(2):33-36.
[10] 李红霞,王雪芹,李振国,等.不同产地金银花与山银花主要成分的含量比较[J].中国药房,2011,22(31):2935-2937.
[11] 茹建永,乔孝伟.HPLC法测定不同采收时期杜仲叶中绿原酸的含量[J].中国药房,2008,19(27):2112-2113.
Optimization of the Extraction Technology of Chlorogenic Acid in Prunus armeniaca Flos and Comparison of Its Contents from Different Origins and Varieties
LUO Huiyu1,2,YAN Weiwei1,2,XU Peng1,ZENG Chunping1(1.Zhangjiakou Food and Drug Inspection Center,Hebei Zhangjiakou 075000,China;2.School of Pharmacy,Hebei Medical University,Shijiazhuang 050017,China)
OBJECTIVE:To optimize the extraction technology of chlorogenic acid in Prunus armeniaca flos,and compare the contents in P.armeniaca flos from different origins and varieties.METHODS:HPLC was conducted to determine the content of chlorogenic acid in P.armeniaca flos;using the volume fraction of ethanol,the ratio of material to liquid,ultrasonic extraction times and time as factor,the content of chlorogenic acid as index,single factor and orthogonal test were designed to optimize the extraction technology,and verification tests were carried out.The optimized extraction technology was used to extract and compare the contents of chlorogenic acid in Armeniaca sibirica from 7 origins of P.armeniaca flos and 3 origins of Armeniaca sibirica flos. RESULTS:The optimized extraction technology was extracting twice with 12-fold 75%ethanol,30 min each time.Under the conditions,the content of chlorogenic acid can reach 77.38 mg/g(RSD=0.58%,n=3);the contents of chlorogenic acid in A.sibirica flos and P.armeniaca flos were 77.38-83.33 mg/g and 63.12-70.22 mg/g,respectively.CONCLUSIONS:The established extraction technology is reasonable,stable and feasible.The contents of chlorogenic acid in A.sibirica are higher than that in P.armeniaca flos;the contents have no obvious differences in the same variety of A.sibirica from different origins.
Prunus armeniaca flos;Chlorogenic acid;Orthogonal test;Extraction technology;Optimization;Origin;Variety
R284.2
A
1001-0408(2017)07-0975-04
2016-06-19
2016-07-24)(编辑:刘 萍)
*主管药师。研究方向:中药材有效成分的提取与测定。电话:0313-4061038-815。E-mail:904266340@qq.com
DOI10.6039/j.issn.1001-0408.2017.07.32

