红树植物秋茄查尔酮合酶基因克隆及其在盐胁迫下的表达分析
潘德灼, 林伟彬, 谭芳林, 陈 伟,3
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建林业科学研究院,福建 福州 350012;3.福建农林大学分子细胞与系统生物学中心,福建 福州 350002)
红树植物秋茄查尔酮合酶基因克隆及其在盐胁迫下的表达分析
潘德灼1, 林伟彬1, 谭芳林2, 陈 伟1,3
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建林业科学研究院,福建 福州 350012;3.福建农林大学分子细胞与系统生物学中心,福建 福州 350002)
以秋茄(Kandeliacandel)叶片为试验材料,采用RT-PCR的方法获得秋茄查尔酮合酶(chalcone synthase, CHS)基因的cDNA序列,命名为KcCHS, GenBank登录号为KX673194.1.序列分析结果表明,KcCHS基因的cDNA序列长度为1 170 bp,编码389个氨基酸,属于CHS超家族.序列比对结果显示,秋茄与其他物种的CHS基因核苷酸序列具有较高的相似性,平均达到80%以上.系统进化分析显示,KcCHS基因与余甘子CHS基因亲缘关系最近.实时荧光定量PCR分析表明,秋茄叶片KcCHS基因的转录水平随着NaCl浓度的升高而上升.此外,随着NaCl浓度的升高,黄酮类化合物的含量显著增加,羟自由基清除率也明显提高.
秋茄; 查尔酮合酶基因; 克隆; 盐胁迫
盐碱地含有较高浓度的可溶性盐分,会造成土壤水势降低,植物种子的胚轴受到破坏,植物根系活力下降,蛋白形成困难,生理代谢失调等现象,最终导致植物的死亡,因此土壤的盐碱化已成为严重影响农业生产的非生物胁迫因子[1-3].秋茄[Kandeliacandel(L.) Druce]属于红树科(Rhizophoraceae)秋茄属(Kandelia)木本植物,是一种典型的非泌盐红树植物,主要生长于热带和亚热带的海岸潮间带地区[4].由于秋茄长期受到不同盐度海水的浸渍,所以已进化一套独特的耐盐机制以适应盐环境,蕴含着丰富的耐盐基因资源.我国盐碱地占地34.7×106hm2,研究红树植物秋茄的耐盐基因,利用耐盐基因培育耐盐植物,对开发利用盐碱地具有十分重要的意义.
查尔酮合酶(chalcone synthase, CHS)是植物黄酮类化合物生物合成的关键限速酶[5],而黄酮类化合物是一类重要的抗氧化和清除自由基的植物次级代谢产物,在植物生长发育以及抵抗逆境胁迫的过程中发挥重要作用[6-8].前人关于CHS基因的研究主要是探讨该基因对植物花色形成的影响,而关于CHS基因抗逆性的研究鲜见报道.研究发现,杧果(Mangiferaindica)和蜜柑(Citrusunshiu)等植物CHS基因表达量与黄酮类化合物的累积呈正相关[9-10].银杏(Ginkgobiloba)叶片在紫外线B(UV-B)处理下,CHS基因的表达量显著增加[11],但是红树植物的抗逆性与CHS基因表达量间的关系尚未见报道.本实验室前期研究结果表明,秋茄在盐胁迫条件下,与苯丙烷代谢途径相关的黄酮类化合物有明显增加的趋势[12].目前,漆树科、木兰科、芸香科、豆科、十字花科、旋花科、茄科以及葡萄科等多个物种的CHS基因已被克隆[13-15],但是未见秋茄CHS基因的研究报道.鉴于此,本研究以秋茄为材料,根据转录组测序结果(CL8403.Contig2_All)设计引物,RT-PCR扩增CHS基因,克隆并测序后得到CHS基因的cDNA序列,进行生物信息学分析,再利用实时荧光定量PCR技术(qRT-PCR),探索不同盐浓度条件下秋茄CHS基因表达量的变化规律,以期揭示秋茄的耐盐机制,也为培育作物耐盐品种提供依据.
1 材料与方法
1.1 材料
秋茄胚轴采自福建省泉州市洛阳河红树林保护区(24°58′ N、118°39′ E).选择外观完好、无虫害、无机械损伤及大小相近的成熟胚轴,培养于洁净的砂子中,培养条件:温度25~30 ℃,光周期 光照16 h,黑暗8 h,光照强度 1 200~1 250 μmol·m-2·s-1,相对湿度70%.每盆(30×42×14 cm)砂子种植胚轴15株,每天浇水2次,每隔2天换1次Hoagland营养液(每盆1 L).待幼苗第2对叶片完全展开时进行盐胁迫处理,以Hoagland营养液为基本溶液,添加浓度为200、500 mmol·L-1NaCl,以无添加NaCl为对照组,每个处理设3个重复,处理72 h后采集完好的叶片,液氮速冻后保存于-80 ℃冰箱备用.
1.2 总RNA提取和CHS基因克隆
应用CTAB-LiCl沉淀法提取秋茄叶片总RNA[16],采用TaKaRa公司PrimeScriptTMRT Reagent Kit(Perfect Real Time; TaKaRa公司,日本)试剂盒反转录合成cDNA第一链,以cDNA第一链为模板进行PCR扩增.根据秋茄叶片CHS基因的转录组序列(CL8403.Contig2_All)设计特异性引物,上游引物(F):5′-AATGGTGACGGTTGATGAAG-3′ ,下游引物(R):5′-ATGACATGGACTGGAGTGATA-3′ .PCR扩增的参数为:95 ℃变性3 min,1个循环;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 90 s,40个循环;72 ℃延伸5 min.PCR产物通过1%的琼脂糖凝胶电泳检测后,应用北京BioTeKe生物技术有限公司的多功能DNA纯化回收试剂盒(离心柱型)回收纯化目的DNA片段.将目的DNA片段连接到pMD18-T载体,采用热激法转化大肠杆菌DH5α感受态细胞(购自华大基因).Amp抗性筛选和X-gal/PTG蓝白斑筛选后,选取白色菌落进行液体培养.采用通用引物BcaBEST Primer RV-M和BcaBEST Primer M13-47进行PCR检测阳性克隆.选取转化成功的菌液,按照泰京生物技术有限公司的质粒小提试剂盒的使用说明书,提取质粒并通过1%的琼脂糖凝胶检测后,检测合格的质粒溶液由深圳华大基因公司测序.
1.3 生物信息学分析
应用InterProScan在线工具(http://www.ebi.ac.uk/interpro/search/sequence-search)分析氨基酸序列的结构域和功能位点,应用NCBI中BLAST在线工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索CHS基因编码的同源氨基酸序列,利用MEGA 6.06软件的最大似然法(maximum likelihood, ML)构建系统进化树.
1.4 qRT-PCR分析
秋茄叶片CHS基因的qRT-PCR分析在Bio-Rad CFX96荧光定量PCR仪上进行,方法参照荧光试剂盒SYBR Premix Ex TaqTM(Tli RNaseH Plus,购自TaKaRa公司)的操作说明书.引物CHS-F:5′-TCCAGGGCAGAAAGACCA-3′ ,CHS-R:5′-TCCTCGGAT-TGCGTAGTG-3′ ,选择Actin基因作为内参,引物Actin-F:5′-GGCAGATAGATGCTTATG-TAGGTG-3′ ,Actin-R:5′-TGTTTGCTTTAGGGTTGAGTGG-3′.反应程序:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 34 s,40个循环;65 ℃升至95 ℃,每升高0.5 ℃,恒温保持5 s.试验设3个重复,基因相对表达量采用2-△△Ct法[17]进行计算.
1.5 生理指标测定及数据分析
黄酮类化合物含量测定参考赵亚婷等方法[18].羟自由基清除率参照郭亚力等方法[19].每个试验均进行3次重复.采用EXCEL软件处理试验数据,利用DPS 14.5软件分析试验数据,P<0.05为差异显著,P<0.01为差异极显著.
2 结果与分析
2.1 秋茄叶片CHS基因的克隆
以500 mmol·L-1NaCl处理72 h后的秋茄叶片样本cDNA第一链为模板,用引物F:5′-AATGGTGACGGTTGATGAAG-3′,R:5′-ATGACATGGACTGGAGTGATA-3′进行PCR扩增,可扩增出1条约1 200 bp的特异性条带,条带大小符合预期结果(图1-A).
目的条带片段回收后,连接到pMD 18-T载体,热激转化大肠杆菌DH5α,经培养后挑选阳性克隆接种于含100 μg·mL-1氨苄青霉素的LB液体培养基中,振荡培养后进行菌液PCR,鉴定转化结果.结果如图1-B所示,扩增条带约1 200 bp,与预期结果相符,说明目的条带连接pMD 18-T载体后成功转化大肠杆菌DH5α.
根据菌液PCR的结果,选取转化成功的大肠杆菌培养液,提取质粒后电泳,可以看出,质粒条带清晰,说明成功获得了浓度较高的重组质粒,可以用于测序(图1-C).

M:DNA分子标记;1:RT-PCR扩增CHS基因(A);2:菌液PCR筛选CHS基因阳性克隆(B);3:重组质粒(C).
2.2 CHS基因序列的生物信息学分析
将重组质粒送至深圳华大基因公司测序,结果表明,秋茄CHS基因长度为1 170 bp,编码389个氨基酸(图2),命名为KcCHS,序列的GenBank登录号为KX673194.1.根据InterProScan在线软件分析KcCHS编码产物的结构域和功能位点,研究表明,秋茄CHS蛋白具有典型的CHS蛋白保守结构域:N-末端结构域(Asp5-Pro228)、C-末端结构域(Glu238-Val387)、植物Ⅲ型聚酮合酶的结构域(Val2-Ile389)和查尔酮/二苯乙烯合成酶的活性位点(Arg156-Arg172).KcCHS编码的产物属于植物Ⅲ型聚酮合酶家族即查尔酮合酶超家族,该家族包括柚皮素——查尔酮合酶(naringenin-chalcone synthases, CHSs)和二苯乙烯合成酶(stilbene synthases, STSs)两大类.
序列相似性分析发现,秋茄CHS基因序列与其他15种植物CHS基因的核苷酸序列的相似性为80%~84%,其中与胡杨(Populuseuphratica)CHS基因的相似性最高,为84%,而与变叶海棠(Malustoringoides)、猕猴桃(Actinidiachinensis)和浙江红花油茶(Camelliachekiangoleosa)CHS基因的相似性最低,为80%(表1).这表明各种植物的CHS基因序列比较保守.

左边数字代表核苷酸数;右边数字代表氨基酸数.
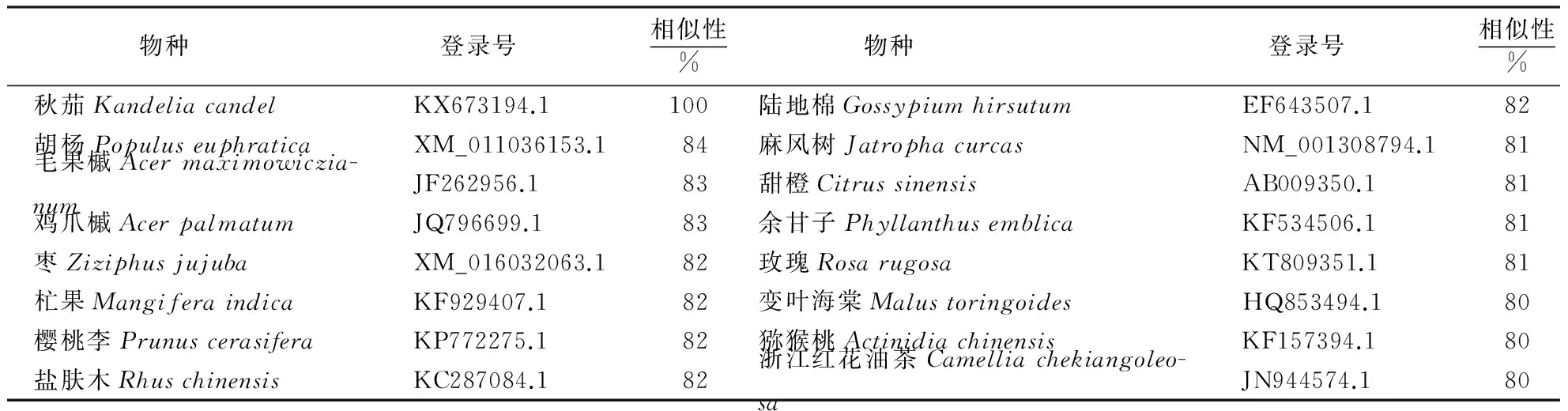
表1 秋茄CHS基因与15种其他植物CHS基因核苷酸序列相似性比较
采用MEGA 6.06软件构建秋茄和其他15种植物CHS基因的系统进化树,由图3可知,秋茄与余甘子(Phyllanthusemblica)CHS基因在进化上靠得最近,并且与麻风树(Gossypiumhirsutum)和胡杨CHS基因聚成一个分支,同时,枣(Ziziphusjujuba)自成一个分支,其他11种植物的CHS基因又聚成2个分支.这说明秋茄和木本植物的余甘子亲缘关系最近,与麻风树和胡杨的亲缘关系较近,与其他12种植物的亲缘关系较远.
2.3 KcCHS相对表达量及生理指标分析
为了研究KcCHS相对表达量与盐胁迫过程中NaCl浓度的关系,以秋茄肌动蛋白Actin作为内参进行模板定量,对盐胁迫下秋茄叶片CHS基因进行qRT-PCR分析.图4-A表明,随着NaCl浓度的升高,KcCHS相对表达量呈极显著上升趋势(P<0.01),与对照组相比,200 mmol·L-1NaCl和500 mmol·L-1NaCl处理的KcCHS相对表达量分别上升了1.39倍和4.01倍.由图4-B结果显示,盐处理下秋茄叶片黄酮类化合物的含量随着盐浓度的上升而显著上升,而且在500 mmol·L-1NaCl处理下的黄酮类化合物的含量极显著高于对照组(P<0.01).此外,本研究还对不同盐处理下的秋茄叶片的羟自由基清除率进行分析,结果发现200 mmol·L-1和500 mmol·L-1NaCl处理的叶片,羟自由基清除率均显著高于对照(P<0.05,图4-C).

图3 秋茄和其他15种植物的CHS核苷酸序列的系统进化树

不同小写字母表示组间显著差异(P<0.05) ;不同大写字母表示组间极显著差异(P<0.01).
3 讨论
研究发现植物CHS的保守结构域含有活性位点Cys164、His303和Asn336,具有CHS基因所必需的活性位点Thr169、Ile309和Val342,以及CHS的信号序列GFGPG等[20].本研究从红树植物秋茄叶片中克隆了KcCHS基因,该基因编码389个氨基酸,具有典型的CHS蛋白保守结构域如N-末端结构域(Asp5-Pro228)、C-末端结构域(Glu238-Val387)等.N-末端结构域含有1个活性位点Cys164和1个CHS基因所必需的活性位点Thr169.N-末端结构域的不同可造成CHS基因活性的不同,是CHS功能活性的关键部位,其中N-端结构域中保守的Cys164在激活CHS的催化活性以及香豆酰辅酶A结合位点活性中起着至关重要的作用[21].同时,C-末端结构域含有2个活性位点His303和Asn336,以及2个CHS基因所必需的活性位点Ile309和Val342.这些位点能够促进底物与查尔酮合酶的结合[20].另外,秋茄CHS蛋白C-末端含有GFGPG信号序列.与此同时,对秋茄与其他15种植物CHS基因的核苷酸序列的相似性进行分析,结果表明秋茄与其他物种CHS基因的相似性较高,达80%~84%.此外,从秋茄CHS和其他15种植物CHS核苷酸序列的系统进化树可以看出,红树科秋茄与大戟科余甘子亲缘关系最近,与麻风树和胡杨的亲缘关系较近,与其他12种植物的亲缘关系较远.这些结果表明,植物CHS基因是一种高保守的基因家族,在植物的生长发育过程中有着重要作用,同时说明红树植物秋茄的CHS基因在进化过程中发生了一定的变异.
大量研究表明,CHS基因在植物色素形成过程中发挥重要作用,其作用机制研究得较深入[8,10,13-15].矮牵牛(Toreniahybrida)花色素合成因为CHS基因和二氢黄酮醇4-还原酶基因的共同抑制而受到影响,从而改变了花的颜色[15].此外,CHS基因在防UV照射、抵御病原真菌侵染等抗逆方面也起着重要作用[22-24],高梁(Sorghumvulgare)幼苗被玉米小斑病病菌(Bipolarismaydis)侵染后CHS基因的表达量明显增加[23];红萝卜在紫外线A的照射下CHS基因的表达水平显著上调[24].本研究发现随着盐胁迫的增强,KcCHS的相对表达量呈极显著上升趋势.另外,研究表明,红砂(Reaumuriasoongorica)在UV-B辐射胁迫下,黄酮类化合物含量显著增加[25];在干旱胁迫下酸枣(ZiziphusjujubaMill.)叶片黄酮类化合物含量显著增加[26];在盐胁迫下烤烟NC89叶片中黄酮类化合物含量也明显增加[27].因此黄酮类化合物含量的增加有助于提高植物体抵抗不利生长环境的能力.本研究表明,随着NaCl浓度的升高,黄酮类化合物的含量显著增加,羟自由基清除率也明显提高.总之,这些结果说明秋茄能够通过增强黄酮类化合物的合成代谢来适应盐环境,是秋茄耐盐性的一个特征,意味着KcCHS与秋茄抵抗盐胁迫的能力有关,为揭示秋茄的耐盐机制提供理论依据.
[1] PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants: a review[J]. Ecotoxicology and Environmental Safety, 2005,60(3):324-349.
[2] ZHU J K. Plant salt tolerance[J]. Trends in Plant Science, 2001,6(2):66-71.
[3] WANG L, LIANG W, XING J, et al. Dynamics of chloroplast proteome in salt-stressed mangroveKandeliacandel(L.) Druce[J]. Journal of Proteome Research, 2013,12(11):5 124-5 136.
[4] CHEN L, WANG W, LIN P. Photosynthetic and physiological responses ofKandeliacandelL. Druce seedlings to duration of tidal immersion in artificial seawater[J]. Environmental and Experimental Botany, 2005,54(3):256-266.
[5] FERRER J L, JEZ J M, BOWMAN M E, et al. Structure of chalcone synthase and the molecular basis of plant polyketide biosynthesis[J]. Nature Structural & Molecular Biology, 1999,6(8):775-784.
[6] AGATI G, AZZARELLO E, POLLASTRI S, et al. Flavonoids as antioxidants in plants: location and functional significance[J]. Plant Science, 2012,196:67-76.
[7] 张党权,谭晓风,王晓红.查尔酮合酶与查尔酮异构酶基因特征及转基因应用[J].中南林业科技大学学报(自然科学版),2007,27(2):87-91.
[8] 罗群凤,胥猛,冯源恒,等.北美鹅掌楸LtCHS基因的克隆及生物信息学与组织表达特征分析[J].林业科学,2015,51(5):37-45.
[9] 梅志栋,张贺,刘晓妹,等.杧果查尔酮合成酶基因(CHS1)的克隆与表达分析[J].果树学报,2015,32(6):1 077-1 084.
[10] WANG Y, LI J, XIA R. Expression of chalcone synthase and chalcone isomerase genes and accumulation of corresponding flavonoids during fruit maturation of Guoqing No.4 satsuma mandarin (CitrusunshiuMarcow)[J]. Scientia Horticulturae, 2010,125(2):110-116.
[11] PANG Y, SHEN G, WU W, et al. Characterization and expression of chalcone synthase gene fromGinkgobiloba[J]. Plant Science, 2005,168(6):1 525-1 531.
[12] WANG L, PAN D, LV X, et al. A multilevel investigation to discover whyKandeliacandelthrives in high salinity[J]. Plant, Cell and Environment, 2016,39: 2486-2497..
[13] TANAKA Y, SASAKI N, OHMIYA A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids[J]. The Plant Journal, 2008,54(4):733-749.
[14] 胡朝阳,周友凤,龚一富,等.紫色马铃薯查尔酮合成酶基因(CHS)的克隆及分析[J].中国农业科学,2012,45(5):832-839.
[15] SUZUKI K, XUE H, TANAKA Y, et al. Flower color modifications ofToreniahybridaby cosuppression of anthocyanin biosynthesis genes[J]. Molecular Breeding, 2000,6(3):239-246.
[16] JORDON-THADEN I E, CHANDERBALI A S, GITZENDANNER M A, et al. Modified CTAB and TRIzol protocols improve RNA extraction from chemically complex Embryophyta[J/OL]. Applications in Plant Sciences, 2015,3(5).doi: 10.3732/apps.1400105
[17] LIVAK K J, SCHNUTTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001,25:402-408.
[18] 赵亚婷,朱璇,马玄,等.采前水杨酸处理对杏果实抗病性及苯丙烷代谢的诱导[J].食品科学,2015,36(2):216-220.
[19] 郭亚力,李聪,欧灵澄,等.3种分光光度法对天然抗氧化物质抗自由基性能的分析检测[J].分析试验室,2004,23(10):43-48.
[20] 宋婷婷,沈红香,姚允聪,等.苹果属观赏海棠McCHS基因的克隆及实时定量表达[J].园艺学报,2010,37(2):269-276.
[21] GROTEWOLD E. The genetics and biochemistry of floral pigments[J]. Annual Review of Plant Biology, 2006,57:761-780.
[22] DAO T T H, LINTHORST H J M, VERPOORTE R. Chalcone synthase and its functions in plant resistance[J]. Phytochemistry Reviews, 2011,10(3):397-412.
[23] CUI Y, MAGILLl J, FREDERIKSEN R, et al. Chalcone synthase and phenylalanine ammonia-lyase mRNA levels following exposure of sorghum seedlings to three fungal pathogens[J]. Physiological and Molecular Plant Pathology, 1996,49(3):187-199.
[24] ZHOU B, LI Y, XU Z, et al. Ultraviolet A-specific induction of anthocyanin biosynthesis in the swollen hypocotyls of turnip (Brassicarapa)[J]. Journal of Experimental Botany, 2007,58(7):1 771-1 781.
[25] 刘美玲,曹波,刘玉冰,等.红砂黄酮类物质代谢及其抗氧化活性对UV-B辐射的响应[J].中国沙漠,2014,34(2):426-432.
[26] 王改利,魏忠,贺少轩,等.土壤干旱胁迫对酸枣叶片黄酮类代谢及某些生长和生理指标的影响[J].植物资源与环境学报,2011,20(3):1-8.
[27] 胡庆辉,王程栋,王树声,等.NaCl胁迫下鲜烟叶中多酚物质含量及PAL和PPO活性变化[J].中国烟草科学,2013,34(1):51-55.
(责任编辑:吴显达)
Cloning and expression analysis of chalcone synthase gene from mangrove treeKandelia candelundersaltstress
PAN Dezhuo1, LIN Weibin1, TAN Fanglin2, CHEN Wei1,3
(1.College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2.Fujian Academy of Forestry, Fuzhou, Fujian 350012, China; 3.Molecular Cell and System Biology Center, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
The accumulation of flavonoid plays an important role in physiological accommodation whenKandeliacandelsuffered from high-salinity stress. In this study, a cDNA sequence of chalcone synthase (CHS) gene from the leaves ofK.candelwas cloned using RT-PCR, namedKcCHS(GenBank accession. KX673194.1). Sequence analysis indicated that the cDNA sequence ofKcCHScontained an open reading frame (ORF) of 1170 bp encoding 389 amino acids which belonged to theCHSsuperfamily. Sequence alignment analysis revealed thatCHSfromK.candelshared more than 80% homology withCHSfrom other plant species. The phylogenetic analysis based on the cDNA sequences showed thatKcCHShad the closest genetic relationship with theCHSfromPhyllanthusemblica. Real-time quantitative PCR was carried out to analyze the expression level ofKcCHSunder different NaCl conditions, showing that its expression level increased with elevated NaCl concentration. Furthermore, the content of flavonoids and the scavenging rate of hydroxyl radical in NaCl treatments both increased compared with the control. These results suggested that the up-regulation expression ofKcCHSmight improve salt tolerance ofK.candel.
Kandeliacandel; chalcone synthase gene; cloning; salt stress
2016-08-15
2016-09-30
林业公益性行业科研专项经费(201504415).
潘德灼(1982-),男,博士研究生.研究方向:植物生理与分子生物学.Email:pdz_006@163.com.通讯作者陈伟(1955-),教授,博士,博士生导师.研究方向:植物生理与分子生物学.Email: weichen909@163.com.
S718.43
A
1671-5470(2017)02-0180-07
10.13323/j.cnki.j.fafu(nat.sci.).2017.02.010

